3株H9N2亚型禽流感病毒基因组分子特征及遗传进化分析
高鑫鑫,王艳文,郭 晶,赵聪慧,王文婷,刘文强,李旭勇
(聊城大学农学院,山东 聊城 252000)
A型流感病毒是一种RNA病毒,根据病毒表面的血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuramidinase,NA)分为不同的亚型(H1~H18和N1~N11)。除了在蝙蝠中分离的H17N10和H18N11亚型流感病毒[1-2],在禽类可检测到所有亚型流感病毒(H1~H16和N1~N9)。流感病毒不仅能感染鸡、鸭等禽类,还能够感染人。H1N1、H2N2和H3N2亚型流感病毒可在人类传播,在历史上引起了数次大流行[3]。H5N1、H5N6、H7N9和H9N2等亚型禽流感病毒(Avian influenza virus,AIV)能够直接从动物感染人类,表明这些亚型的病毒可能具有通过进一步进化而成为引起新的大流行病的潜在威胁[4-6]。1966年,首次在家禽中发现H9N2亚型流感病毒[7]。研究表明,H9N2 AIV能够为感染人类的H5N1、H5N6、H7N9 和H10N8等亚型AIV提供内部基因[8-12]。同时,本课题组前期研究发现,H9N2同H4N6 AIV共感染家禽后在宿主体内会发生高频率的基因重组,并产生比野生型病毒具有更高毒力的子代重组病毒[13]。
为更深入了解H9N2 AIV遗传演化规律,本试验于2017—2019年在活禽市场采集样品,分离选取3株 H9N2 AIV进行全基因组序列测定、遗传进化及关键氨基酸位点分析,总结了数据库中历年H9N2分离株HA基因关键氨基酸位点的变异规律,为进一步了解H9N2 AIV的进化、变异规律提供理论依据。
1 材料与方法
1.1 病毒及鸡胚 试验中所用的3株H9N2分离株A/chicken/Weifang/862/2017(简称CK/862/17)来源于潍坊某养殖场病鸡组织、毒株A/chicken/Liaocheng/844/2018(简称CK/844/18)和毒株A/pigeon/Liaocheng/168/2019(简称PG/168/19)均来源于山东省农贸市场,由本实验室分离鉴定并保存。其中CK/862/17和CK/844/18宿主为鸡,PG/168/19来源于鸽子。SPF鸡胚,购自济南斯派福瑞禽业科技有限公司。
1.2 试剂 RNA提取试剂盒(TIANamp Virus RNA Kit,DP315-R),购自北京天根生化科技有限公司;反转录试剂盒(ReverTra Ace qPCR RT Kit)和PCR混合剂(Quick Taq®HS DyeMix),均购自TOYOBO科技有限公司;分子量Marker,购自TaKaRa公司;PCR产物纯化试剂盒,购自OMEGA公司;测序反应由生工生物工程(上海)股份有限公司完成。
1.3 病毒的分离 采集山东活禽市场售卖家禽的泄殖腔和咽喉拭子;取发病鸡气管、喉头、肺组织置于前期加入双抗的PBS缓冲液中,以60 Hz的频率研磨2 min。然后以8 000 r/min的转速离心5 min,取上清液0.25 mL接种于10日龄的鸡胚中,置于37 ℃培养箱培养48 h后收取鸡胚尿囊液,分装并置于-80 ℃保存。
1.4 RT-PCR 鉴定及序列测定 取尿囊液提取其RNA,并反转录成cDNA。利用禽流感病毒HA的鉴定引物对其亚型进行鉴定。接着利用H9N2亚型病毒各基因节段测序引物以50 μL的体系进行PCR扩增,50 μL体系:cDNA 2 μL,10 μmol/L上下游引物各1 μL,Mix 25 μL,H2O 21 μL。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s;退火温度58 ℃,退火时间30 s,68 ℃ 延伸1 min 30 s,共30个循环;72 ℃延伸10 min。将PCR产物于1%琼脂糖凝胶中进行电泳,并将胶块置于凝胶成像仪下观察,将特异性条带胶回收纯化后送至测序公司利用测序引物进行病毒的全基因序列测定。
1.5 遗传演化分析 将各基因节段测序结果导出后利用DNASTAR 7.1中的MegAlign程序对8个基因片段序列拼接,应用NCBI中BLAST检索相似性序列以及代表性毒株序列,利用MEGA 7.0软件对各基因节段的序列进行同源性及关键位点的分析,并利用Neighbor-joining 法绘制下载序列与分离毒株序列8个基因片段的遗传进化树。
2 结果
2.1 全基因组序列的测定
2.1.1 核苷酸同源性分析 从2017—2019年分离的H9N2 AIV中,根据分离年份、地区和宿主,选出3株 分离株CK/862/17、CK/844/18和PG/168/19进行全基因组序列的测定,在NCBI中BLAST上比对分析,绘制8个基因节段遗传进化树。结果显示,CK/862/17和CK/844/18的8个基因节段与近几年流行的H9N2病毒高度同源;PG/168/19的8个基因节段来源复杂,PB2和PB1与H7N9同源性较高,其中PB2与A/Chicken/Anhui/AH395/2017(H7N9)(GenBank 登录号MG575543.1)同源性为98.38%,PB1与A/Changsha/26/2017(H7N9)(GenBank 登录号MF370244.1)同源性为98.90%(表1)。

表1 与分离株各基因片段的核苷酸同源性最高的病毒株
2.1.2 分离株与疫苗株HA、NA基因同源性分析 3株分离株与当前市场上的疫苗株进行HA、NA基因序列比对分析表明,与LG1株的同源性最高,HA基因序列的同源性为94.1%~95.1%,NA基因序列的同源性为93.9%~95.3%,但分离株与其他疫苗株的同源性较低(表2)。另外近年来,H9N2亚型AIV经常在已免疫过疫苗的鸡群中分离出[14],说明目前流行的H9N2病毒与早期H9N2疫苗毒株相比已发生抗原的改变,致使现有的疫苗保护效力降低或者失效。这就需要企业生产疫苗与流行毒株的抗原性相匹配。

表2 3 株分离株与疫苗株 HA、NA基因的同源性比较
2.2HA基因的分子特征、同源性和遗传分析
2.2.1HA基因序列的进化分析 3株H9N2分离株与参考毒株的HA基因序列进行遗传进化分析,绘制基因进化树(封三彩版图1A)。HA基因的遗传进化分为欧亚种系和北美种系,3株分离株的遗传距离较近,均属于欧亚分支的Y280亚群。3株分离株HA基因的核苷酸同源性为95.6%~98.0%。
2.2.2 HA蛋白关键氨基酸位点分析 HA蛋白裂解位点的氨基酸组成均为RSSR↓GLF,符合低致病性AIV的特征。与早前分离的经典毒株相比,3株分离株的受体结合位点在第101、138、153、155、194、195位和第228位相对保守,第183位突变为N,第190 位突变为T。左侧壁(第240~245位)的氨基酸组成形式均为NGLMGR,右侧壁(第138~142位)为GTSTA。3株分离株第226位受体结合位点均为L,具有与哺乳动物α,2-6唾液酸受体结合的特征(表3)。从NCBI数据库中下载2019年之前所分离的H9N2流感病毒的HA蛋白氨基酸序列,对其第183、190位和第226位氨基酸残基位点分析表明:H9N2流感病毒的受体结合位点显现多样性,其中H9N2 AIV的HA蛋白第226位氨基酸主要以Q和L为主,但也出现了一些Q和L 之外的氨基酸,如M、F等新的氨基酸。从整体趋势上来看,H9N2亚型流感病毒HA蛋白的第183位点由早年的H逐渐向N转化,第109位点主要比例由A向T转化,第226位氨基酸由早年的Q突变为L,普遍具有了与哺乳动物α,2-6唾液酸受体结合的特征(封三彩版图2A~2C)。
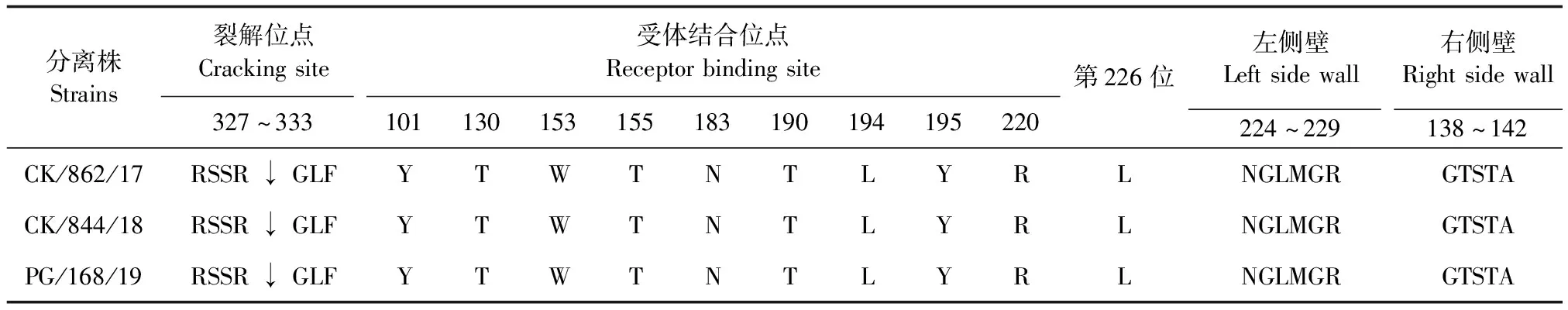
表3 分离株HA蛋白的氨基酸序列分析
对3株分离株HA蛋白潜在糖基化位点分析表明(表4),HA1蛋白上具有6个共同的潜在糖基化位点,分别为第21、74、133、290、297位和第305位。HA2蛋白上具有1个共同的潜在糖基化位点,为第484位,其中分离株CK/844/18在第543位由NGS突变为NGR,造成了1个糖基化位点的缺失。3株分离株HA蛋白的第202~204位氨基酸由NRT突变为NRI,造成1个糖基化位点的缺失;第295~298位由NCP突变为NCS,新增1个糖基化位点,这与数据库中分离株的变化趋势一致(封三彩版图2D)。

表4 分离株HA蛋白的潜在糖基化位点分析
2.3NA基因的分子特征和遗传分析 同HA基因的遗传进化树相类似,NA基因的遗传进化树也分为欧亚种系和北美种系。3株分离株NA基因均属于欧亚分支的Y280亚群,核苷酸同源性为97.3%~97.6%(封三彩版图1B)。3株分离株共有的NA蛋白中有6个糖基化位点,分别为第44、69、86、146、200位和第234位。分离株CK/862/17在第404位由S突变为A,造成1个潜在糖基化位点的缺失。3株NA蛋白的第256位氨基酸由S突变为R,导致第256位糖基化位点的缺失(表5)。3株分离株的耐药性相关基因位点未发生突变,第274位仍为S,第294位仍为N。

表5 分离株NA蛋白的潜在糖基化位点分析
2.4 分离株内部基因遗传进化分析 3株分离株的内部基因的同源性依次为M94.2%~97.8%、NP97.3%~98.7%、NS97.4%~98.3%、PA96.3%~96.9%、PB1 94.8%~97.6%、PB2 96.4%~96.8%。分离株CK/844/18与CK/862/17各基因片段的同源性略高于PG/168/19。3 株分离株的内部基因呈现多样性的特点,PB1、PA、NP来自F98亚系(图3B~3D);M基因来自G1亚系。分离株的PB2、NS基因与参照标准流感病毒毒株的遗传进化关系比较 远,形成单独的Unknown Avian分支。3株分离株的PB2蛋白的第340位和第627位存在差异,CK/862/17与PG/168/19的第340位为K,CK/844/18的第340位为R;CK/844/18与CK/862/17的第627位为E,PG/168/19的第627位为V;第588位均为V,第701位均为D;3株分离株的NS 蛋白中第114、124位和第212位氨基酸分别为S、V、P。第588位的突变使病毒在哺乳动物宿主体内的复制、致病及传播能力增强,NS基因中第114、124位和第212位的突变使干扰素刺激基因(ISGs)mRNA 的转录活性受到抑制。

图3 3株H9N2 AIV的 PB2(A)、PB1(B)、PA(C)、NP(D)、M(E)和NS(F)基因的系统发育分析
3 讨论
H9N2病毒为低致病性AIV,家禽感染H9N2后,生产性能和免疫力降低,易引起继发性细菌感染导致较高的死淘率,严重影响了养禽业的发展。H9N2病毒的内部基因易与其他亚型发生基因重组,形成一些高致病力的新型流感病毒。
本试验3株分离株HA蛋白的第226位点均为L,能够与哺乳动物α,2-6唾液酸受体结合,这与早前分离的H9N2亚型禽流感的特征一致[14],促使人感染的可能性急剧增加。同时3株分离株HA蛋白在第295~298位氨基酸由NCP突变为NCS,新增了1个糖基化位点,其可能与病毒感染宿主和宿主免疫反应抗原递呈有关[15],相关机制仍有待于进一步研究。PB2蛋白差异性较大,其中T271A、R340K、A588V、E627K、D701N等特异性位点的突变能够使病毒在哺乳动物宿主体内的复制、致病及传播能力增强[16-17]。NS蛋白中P114S、M124V、S212P氨基酸突变与H9N2亚型AIV拮抗宿主先天性免疫应答密切相关,它能够显著抑制干扰素刺激基因(ISGs)mRNA的转录活性[18]。同时有研究发现,G1-like的PB2和M基因在出现新基因型方面具有重要意义[19-20]。H9N2亚型AIV在我国流行广泛,致病性和感染哺乳动物的能力逐渐增强,对我国公共卫生安全造成的潜在危险也在逐渐增强,此研究从基因水平为探索H9N2 流感病毒的遗传进化规律及防控提供科学依据。

