8种试剂盒的水稻DNA提取效果比较研究
肖婉钰 孙艺嘉 周贤玉 任海龙 邹集文 张晶 许东林

摘 要:水稻种子DNA的提取质量直接影响水稻种子真实性检验的效果。选取市面上常见的8种植物基因组DNA提取试剂盒(K1~K8)进行水稻种子DNA提取效果比较研究,结果表明,试剂盒K2提取得到的水稻种子DNA在0.8%琼脂糖凝胶电泳检测中,条带最明亮、整齐且无拖尾,质量最高,试剂盒K8、K3的提取质量次之;试剂盒K1、K6提取的水稻种子DNA纯度最佳,试剂盒K2、K3、K5、K7、K8的提取产物纯度次之。因此,试剂盒K2的提取效果最好,K8、K3次之,8种试剂盒均适用于基于SSR片段分析的水稻品种真实性检测。
关键词:水稻;DNA提取试剂盒;品种真实性
文章编号:1005-2690(2021)18-0005-02 中国图书分类号:S511 文献标志码:B
种子真实性检测是加强知识产权保护、促进种业健康发展的保障[1]。目前,我国水稻、玉米等大宗农作物已普遍开展种子真实性检测,无论是目前主流第二代分子标记即SSR(简单重复序列)的检测方法,还是新一代SNP分子标记的检测方法,都需要高质量的基因组DNA作为基础。因此,确保植物DNA提取的质量是种子真实性检测能否保质保量完成的关键因素。
在种子真实性检测中,选取的材料大多为水稻新鲜叶片、幼苗或水稻幼嫩茎 [2-7]。但将水稻的种子播种,发苗之后再进行核酸抽提耗时太久,如能直接用水稻种子抽提核酸,将大大提升试验效率,但是在水稻的各部位组织中,种子稻米的成分最为复杂,含更多的淀粉等物质,所以提取水稻种子基因组DNA 难度更大。通过比较不同DNA试剂盒水稻种子DNA的提取效果,旨在为今后种子真实性检测提供技术支持。
1 材料和方法
1.1 试验材料
以10个杂交水稻品种的干种子为试验材料,材料均来自于2020年广东省种子监督抽查的备份样品。试验样品编号如下,A:深优9516,B:野香优莉丝,C:恒丰优778,D:荃优丝苗,E:创优华占,F:隆优3206,G:广8优金占,H:软华优6100,I:广8优金占,J:恒丰优387。
1.2 单粒种子DNA提取
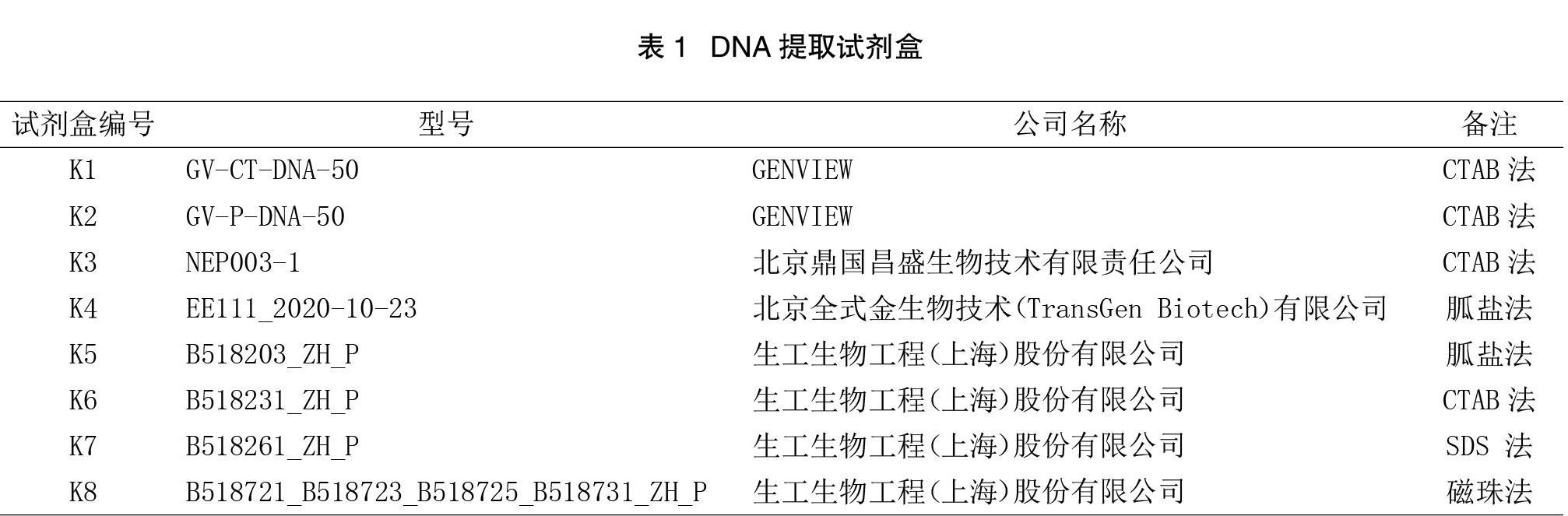
取 1 粒水稻干种子,用MP FastPrep-24组织匀浆器磨成粉末,再用8种DNA提取试剂盒(见表1)分别提取上述10个水稻品种的DNA,按照每种试剂盒中的使用说明来进行提取,共获得80个水稻基因组DNA。
1.3 DNA产物质量测定
1.3.1 琼脂糖凝胶电泳检测
用超纯水将80个DNA模板稀释到50 ng/μL,吸取5 μL DNA 与1 μL 上样缓冲液混匀, 0.8%的琼脂糖凝胶,85 V电压,电泳20 min,用Proteinsimple AlphaImager HP凝胶成像系统上观察和拍照。
1.3.2 DNA 质量浓度和纯度的测定
用Thermo Scientific NanoDrop One超微量分光光度计检测80个DNA 模板的质量浓度和纯度。其中A260/A280的大小代表DNA 纯度;DNA 模板在260 nm 的吸光度代表DNA 质量浓度,A260=1代表DNA 质量浓度为50 ng/μL[8]。
1.4 水稻SSR的PCR扩增与毛细管电泳检测
引物来自于2014 年原农业部水稻品种鉴定标准《水稻品种鉴定技术规程:SSR 标记法NY/T 1433—2014》。选用5 對引物进行PCR 扩增,见表2。
20 μL 反应体系:10×buffer 2μL,dNTP0.5 μL,Taq酶0.5 μL,10 μmol/L的正向荧光引物1 μL,1 μL 10 μmol/L的反向普通引物,50 ng/μL 的模板DNA1 μL,加无菌水补齐至20 μL。
扩增条件:预变性94 ℃ 4 min;变性94 ℃ 45 s,退火50~67 ℃ 45 s,延伸72 ℃ 1 min,30 个循环;72 ℃延伸8 min。
上机准备:PCR 结束以后,取一块96 孔板加入70%乙醇至总体积为50 μL,震荡充分混匀。3 700 r/min,4 ℃离心30 min。静置15 min 后加入内标LIZ500 和HiDi,振荡充分混匀,离心10 s。放入PCR 仪,95 ℃ 条件下4 min 变性。放到Thermo Scientific ABI 3500中进行毛细管电泳。
2 结果与分析
2.1 DNA 提取物琼脂糖凝胶电泳检测结果
由图1可见,试剂盒K2呈现出整齐清晰的条带,无拖尾现象;试剂盒K3和K8条带亮度较弱,也无拖尾现象;试剂盒K7条带明亮,但拖尾现象严重;试剂盒K1、K4、K5、K6条带亮度很弱,有明显拖尾现象。
2.2 DNA提取物浓度和纯度检验结果
由表3可知,8种试剂盒提取方法的DNA质量浓度中,试剂盒K7的浓度为25.4~266.3 ng/μL,浓度最高;试剂盒K1、K2、K3、K5、K8的DNA质量浓度在18.4~137.4 ng/μL,浓度适中;试剂盒K4、K6的DNA质量浓度低于20 ng/μL,浓度较低。
8种试剂盒提取方法的A260/A280比值情况如下:纯DNA 的A260/A280 约为1.8,>1.8 表明有RNA污染,<1.8 表明有蛋白质污染[9-10]。试剂盒K2、K3、K8的A260/A280为1.74~2.06,纯度最高;试剂盒K1、K5、K6、K7的A260/A280在1.42~2.29,纯度次之;试剂盒K4的A260/A280为1.04~1.74,纯度最低。
2.3 毛细管电泳结果
在ABI3700 基因分析仪器上利用荧光标记的PCR 产物进行毛细管电泳,8个样品在5个位点上扩增片段带型清晰,8个试剂盒的表现一致。
3 讨论
试剂盒K2、K3、K8提取质量和产量都比较高。采用试剂盒K2、K3、K8提取得到的DNA纯度较高,DNA 带清晰; PCR扩增结果较好,每个引物均可扩增出清晰的波峰,但操作比较烦琐,耗时耗力,提取10个基因组DNA需2.5 h,所用试剂对人体有毒。与试剂盒K2、K3、K8相比,试剂盒K6步骤简单,用时少,扩增效果也较好,但DNA 纯度较低,也用到了一些对人体有害的试剂,安全性不高。试剂盒K1、K4、K5、K7步骤较复杂,提取得到的DNA纯度较低;试剂盒K7的DNA质量浓度太高,需要稀释才能使用;试剂盒K1、K2、K3、K5、K8的DNA质量浓度适中;试剂盒K4、K6的DNA质量浓度低于20 ng/μL,浓度较低。
在进行SSR-PCR 反应中,模板DNA 如果含有多糖、酚类、蛋白质等杂质[10], 会影响DNA 聚合酶活性,干扰引物与模板的结合。试剂盒K2提取的数量多,PCR 结果稳定,重复性也好, 在进行水稻干种子DNA 抽提时,试剂盒K2是实验室提取水稻基因组DNA 的一种好方法。
通过对8种DNA提取试剂盒提取10个水稻品种的DNA进行DNA提取试剂盒筛选,结果表明,试验筛选出最优DNA提取试剂盒具有稳定、高效和可重复性的特点,可应用于水稻真实性检测工作。
参考文献:
[ 1 ] OECD.Consensus document on compositional considerations for new varieties of rice(Oryza sativa):key food and feed nutrients and antinutrients[R].Paris:OECD,2004.
[ 2 ] 李炫丽,王世才,许双全.水稻单粒种子DNA提取及SSR-PCR反应体系的正交设计优化[J].中国种业,2011(8):46-49.
[ 3 ] IKEDA N,BAUTISTA N S,YAMADA T.Ultra-Simple DNA extraction method for marker-assisted selection usingmicro-
satellite markers in rice[J].Plant Molecular Biology Reporter,2001(19):27-32.
[ 4 ] WU Gang,WU Yuhua,NIE Shujing,et al.Real-time PCR method for detection of the transgenic rice event TT51-1[J].Food Chemistry,2010(119):417-422.
[ 5 ] 朱世楊,罗天宽,张小玲,等.8种水稻基因组DNA提取方法的比较[J].安徽农业科学,2009(5):1929-1931.
[ 6 ] 赵红霞,谢攀,黄志坚,等.一种改良的水稻总DNA提取方法[J].湖北大学学报(自然科学版),2006(4):389-392.
[ 7 ] COLLARD B C Y,DAS A,VIRK P S,et al.Evaluation of quick and dirty DNA extraction methods for marker-assisted selec-
tion in rice(Oryza sativa L.)[J].Plant Breeding,2007(126):47-50.
[ 8 ] CHAPELA M J,SOTELO C G,PEREZ-MARTIN R I,et al.Comparison of DNA extraction methods from muscle of canned
tuna for species identification[J].Food Control,2007(18):1211-1215.
[ 9 ] SHARMA A D,GILL P K,SINGH P.DNA isolation from dry and fresh samples of polysaccharide-rich plants[J].Plant Mol Biol Rep,2002(20):415.
[ 10 ] 李娟,文建成,谭学林.从水稻单粒糙米中快速制备基因组DNA的方法[J].分子植物育种,2007(5):735-737.

