基于CT 图像纹理特征评价肝硬化:平扫与增强扫描的对比
李民 张喆 赵丽琴 杨大为 刘长春 荆利娜 闫玉昌 常泰
肝硬化是多种急、慢性肝病发展的一个阶段,失代偿期可引起严重并发症,部分可进展为肝癌。在CT 上明确诊断肝硬化时多已处于失代偿期,常规CT 图像主要通过肝脏形态、大小、肝叶比例、肝裂增宽等征象来诊断肝硬化,多难以显示肝脏质地的改变。肝脏质地反应了肝组织的内部结构成分,在肝硬化发生、发展的过程中,肝细胞损伤,细胞外基质沉积,门管区纤维组织增生乃至假小叶形成,肝脏质地都会发生相应变化,这些组织结构内部的变化,早于肝脏形态变化,并且与组织病理改变相统一[1]。肝硬化程度及发病时间不同,肝脏质地改变不同,但这种改变仅少量病例可以在CT 上观察到。目前,早期诊断肝硬化仍以有创性的组织穿刺活检作为金标准[2],存在穿刺局限性导致的采样误差。影像组学可进一步挖掘影像图像之外的特征,显示肉眼不能显示的潜在影像特征。既往研究分别应用平扫CT 或增强CT 图像研究了肝纤维化纹理特征以及建立肝硬化诊断模型[3'6]。本研究拟通过比较基于平扫与增强CT 图像建立的肝硬化纹理特征模型的诊断效能,以期获得建立模型的最佳CT 扫描时相。
资料与方法
本研究已获得伦理委员会批准。
1.一般资料
回顾性收集2015 年2 月~2021 年2 月因肝硬化就诊、并应用GE Disvovery CT 行腹部平扫加增强CT 扫描的患者562 例作为研究组,选取同时期行相同CT 扫描的无弥漫性肝病患者106 例作为对照组。纳入及排除标准如下。
研究组病例入组标准:年龄大于18 岁;符合《肝硬化诊治指南》(2019)诊断标准[2];临床确诊肝硬化30 d 内行CT 平扫加增强检查。研究组病例排除标准:(1)合并肿瘤,或肝内多发局灶性异常密度灶(大于2 个病灶,病灶累计直径大于2 cm);(2)肝脏部分切除术后;(3)图像质量不佳。
对照组病例入组标准:年龄大于18 岁;肝脏各项实验室指标正常;无肝病病史;行CT 平扫及增强检查。对照组病例排除标准:(1)肝内多发局灶性异常密度灶(大于2 个病灶,病灶累计直径大于2 cm);(2)图像质量不佳。
最终研究组入组100 例肝硬化患者,其中男62 例,女38 例,年龄19~79 岁,中位年龄54 岁;肝功能Child'Pugh 分级为A 级44 例,B 级38 例,C 级18 例。对照组入组98 例患者,其中男51 例,女47 例,年龄21~70 岁,中位年龄34 岁。
2.检查方法
图像获取:采用GE Discovery CT 750 HD(HDCT,GE Healthcare,Wisconsin)扫描机。仰卧位,行平扫及增强扫描三期扫描,扫描参数为:管电压120 kV,自动管电流范围150~375 mA,层厚5 mm,螺距1,扫描范围自膈顶上2 cm 至肝下缘,矩阵512×512,采用标准重建算法。增强扫描对比剂选用欧乃派克350,用量350 mg I/kg 体重,注射时间20 s。增强扫描采用Smart 技术,ROI 设定在腹主动脉,CT值达100 HU 时触发扫描,门静脉期于触发扫描后延迟40 s 进行。将平扫及门静脉期图像以DICOM格式输出到图像分割软件。
图像分割:平扫及门静脉期图像均选取门静脉主干左支层面,采用单层面2D 图像,应用Shukun Radiomics V94 图像分割软件,由两名放射科医师(工作经验大于10 年)分别沿肝脏边缘人工勾画兴趣区(region of interest,ROI)(图1a),病例随机分配,勾画过程相对独立,尽量避绕大的脉管,如兴趣区肝实质内存在局灶性异常密度灶(数量≤2 个,直径≤2 cm),如钙化、囊肿等,予以剔除(图1b)。对两名医生勾画结果进行组间一致性检验,组内相关系数(intraclass correlation coefficient,ICC)大于0.75 视为可重复性良好。
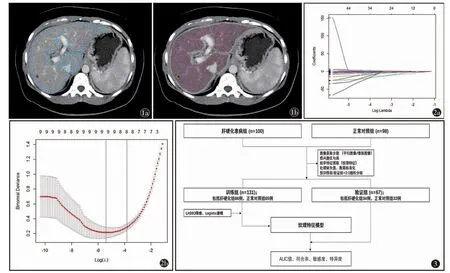
图1 a)CT 图像分割的ROI 勾画;b)CT 图像分割剔除肝内局灶病变(反选区)图2 a)LASSO 降维;b)最小方差法保留9 个特征 图3 肝硬化纹理特征模型建立与验证流程图
3.CT 纹理特征提取
使用Shukun Radiomics V94 软件提取肝脏组学纹理特征,共计75 个。包括灰度共生矩阵特征24 个,灰度相关矩阵特征14 个,灰度游程矩阵特征16 个,灰度区域大小矩阵特征16 个以及邻域灰度差矩阵特征5 个;经过滤波变换的纹理特征900 个。通过RStudio 软件首先对所提取特征进行缺失值处理,对所有特征均采用最小'最大缩放算法进行标准化预处理,见公式(1)。

对每个放射组学特征和标签之间进行Spearman相关分析。系数小于0.25 或P>0.05 的特征被相应删除。使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法进行降维。选用最小方差法最终保留9 个最显著特征(图2)。
4.模型建立与性能评估
使用RStudio 软件,将肝硬化研究组和正常对照组病例按照2∶1 比例随机分成训练组(n=131)和验证组(n=67),其中训练组中肝硬化病例66例,正常对照组65 例;验证组中肝硬化病例34 例,正常对照组33 例。使用训练组数据通过Logistic 回归建立预测模型,使用验证组数据验证模型的效能(图3)。
在图像获取阶段,分别选取平扫图像及增强门静脉期图像;在组学特征提取阶段,选择相同层面图像,提取纹理特征数据;在模型训练阶段,使用5 倍交叉验证结果判定机器学习分类器的性能;在模型验证阶段,通过模型曲线下面积(area under curve,AUC)值、符合率、敏感度、特异度等指标评价模型性能。对比平扫图像模型和增强图像模型的AUC 值等指标差异,优选肝硬化纹理特征模型建模图像的时相。
5.统计分析
使用SPSS 25.0 和SAS 9.4 软件。采用卡方检验对训练集和验证集的AUC 值、符合率、敏感度、特异度进行比较。采用SAS 软件宏命令包对反映肝脏质地的平扫和增强CT 纹理特征诊断模型ROC 曲线下面积进行比较。采用ICC 对两名医生的图像分割结果的一致性进行检验;P<0.05 被认为有统计学差异。
结果
数据测量一致性比较:两名医生对图像分割的一致性检验结果良好,ICC=0.77。
训练集及测试集的增强CT 所获肝脏纹理特征模型的AUC 值、符合率、特异度,以及测试集的敏感度均高于平扫CT;而训练集的平扫CT 所获肝脏纹理特征模型敏感度优于增强CT(表1,图4)。
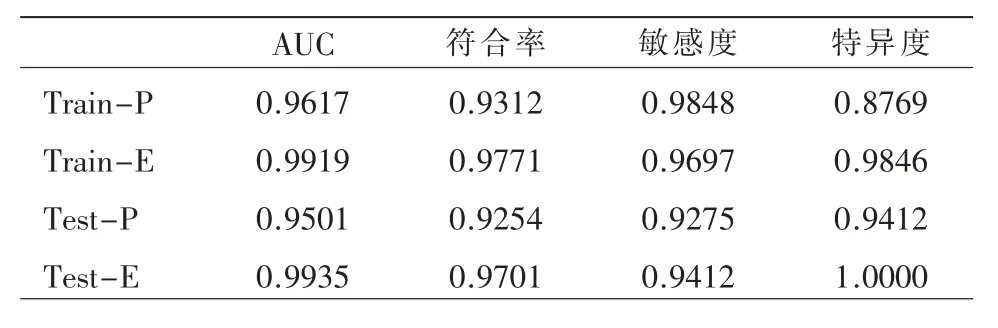
表1 平扫及增强CT 图像肝脏纹理特征模型诊断性能比较

图4 肝硬化纹理特征模型诊断性能比较 图5 肝硬化纹理特征模型交叉验证性能比较。Train'P:平扫图像训练集;Test'P:平扫图像验证集;Train'E:增强图像训练集;Test'E:增强图像验证集。每个数据集的四个分格中,右上角为真阴性病例数,左上角为假阳性病例数;右下角为假阴性病例数,左下角为真阳性病例数 图6 平扫与增强CT 肝硬化纹理特征模型ROC 曲线下面积比较
模型交叉验证性能比较的结果显示,训练集131 例中,平扫图像模型的正确率及错误率分别为93.12%(122/131)、6.87%(9/131);增强图像的正确率及错误率分别为97.71%(128/131)、2.29%(3/131)。验证集67 例中,平扫图像模型的正确率、错误率92.54%(62/67)、7.46%(5/67);增强图像模型的正确率、错误率97.01%(65/67)、2.99%(2/67)(图5)。
使用SAS 软件宏命令包对CT 平扫图像模型及增强图像模型应用受试者工作特征(receiver operator characteristic,ROC)曲线进行比较,两者之间无统计学差异(P=0.0875>0.05)(图6)。
讨论
影像组学(Radiomics)是从医学影像图像中高通量地提取大量定量影像学特征,用以诊断疾病或判断预后[7,8]。这些定量影像特征能够捕捉人类肉眼无法或不易识别的信息,是对常规影像学定性及半定量图像分析的补充[9]。
影像组学作为一种新兴的非侵入性的定量成像技术,在肝脏局灶性及弥漫性疾病的鉴别诊断,疾病分期中表现出色[10'14]。Segal等[15]研究发现CT纹理特征与肝癌全基因表达之间存在显著相关性,约78%的基因信息可以通过28 个CT 特征重建得到。Kalyan 等[16]应用人工神经网络分析肝脏超声图像组学特征鉴别肝脏疾病;Yokoo 等[17]证实增强MRI 图像纹理分析评估肝纤维化与肝脏组织活检结果显著相关。不同模态影像组学分析在肝脏疾病诊断、鉴别诊断及预后评估方面均取得了令人满意的结果。一项荟萃分析统计了关于肝脏疾病的放射组学研究36 项,发现目前发表的研究以CT 图像组学分析为主[18]。
与CT 图像比较,MRI 图像对肝脏纹理识别的敏感性更高[19],但MRI 检查操作相对复杂,较易产生伪影致图像质量下降,且多项禁忌证限制了受检者应用;超声检查简单经济,与CT 比较无放射污染,但其图像的获取与检查者经验密切相关,主观影响大[2]。CT 检查简单快捷、密度分表率高,增强CT 较MRI 及超声可更好的评估肝硬化门脉高压侧支循环情况,无创性地预测门静脉高压及其并发症的发生[20]。但是,常规CT 检查对早期肝硬化患者肝脏质地改变评估存在一定困难。
纹理特征反映了图像中同质现象的视觉特性,描述了区域像素的空间位置关系,是物体表面结构的组织排列属性。通过灰度共生矩阵、灰度相关矩阵、灰度游程矩阵、灰度区域大小矩阵及邻域灰度差矩阵来体现区域像素的空间关系。在此基础之上,通过滤波变化又可获得大量更高维度特征。这些特征以肉眼不可见的信息定量地描述了体素的物理特性,从而揭示了兴趣区的组织病理结构变化。
近年来基于CT 平扫或增强图像的影像组学分析在肝炎、肝纤维化及肝硬化诊断、分级以及并发症预测中取得满意效果[4,21'23]。Wang 等[4]通过CT平扫图像建立组学模型,发现肝硬化组与非硬化组影像组学特征之间存在显著差异,利用支持向量机(support vector machine,SVM)算法建立的组学模型识别肝硬化训练组和验证组的AUC 分别为0.879 和0.858;Homayounieh 等[3]通过腹部CT 平扫组学分析,区分健康肝脏与肝硬化(AUC 值0.84)。而Daginawala 等[6]通过增强CT 纹理特征对肝纤维化分期进行分类,发现G0'3 与G4'6 组以及G0'4 与G5'6 组分类时,AUC 值最高,AUC 均大于0.70;Choi 等[11]应用CT增强图像建立深度学习系统对肝硬化分期(AUC 值0.95~0.97),优于放射医师评估(AUC 值0.75~0.88)和实验室指标(AUC 值0.65~0.85)。
既往应用CT 图像纹理特征评估肝脏质地特征改变的研究中,既有CT 平扫图像,亦有CT 增强图像[3'6],其中以CT 增强图像研究较多。增强扫描可以增加组织间对比,提高肝内微小病灶的检出率[24],同时可以更好地显示肝内血流动力学改变、组织灌注及侧支循环情况,为评估肝硬化及并发症提供依据[20,25];但是,增强扫描图像受对比剂注射方案的影响,且增强扫描所用对比剂,增加了检查的复杂程度,同时检查者需要承担对比剂过敏的风险,对比剂的引用并可能会加重肝、肾功能的负担,并且需要额外增加CT 辐射剂量;另外出于成本效益的考虑,美国肝病协会2018 年实践指南不推荐使用增强CT 筛查肝脏疾病[26]。在中国,众多HBV 携带者每年接受CT 检查,大多数患者也只接受平扫检查[4]。相对于增强扫描,CT平扫检查更为简单快捷,无需注射对比剂,不会发生对比剂过敏现象,图像不受对比剂注射方案不同的影响。不足之处在于缺乏反映肝脏血流动力学状态的信息,对伴发的肝内病变鉴别诊断能力较低。临床工作中,CT 平扫或增强检查各有其优势与不足。因此,应用影像组学对肝硬化患者肝脏质地等特征进行分析时,在考虑诊断效能的基础上,也需考虑检查成本及患者接受度等因素。比如基层医院软硬件条件相对不足的单位推荐平扫检查;碘剂过敏者严禁增强检查;而实验室检查肿瘤标志物异常的患者应该增强检查。总之,合理选择检查最佳时相,对于临床有一定意义。
在本研究中,平扫与增强图像纹理特征模型均能很好识别预测肝硬化,模型AUC 值均在0.95以上,说明肝硬化组织与正常肝脏组织存在纹理特征的显著差异,通过纹理特征模型可以较容易识别肝硬化患者肝脏质地的改变。
对比训练集及验证集的增强与平扫CT 的诊断符合率,结果显示训练集及验证集的基于增强CT 建立的图像纹理特征模型均较平扫模型性能略佳,但是无统计学意义。增强图像模型训练集与验证集的AUC 值、符合率、特异度指标均高于平扫图像模型,说明对比剂的引入可能会提高肝脏组织结构的分辨程度,增加正常肝脏质地与肝硬化组织的区分度;但是训练集敏感度低于平扫图像模型,推测可能与对比剂的引入,增加了组织背景的噪声所致有关。
本研究具有一定局限性:(1)回顾性研究,可能存在病例选择偏差;(2)病例数量相对较少,在今后将进一步增加病例进一步研究。
综上所述,以CT 平扫图像及增强图像建立的肝硬化患者肝脏纹理特征模型均可准确识别肝脏质地改变,增强CT 略优于平扫CT。在临床应用中,应根据检查目的,结合当地诊疗水平和患者接受度合理选择检查方式,在条件允许的前提下优先提倡使用增强图像纹理特征评估肝脏质地。

