黄瓜细菌性茎枯萎病病原鉴定及温度对其致病力的影响
白雪 张晓晓 季苇芹等


中图分类号: S436.421.1 文献标识码: A DOI: 10.16688/j.zwbh.2020260
黄瓜Cucumis sativus是葫芦科黄瓜属植物,在我国有2000 多年的栽培历史,是重要的蔬菜作物。近年来,随着黄瓜的大面积种植,日光温室及各种塑料大棚等设施逐年增多,为黄瓜生长提供适宜环境的同时,也为多种黄瓜细菌性病害的发生提供了适宜的环境条件。生产中黄瓜细菌性病害主要有丁香假单胞菌流泪致病变种Pseudomonas syrin gae pv. lachrymans引起的细菌性角斑病、丁香假单胞菌P.syringae引起的细菌性茎软腐病、绿黄假单胞菌P.viridiflava引起的细菌性白枯病、嗜管欧文氏菌Erwinia tracheiphila引起的细菌性萎蔫病、野油菜黄单胞菌野油菜致病变种Xanthomonas campestris pv. cucurbitae引起的细菌性圆斑病和丁香假单胞菌流泪致病变种P.sy-ringae pv. lachrymans、胡萝卜软腐果胶杆菌巴西亚种Pectobacterium carotovorum subsp. brasiliense引起的细菌性流胶病等。黄瓜细菌性茎枯萎病是黄瓜生产中的一种新的细菌病害,2003年以来在我国河南以北地区有不同程度的发生。该病害可危害黄瓜茎部,造成植株萎蔫,因此称为黄瓜细菌性茎枯萎病。实验室前期采集样品时发现黄瓜细菌性茎枯萎病的发病时间集中在每年的10月-12月及次年的1月-2月,温度低时,植株流胶、枯萎情况更严重。黄瓜细菌性茎枯萎病(也有人称为流胶病)的症状与角斑病不同,可以侵染叶脉和茎部,且在早春低温环境下危害加重。
植物病原细菌通常依据病原菌的形态特征、培养性状、致病性、生理生化反应以及分子生物学相关技术等进行鉴定。常规PCR 技术、实时荧光定量PCR 技术、多位点序列分型(multilocussequencetyping,MLST)技术、分子标记技术、BOXPCR 技术和转录组测序等方法越来越多地用于细菌的鉴定。生理生化反应是鉴定细菌种类的经典试验,如LOPAT 试验、Ayers碳源利用试验和GATTa试验等。BOXPCR 技术具有操作简单快捷,易获得丰富的扩增条带,不需要菌株的特异性DNA多态性分析,扩增结果可直接进行琼脂糖电泳检测等优点,目前在固氮菌的多样性研究中已有应用,在类鼻疽假单胞菌Pseudomonas pseudomallei、荧光假单胞菌Pseudomonas fluorescens、恶臭假单胞菌P.putida等细菌上也有应用的报道。多位点序列分型技术是由多位点酶电泳(MLEE)衍生出来的分型方法,用看家基因的DNA 序列多态性代替了同工酶基因产物的酶谱带型的多态性,使试验结果的可比性和重复性有很大提高,也广泛应用于动物学和医学中。Newberry等通过LOPAT 生理生化反应、BOXPCR 和MLST 等技术确定了佛罗里达州的西瓜和西葫芦细菌性叶斑病的病原菌为丁香假单胞菌丁香致病变种。
本实验室前期通过碳源利用等方法初步鉴定该病害的病原菌为丁香假单胞菌,本研究将进一步明确黄瓜茎枯萎病病原菌的分类地位,并研究温度对该病害发生的影响,为黄瓜细菌性茎枯萎病的防治奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
本试验菌株如下:黄瓜茎枯萎病菌山东分离物A1~A7、北京分离物B22、辽宁分离物L2和L3,由本实验室分离并验证为病原菌;丁香假单胞菌流泪致病变种P.syringae pv.lachrymans pslb8、丁香假单胞菌丁香致病变种P.syringae pv.syringaepss和丁香假单胞菌番茄致病变种P.syringae pv.tomato DC3000为本研究室保存;丁香假单胞菌流泪致病变种P.syringae pv. lachrymans NCPPB540~NCPPB543、丁香假单胞菌菜豆致病变种P.syringae pv. phaseolicola psp、丁香假单胞菌降红致病变种P.syringae pv. atropurpureaNCPPB1328、丁香假单胞菌李死致病变种P.syringae pv. morsprunorum ATCC13395、丁香假單胞菌猕猴桃致病变种P.syringae pv.actinidiae NCPPB3738、丁香假单胞菌桑致病变种P.syringae pv.mori ATCC19872和丁香假单胞菌猝倒致病变种P.syringae pv.lapsa ATCC10859由中国检验检疫科学院赵文军研究员惠赠。
1.1.2 培养基及培养条件
KingsB(KB)培养基(pH7.0):胰蛋白胨20g,MgSO41.5g,K2HPO41.55g,丙三醇15mL。
LB培养基(pH7.0):胰蛋白胨10g,酵母提取物5g,NaCl10g。
蔗糖(葡萄糖)培养基(pH7.0):胰蛋白胨10g,NaCl5g,蔗糖(葡萄糖)50g。
Thornley培养基(pH 7.0):蛋白胨1g,NaCl5g,KH2PO40.3g,酚红0.01g,L精氨酸盐酸盐10g。
明胶液化培养基(pH7.0):牛肉膏3g,蛋白胨5g,明胶120g。
七叶苷培养基(pH7.0):蛋白胨5g,酵母粉1g,蔗糖5g,七叶苷1g,柠檬酸铁0.5g。
肉汁冻培养基(pH7.0):牛肉膏3g,蛋白胨5g,酵母粉1g,蔗糖10g。
Ayers培养基(pH 7.0):NH4H2PO41g,KCl0.2g,MgSO40.2g,酵母粉0.2g,溴百里酚蓝(1.6%乙醇溶液)1.5mL,在培养基中加1%待测定的碳素化合物。
酒石酸盐利用培养基(pH=7.4):胰蛋白胨10g,NaCl5g,溴百里酚蓝(0.2%)12.5mL,酒石酸钾10g,接种14d后加入等体积1%醋酸铅试剂。
以上培养基均用去离子水定容至1000mL,固体培养基在液体培养基配方基础上添加琼脂,浓度为1.5%。121℃高温高压灭菌(含蔗糖的培养基110℃高温高压灭菌)20min。卡那霉素(kanamycin)的最终使用浓度为50μg/mL。
菌株培养条件:28℃恒温培养。
1.1.3 试剂、药品及仪器
试验所用试剂:2×Taq PCR MasterMix、SuperRealPreMixPlus和FastQuentRTKit(天根生化科技(北京)有限公司);细菌基因组DNA 提取试剂盒(BioTeke);质粒提取试剂盒及琼脂糖凝胶纯化回收试剂盒(Axygen);N,N-二甲基对苯二胺二盐酸盐、干酪素、酒石酸钾半水合物、明胶、柠檬酸铁、甘露醇和秦皮甲素(上海阿拉丁生化科技股份有限公司);溴百里酚蓝、酚红、DL-高丝氨酸、L-乳酸钠和(R)-3-哌啶甲酸乙酯犔酒石酸盐(上海麦克林生
化科技有限公司);甜菜碱(北京金百特生物技术有限公司);醋酸铅(北京百灵威科技有限公司)。所有PCR 引物的合成和序列测序由六合华大基因(北京)公司完成。
试验所用仪器:普通离心机、低温离心机(Eppendorf,德国),凝胶成像分析系统和PCR 仪(BIORAD,美国),超低温冰箱MDF382E(SANYO,日本),分光光度计(ThermoFisherScientific,美国),Biosceen全自动生长曲线分析仪(Biosceen,芬兰),pH 计(Sartorius,德国),磁力搅拌器(WiseStir,中国),烘箱(Memmert,德国),DHP120立式恒温培养箱(上海实验仪器厂有限公司)。
1.2 多位点序列分型(犕犔犛犜)试验
菌株基因组DNA 提取参照细菌基因组DNA提取试剂盒说明书进行,DNA 用去离子水溶解。选取7个管家基因:编码σ70因子狉狆狅犇,促旋酶基因gyrB,乌头酸水合酶B基因acnB,柠檬酸合成酶基因cts,甘油醛-3-磷酸脱氢酶基因gap,磷酸葡萄糖异构酶基因pgi和磷酸果糖激酶基因pfk,以A1~A7为供试菌株,NCPPB540 ~ NCPPB543、NCPPB1328、ATCC13395、NCPPB3738、ATCC19872、ATCC10859、psp、pss和pslb8 为对照菌株,对其DNA 进行PCR扩增并测序,扩增引物见表1。
1.3 犅犗犡犘犆犚检测
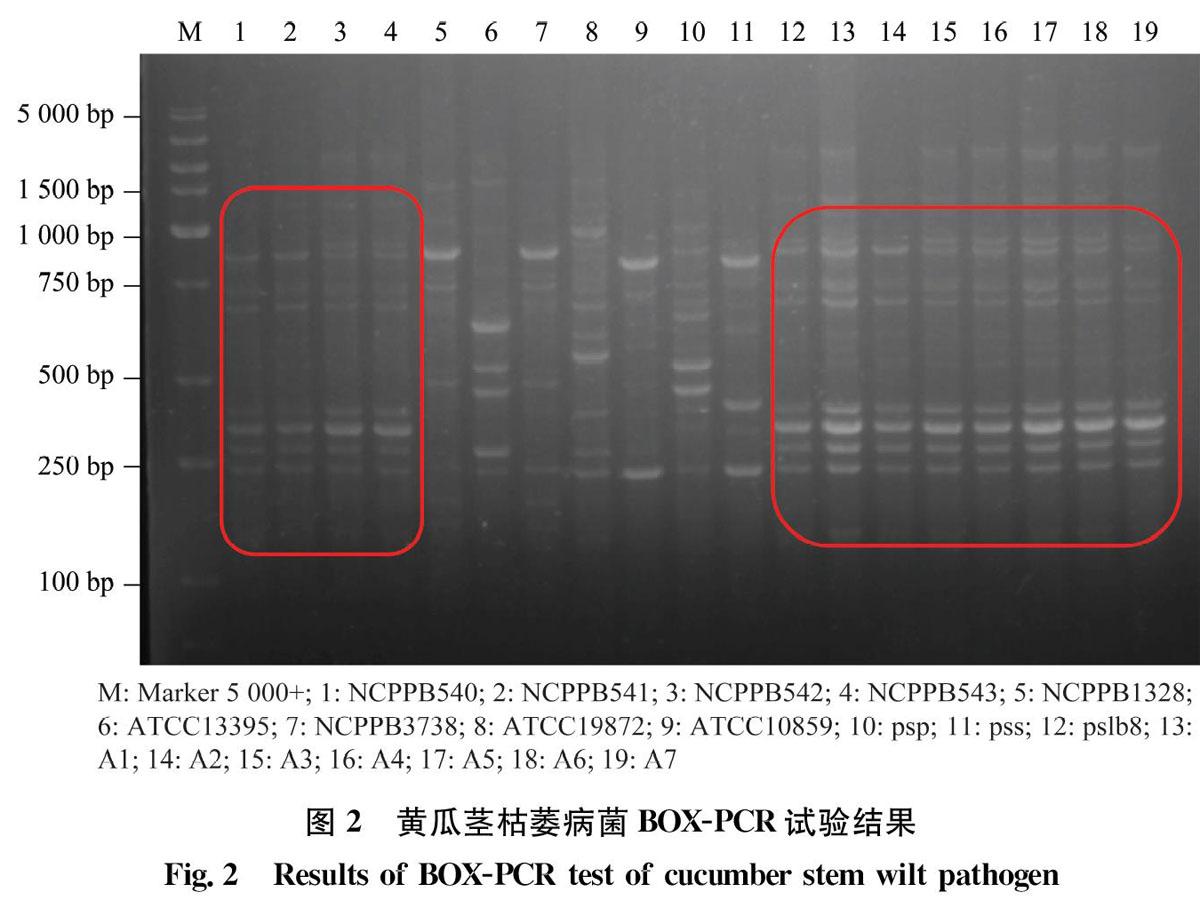
以BOX 为单引物(5′CTACGGCAAGGCGACGCTGACG3′),对NCPPB540~NCPPB543、NCPPB1328、ATCC13395、NCPPB3738、ATCC19872、ATCC10859、psp、pss、pslb8和A1~A7菌株提取的DNA 进行PCR 扩增。25μL反应体系:2×TaqPCR MasterMix12.5μL,引物1μL,模板2μL,ddH2O9.5μL。反应条件为:95℃预变性5 min;95℃變性30s,60℃退火2min,72℃延伸2min,30个循环;72℃延伸10min。BOX 扩增产物经1.5%琼脂糖凝胶电泳,用自动凝胶成像系统检测。
1.4 特异性引物犘犆犚扩增与测序
以A1~A7、B22、L2和L3为供试菌株,pslb8为阳性对照,无菌水为阴性对照,用王哲等根据丁香假单胞菌流泪致病变种的glyceraldehyde3phosphatedehydrogenase1(犵犪狆1)基因序列设计的特异性引物PslF/R(PslF:5′GTTCGGCGACGCAATCAATG3′, PslR: 5′GTTGACTTCTTCGGCGGTGG3′)进行PCR 扩增(产物大小为179bp)。25μL 反应体系:2×TaqPCR MasterMix13μL,引物各1μL,模板2μL,ddH2O8μL。反应条件为:95℃预变性5min,95℃变性30s,58℃退火30s,72℃延伸1min,30个循环后72℃延伸8min。PCR产物送六合华大基因(北京)公司测序。
1.5 病原菌的生理生化反应测定
试验选取pslb8、pss和DC3000为对照菌株,将供试菌株用KB 液体培养基培养至菌液浓度为OD600=0.6,离心收集菌体,加1mL无菌水悬浮,再离心,然后洗去表面培养基,将菌悬液浓度调至1×108cfu/mL,进行以下试验:荧光色素的产生、LOPAT试验(果聚糖的产生、氧化酶反应、马铃薯软腐反应、精氨酸双水解检验和烟草过敏反应)、GATTa 试验(明胶液化、七叶苷水解、酪蛋白水解和酒石酸盐的利用)及Ayers碳源利用试验(甘露醇、甜菜碱、L-酒石酸盐、DL-高丝氨酸和犔乳酸钠)。
1.6 不同温度下病原菌致病力的测定
为了研究温度对病害发生的影响,测定20、25℃和28℃条件下病原菌的生长能力和对黄瓜叶片的致病力(30℃条件下由于温度过高,子叶过早枯萎,无法完成试验,因此将最高温度设为28℃)。
采用喷雾接种的方法。A2菌株和pslb8菌株分别用KB液体培养基28℃振荡培养至菌液浓度为OD600=0.6,5000r/min离心10min,弃上清,沉淀用无菌水洗涤,再用无菌水将菌悬液浓度调至1×106cfu/mL。使用无菌喷头将菌液接种到4周龄健康的黄瓜植株,每个菌株接种3盆,以无菌水为阴性对照。接种后使用新塑料袋保湿,置于光照气候培养箱中,培养温度分别设置为20、25℃和28℃,L∥D=16h∥8h,相对湿度80%~85%。分别于接种后7、10、14d观察黄瓜苗发病情况,并计算病情指数。试验重复3次。
1.7 不同温度下病原菌在寄主体内生长能力的测定
参考Johnson等和Ren等的方法,进行部分修改。将A2和pslb8菌株分别用KB液体培养基培养至菌液浓度为OD600=0.6,5000r/min离心10min,弃上清,沉淀用无菌水洗涤,再加入无菌水至菌悬液浓度为1×104cfu/mL,以无菌水为阴性对照。使用一次性注射器将菌悬液注入至完全展开的2周龄黄瓜子叶中,注满整个子叶,每个菌株接种25株苗。分别放置于20、25℃和28℃培养箱培养,每隔24h取1片子叶观察发病情况并拍照,持续观察至子叶症状不再变化或全部萎蔫。从每个菌株接种的幼苗中选6片子叶,用消毒并灭菌后的打孔器在叶脉左侧中间部位打取大小约为0.5cm2的叶盘,无菌水冲洗表面后使用MP破碎仪器研磨,研磨液连续稀释后涂布于KB固体培养基上,28℃孵育24h,统计细菌菌落数。试验重复3次。
1.8 不同温度下病原菌体外生长能力的测定
将A2和pslb8菌株在KB液体培养基中培养至OD600=0.6,用KB液体培养基调至菌悬液浓度为1×108cfu/mL,梯度稀释至1×106cfu/mL,以KB液体培养基为阴性对照,吸取200μL加入到200孔带标记聚苯乙烯培养板中,放入Biosceen自动生长曲线仪,设置温度为20、25℃和28℃,200r/min振荡培养,每隔2h测定1次菌液OD600的吸光值,测定前5s停止振荡,培养96h,观察和记录各菌株的生长情况。每个处理重复4孔,试验重复3次。
1.9 数据处理
试验数据均使用GraphPadPrism7进行记录、运算及制图,使用PASW Statistics18进行分析,采用独立样本狋测验进行相同条件下的不同菌株间差异性分析(置信区间=0.95)。
2 结果与分析
2.1 多位点序列分型(MLST)结果
通过多位点序列分型试验,对所研究菌株的7个看家基因rpoD、gyrB、acnB、cts、gap、pgi和pfk进行PCR验证,测序结果通过NCBI进行BLAST分析,用MEGA7.0软件构建系统发育树。以A1和A2为例(图1),由图1可知:基于7个看家基因供试菌株与丁香假单胞菌流泪致病变种NCPPB540、NCPPB541、NCPPB542、NCPPB543和pslb8菌株的亲缘关系最近,因此,确定黄瓜细菌性茎枯萎病的病原菌为丁香假单胞菌流泪致病变种P.syringae pv.lachrymans。
2.2 BOX-PCR检测结果
BOXPCR试验,结果表明,供试菌株与NCPPB540、NCPPB541、NCPPB542和NCPPB543的结果相同,与NCPPB1328、ATCC13395、NCPPB3738、ATCC19872、ATCC10859、psp和pss不同,说明供试菌株为丁香假单胞菌流泪致病变种(图2)。
2.3 特异性引物犘犆犚扩增结果
以特异性引物PslF/R 对黄瓜茎枯萎病菌代表性菌株和对照菌株进行PCR 扩增,得到179bp的目的片段,经测序和BLAST 比对分析后,确定供试菌株为丁香假单胞菌流泪致病变种。
2.4 病原菌的生理生化反应
10株供试菌株与pslb8菌株的试验结果一致,其在KB培养基上产生荧光,产生果聚糖,烟草过敏性反应、明胶液化和七叶苷水解均呈阳性,精氨酸双水解、马铃薯软腐和酪蛋白水解均呈阴性,可利用甘露醇、甜菜碱和L-酒石酸盐,不能利用L-乳酸钠和DL-高丝氨酸(表2)。与pss菌株在酒石酸盐、L-酒石酸盐和犔乳酸钠利用的试验结果不一致;与DC3000菌株在明胶液化、酒石酸盐和L-酒石酸盐利用的试验结果不一致;由此也可证明该病害的病原菌为丁香假单胞菌流泪致病变种。
2.5 不同温度下病原菌的致病力测定结果
A2菌株和pslb8菌株喷雾接种健康的黄瓜幼苗,分别在20、25℃和28℃条件下培养,接种后7d调查黄瓜幼苗发病情况。20℃时,接种A2菌株的黄瓜苗均比接种pslb8菌株的黄瓜苗症状明显;在25℃和28℃条件下,接种A2菌株的黄瓜苗症状与接种pslb8菌株的黄瓜苗无明显差异。说明20℃条件下黄瓜苗接种A2菌株比接种pslb8菌株更易发病,但是随着温度的升高,接种A2和pslb8菌株的黄瓜苗的发病程度无明显差异(图3a,c,e)。
黄瓜苗喷雾接种A2和pslb8菌株7d后调查病情指数:在20℃条件下,接种A2菌株的黄瓜苗第7、10天和14天的病情指数分别为18.75、48.96和65.63,接种pslb8菌株的黄瓜苗的病情指数分别为7.14、20.24和34.67;在25℃条件下,接种A2菌株的黄瓜苗第7、10 天和14 天的病情指数分别为14.12、32.87和40.74,接种pslb8菌株的黄瓜苗的病情指数分别为15.63、35.65和41.43;在28℃条件下,接种A2菌株第7、10天和14天的黄瓜苗的病情指数分别为19.5、27.48和38.19;接種pslb8菌株的黄瓜苗的病情指数分别为19.20、25.00和31.55。在20℃条件下,A2菌株与pslb8菌株的致病性差异显著(犘<0.05),在25℃和28℃条件下,A2菌株与pslb8菌株的致病性差异不显著(图3b,d,f)。由以上结果表明:在20℃条件下,A2菌株的致病力强于pslb8菌株,在25℃和28℃条件下,A2与pslb8菌株的致病力无明显差异,20℃条件下更有利于黄瓜茎枯萎病的发生(图3)。
2.6 不同温度下病原菌在寄主体内生长能力测定
20℃条件下,注射A2和pslb8菌液的黄瓜子叶在观察时间范围内未出现萎蔫症状,在25℃和28℃条件下,子叶在72h时出现萎蔫症状(图4a,c,e)。
注射A2和pslb8菌液后,20℃条件下,在48h内A2菌株与pslb8菌株在黄瓜子叶内的菌落数量增长速率无差异,在48h后A2菌株的菌落数量增长速率加快,在72h时可看出A2菌株与pslb8菌株的菌落数量增长率差异显著(犘<0.05,独立样本狋测验),72h后pslb8菌株的菌落数量增长速率进入稳定期。25℃条件下,24h时A2和pslb8菌株在黄瓜子叶内的菌落数量增长速率差异明显,在48h时,A2与pslb8菌株的菌落数量增长速率无明显差异。28℃条件下,在24h内A2菌株与pslb8菌株的菌落数量增长速率无差异,在48h内菌落数量增长速率最快,48h后A2菌株的增长速率趋于稳定,pslb8菌株的增长速率略有下降趋势(图4b,d,f)。由以上结果表明:在观察时间范围内,20℃条件下,A2菌株在黄瓜子叶内的菌落数量增长速率呈现强于pslb8菌株的趋势,说明在20℃条件下,A2菌株在寄主体内生长能力强于pslb8菌株。在25℃和28℃条件下,A2菌株与pslb8菌株在黄瓜子叶内的菌落数量增长速率无明显差异。
2.7 不同温度下病原菌体外生长能力测定
在20℃条件下,A2菌株在第16h进入对数生长期,在第44h进入稳定期,在第92h出现衰退现象;pslb8菌株一直处于生长期且较迟缓;在25℃条件下,A2菌株在第12h进入对数生长期,第34h进入稳定期,在第72h进入衰退期,pslb8菌株生长较迟缓,在第84h进入稳定期;28℃条件下,A2菌株在第9h进入对数生长期,A2菌株在第30h时趋于稳定增长,在第60h菌株生长进入衰退期,pslb8菌株生长迟缓,生长期延长。由以上结果可知:在20℃条件下,A2菌株维持在稳定期的时间较长,在3个温度条件下,pslb8菌株均生长缓慢,随着温度升高,pslb8菌株在后期生长速率比A2菌株的生长速率快。说明在20℃条件下,A2菌株的体外生长(72h内)能力强于pslb8菌株(图5)。
通过对黄瓜细菌性茎枯萎病病原菌不同温度下病情指数、体内和体外生长能力的测定,可以看出,在20℃条件下,A2菌株的生长能力一直强于pslb8菌株,这与20℃条件下A2菌株的致病力强于pslb8菌株的结论相符。
3 结论与讨论
2003年以来在我国黑龙江、吉林、辽宁、内蒙古、北京、山东、山西、河北和河南等地黄瓜细菌性茎枯萎病均有不同程度的发生。田间调查发现,黄瓜的果实、茎秆和叶片均可被侵染。成株期叶片通常从边缘开始发病,形成“V”字形或圆形病斑,病斑周围有黄色晕圈,有时也从叶片中部开始发病,叶片水浸状褪绿,后期整个叶片表现腐烂症状,严重时造成病斑穿孔,病菌可沿叶脉扩展并侵染叶脉。茎秆发病初期,发病部位呈水浸状,有流胶现象,严重时可见大量的白色胶状物质溢出,通风干燥后白胶变黄;发病中期茎秆纵向开裂,表现为软腐症状;发病严重时茎秆由里向外软腐,造成整株植株萎蔫、死亡。果实发病病斑呈水浸状,中后期果实表面流出白色胶状物,果实内部呈现软腐症状,或呈开裂状,后期黄瓜变黄腐烂。本研究利用生理生化反应对黄瓜细菌性茎枯萎病的病原菌进行了鉴定,同时也用多种分子生物学技术对病原进行了再确定,即达到了经典细菌学鉴定病菌的要求也应用了分子技术对其快速验证,最终确定黄瓜细菌性茎枯萎病的病原菌为丁香假单胞菌流泪致病变种P.syringae pv.lachry-mans,与黄瓜细菌性角斑病及流胶病的病原菌为同一变种。1984年黄仲生等黄瓜细菌性角斑病的病原菌鉴定为P.syringae pv.lachry-mans。李宝聚等在河南、辽宁、山东、山西、天津等地发现黄瓜细菌性流胶病(初称为细菌性茎软腐病,后更改为细菌性流胶病)。孟祥龙等确定了黄瓜流胶病的病原菌为丁香假单胞菌流泪致病变种和胡萝卜软腐果胶杆菌巴西亚种。本实验室从采集的样品中只分离到丁香假单胞菌流泪致病变种,沒有分离到高温下容易引起植物发病的胡萝卜软腐果胶杆菌巴西亚种。本研究结果表明:黄瓜细菌性茎枯萎病菌株A2和黄瓜细菌性角斑病菌pslb8在不同温度下的致病力和生长能力并不相同。20℃条件下,A2菌株的致病力、体内生长能力和体外生长能力均强于pslb8菌株,说明相对低温条件下,A2菌株侵染黄瓜的能力更强,相对低温的条件下更有利于病害的发生。这与在田间调查发现黄瓜细菌性茎枯萎症状主要出现在秋冬以及初春低温时期相符合。黄瓜角斑病的病斑为近圆形或不规则病斑,严重时病斑连成片且受叶脉限制呈不规则形,这与黄瓜茎枯萎病的症状有所不同。
梨火疫病原梨火疫欧文氏菌犈狉狑犻狀犻犪犪犿狔犾狅狏狅狉犪通过胞外酶果聚糖蔗糖酶降解蔗糖产生β2,6呋喃低聚糖(果聚糖)。植物病原丁香假单胞菌中,细胞外多糖果聚糖蔗糖酶(Lsc)介导胞外多糖—果聚糖的产生。Lsc由两个功能基因犾狊犮犅和犾狊犮犆编码,两个基因为温度依赖性表达,在18℃时转录水平最高。LscB和LscC的区别仅在于5个氨基酸残基,其中一个是半胱氨酸残基。温度响应性表达依赖于果聚糖蔗糖酶(Lsc)基因的特定启动子以及调节该过程的调节子。在恶臭假单胞菌犘狊犲狌犱狅犿狅狀犪狊狆狌狋犻犱犪中犾狊犮犅和犾狊犮犆不诱导果聚糖形成。我们研究证明黄瓜茎枯萎病的病原菌在低温下具有更强侵染能力,黄瓜茎枯萎病的低温下发生是否受犾狊犮犅和犾狊犮犆基因调控需要进一步研究,以便为病害防控提供科学的理论依据。

