海洋细菌来源几丁质酶的研究进展
张新月,张月琪,王凤彪,王纪生,倪浩东,王致鹏
(青岛农业大学海洋科学与工程学院,山东青岛 266109)
几丁质是海洋环境中含量最为丰富的可再生资源,每年有超过1011吨几丁质形成[1]。几丁质也是仅次于纤维素的第二大类天然高分子化合物。虽然在全球水生生物圈中几丁质总量很大,但在海洋沉积物中几丁质含量并没有实质性增加。因为几丁质颗粒一旦到达海底就会被细菌为主的海洋微生物产生的生物酶降解,以维持碳氮循环的平衡[2]。因此,几丁质降解细菌对海洋生态系统中几丁质的物质循环起着重要作用。
这些细菌产生几丁质酶(Chitinase),将长链几丁质水解为N-乙酰-D-氨基葡萄糖,进而被微生物利用。迄今为止,已鉴定出30多种海洋细菌所产的几丁质酶[2-6]。另外,人们对海产品的需求量也日益增加,海产品加工所产生的贝类、鱼鳞、虾蟹等甲壳类废物不断积累。虾蟹等甲壳类动物每年产生25~35亿吨的几丁质废物[7],贝类加工所剩余废物中几丁质占废物干重的20%~58%[8],废物的产生与累积对环境造成严重的危害[2]。同时,利用几丁质酶制备N-乙酰葡萄糖具有高效和低成本等优点,具有工业上的应用价值。本文着重介绍海洋中几丁质的结构和来源,几丁质酶的作用方式及分类,海洋细菌来源几丁质酶的催化特性及其在多领域的应用。
1 海洋中几丁质的结构和来源
几丁质(Chitin)是由N-乙酰-D-氨基葡萄糖(Nacetyl-D-glucosamine, GlcNAc)通过β-1,4糖苷键连接而成的线性多糖[9]。几丁质结构与纤维素相似,如图1[10]所示,当C2位置上的R基为羟基时,是纤维素结构式;当C2位置上的R基为乙酰氨基时,是几丁质结构式;当乙酰氨基脱去乙酰基团连接一个氨基时,是壳聚糖结构式。根据其来源,几丁质存在于α、β和γ三种形式,区别于多糖连接的取向,主要以α和β形式存在[11-12]。

图1 几丁质的分子结构Fig.1 Molecule structure of chitin
几丁质在自然界中分布广泛,主要存在于虾、蟹等甲壳动物、真菌及高等植物细胞壁、昆虫肠道内壁中。在海洋环境中,几丁质是由许多海洋生物,如软体动物、原生动物、真菌和甲壳类动物等产生的最为丰富的复杂碳水化合聚合物[13],大多存在于贝类、蟹虾等甲壳类的外壳、头足类的内壳(鱿鱼的胃、乌贼的嘴部、胃粘膜以及软骨)中[14];在南极磷虾壳中几丁质的含量约占整条磷虾干重的4%[15],新鲜的虾头约占整个虾重的30%,具有丰富的甲壳资源;其次还存在于海葵、海兔、海鞘、海绵以及海泥中[16]。
海洋水产品生产和加工所产生的几丁质废弃物每年多达产25~35亿吨。对于过多的几丁质废物,解决该问题的最佳方法就是降解几丁质以生产几丁寡糖等功能产品。这样的方法不仅减少环境污染,而且具有工业价值。降解几丁质的方法包括化学法、物理法和酶法[17]。化学法采用强酸和强碱进行,存在收率低,成本高和腐蚀性强等问题[18]。物理降解方法反应条件苛刻,反应稳定性较差,产物不均一且有大量废水产生,严重污染环境。而酶降解反应条件温和、产率高、对环境无污染,是新环境友好型的替代方法,是制备几丁寡糖的重要技术[19]。
2 几丁质酶的作用方式和分类
几丁质酶是专一降解几丁质生成几丁寡糖或单糖的一类酶的总称[20]。它能将几丁质水解生成几丁寡糖、几丁二糖和N-乙酰-D-氨基葡萄糖。如图2所示,根据切割位点的不同,可将几丁质酶分为内切几丁质酶、外切几丁质酶和N-乙酰氨基葡萄糖苷酶。内切几丁质酶沿聚合物内部随机位点切割生成几丁寡糖,外切几丁质酶作用于糖链的非还原端将其切割成几丁二糖,N-乙酰氨基葡萄糖苷酶将内切几丁质酶产生的寡糖分解为单体N-乙酰葡萄糖胺[9-10,21-22],最终将其代谢生成所需能量。在几丁质酶发挥作用的过程中通常需要外切和内切型的几丁质酶协同作用,首先不溶性长链几丁质被切割为小短链,随后通过N-乙酰氨基葡萄糖苷酶将乙酰壳多糖分解为N-乙酰葡萄糖胺[22]。

图2 几丁质酶水解几丁质示意图Fig.2 Schematic diagram of chitinase hydrolysis of chitin
根据催化结构域的多少,几丁质酶可以分为单催化结构域的几丁质酶和多催化结构域几丁质酶。根据酶结构域氨基酸序列不同,几丁质酶分属于18和19家族。第18家族几丁质酶主要包括细菌、真菌、病毒、哺乳动物以及部分植物来源的几丁质酶,其中有记录的产几丁质酶的微生物细菌占有70%以上;第19家族主要存在于放线菌、霉菌以及大部分植物中[9-10]。大多数几丁质酶是模块化的,除信号肽和催化结构域外还包含辅助结构域的蛋白,比如碳水化合物结合模块(CBMs)、几丁质结合结构域(ChBDs)和纤连蛋白型结构域(Fn-III)等。信号肽通常位于几丁质酶的N端,在几丁质酶向细胞外基质的转运和外部几丁质的利用中起着重要作用;ChBDs能够促进酶与底物的结合,但不具有催化活性,因而ChBDs的缺失不影响酶降解几丁质的活性;Fn-III是一种糖蛋白,除了充当其他结构域之间的连接外,还可能引起酶与细胞外基质的粘附[23]。而在某些多催化域几丁质酶之中,两个催化域之间的氨基酸序列同源性通常较低,并且两个催化结构域彼此具有的特征[24]。
3 海洋细菌来源几丁质酶的催化性质
近年来,科研工作者已经对几丁质酶进行了许多研究。因海洋中几丁质含量丰富,几丁质酶在海洋微生物中广泛存在。其中海洋细菌中几丁质酶研究得最为广泛,已经鉴定出多种具有pH和温度稳定性以及良好催化特性的几丁质酶。与陆地来源几丁质酶相比,部分海洋几丁质酶具有较好的热稳定性和pH耐受性,具有更好的应用潜力。在表1中,简单概括了海洋细菌中几丁质酶的基本催化性质[25-26]。
3.1 pH性质
从表1中可以看出,大多数几丁质酶在碱性条件下表现出更好的稳定性。例如,从芽孢杆菌(Bacillussp. R2)中分离的几丁质酶R2在pH7.5时表现出最大活性,分别在pH7.0和8.0时保留其活性的57%和62%[31];假交替单胞菌(Pseudoalteromonassp. DL-6)低温几丁质酶ChiA在pH8.0时表现出最大活性,在pH10.0时保留其活性的70%,ChiC在pH9.0时表现出最大活性,在pH8.0~9.0时保留其活性的80%[28];在粘质沙雷氏菌(Serratia marcescens)中分离的几丁质酶rCHI-2,在37 ℃,pH9.0时孵育1 h后能保持90%以上活性[34];Pseudoalteromonassp.DL-06在pH 7.0时表现最大活性,而在pH12.0还有48%的酶活力[38]。
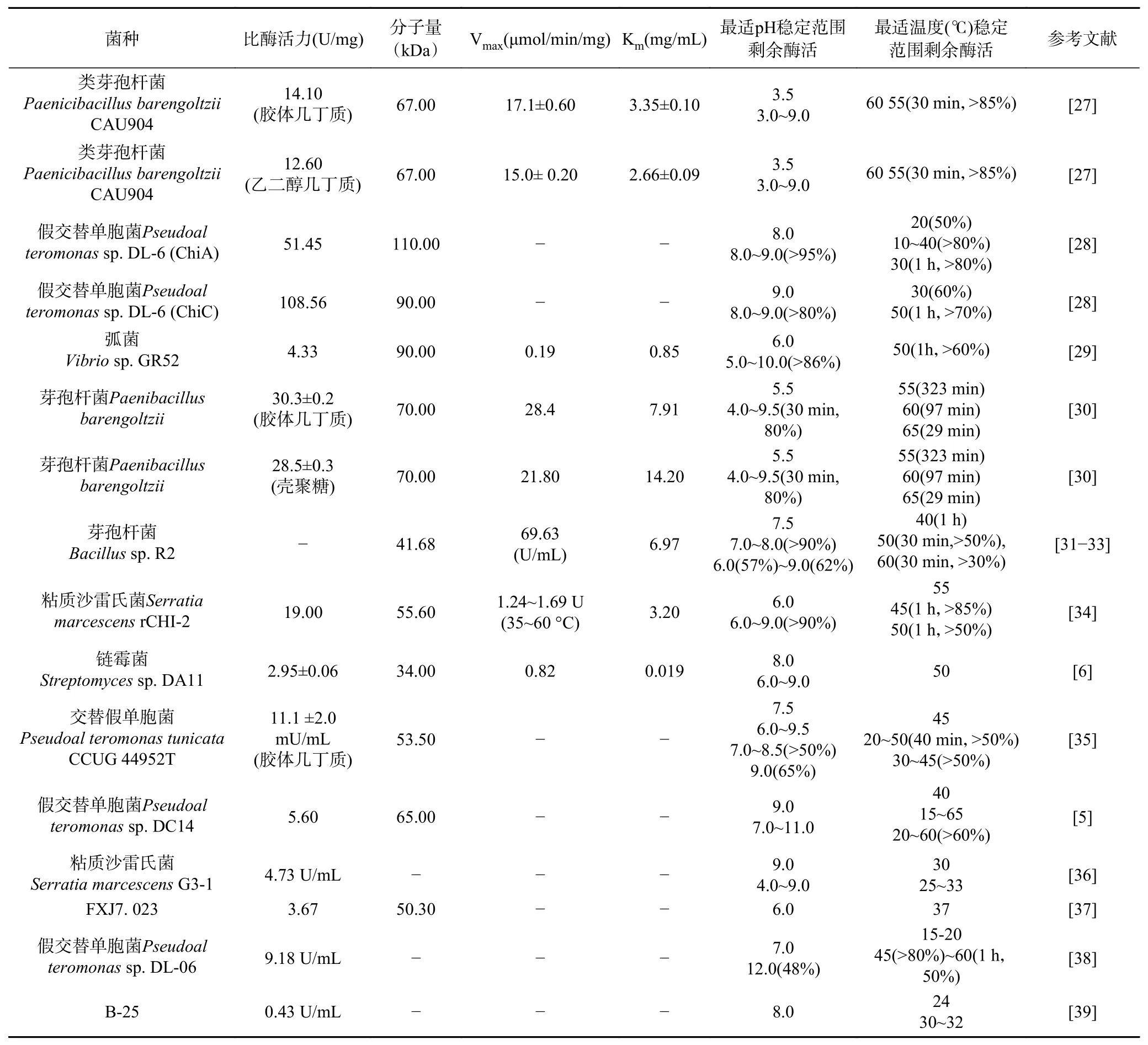
表1 不同海洋几丁质酶产生菌的生化和酶学特性Table 1 Biochemical and enzymatic characteristics of different marine chitinase-producing bacteria
从表1中的最适pH范围一列进行各种海洋几丁质酶产生菌酶学性质的总结,得出如图3所示结果,最佳pH范围介于类芽孢杆菌(Paenicibacillus barengoltziiCAU904)的3.5至Serratia marcescensG3-1的9.0之间。其中,海洋细菌Bacillussp. R2和交替假单胞菌(Pseudoal teromonas tunicataCCUG 44952T)在弱碱(pH7.5)环境下具有最佳活性;Pseudoal teromonassp. DL-6(ChiA)、链霉菌(Streptomycessp. DA11)、B-25在pH8.0具有最大活性,其余大部分都是在碱性环境下保持较高的降解能力,研究表明[31-33,35],大多数海洋细菌几丁质酶在碱性pH并接近于海水pH时具有最大活性,但也会有少数的海洋细菌Paenicibacillus barengoltziiCAU904、芽孢杆菌(Paenibacillus barengoltzii)、弧菌(Vibriosp.GR52)、橄榄链霉菌(Streptomyces olivaceusFXJ7.023)在酸性条件下表现最大活性。因此在碱性条件的培养下,源自海洋的几丁质酶表现出最大活性是非常合理的。

图3 不同海洋几丁质酶活性的最佳pH比较Fig.3 Comparison of optimum pH for maximal activity of various marine chitinase-producing bacteria
3.2 温度性质
此外,热稳定性是工业应用中最重要标准之一,部分几丁质酶表现出良好的稳定性。如Bacillussp.R2的几丁质酶在40 ℃时表现出最大活性,分别在50和60 ℃孵育30 min后仍保留50%和30%活性;Pseudoal teromonassp. DL-6低温几丁质酶中,ChiA在30 ℃孵育1 h后仍保留80%以上活性,ChiC在50 ℃孵育1 h后仍保留70%以上活性;在Serratia marcescensrCHI-2中分离的几丁质酶在55 ℃时表现出最大活性,在45 ℃孵育1 h后仍保留85%活性;Paenicibacillus barengoltziiCAU904在60 ℃时表现出最大活性;Pseudoal teromonassp.DL-06在低温15 ℃具最大活性,在60 ℃具有孵育1 h后仍保留50%活性。
从表1中的最适温度范围一列进行各种海洋几丁质酶产生菌酶学性质的总结,得到如图4结果显示,最佳温度范围介于Pseudoal teromonassp. DL-06的15 ℃至Paenicibacillus barengoltziiCAU904的60 ℃之间。这项研究表明,各种几丁质酶的最佳温度范围维持在15~60 ℃,大多数几丁质酶的最佳温度均高于30 ℃,除了陈立功等[28]、王晓辉等[38]研究的Pseudoal teromonassp. DL-6 分别在20、15 ℃具有最佳活性。具有热稳定性的几丁质酶更有利于实现工业化生产,不会受到温度的限制,从而减少工业化过程,降低成本。

图4 不同海洋几丁质酶活性的最佳温度比较Fig.4 Comparison of optimum temperature for maximal activity of various marine chitinase-producing bacteria
3.3 金属离子对几丁质酶的影响
据报道,K+、Na+、Ca2+、Mg2+等金属阳离子可以提高酶活性,而Ag+、Hg2+、Ba2+、Co2+、Cr2+和Cd2+等重金属阳离子则有抑制作用[6,33-34,40]。例如Mn2+在Bacillussp. R2中被称为激活因子,而在Pseudoal teromonassp. DC14和Vibriosp. GR52被认为是几丁质酶的抑制因子;Cu2+对Vibriosp. GR52和Streptomycessp. DA11具有激活作用,对Bacillussp. R2和Serratia marcescensG3-1具有抑制作用,对Pseudoal teromonas tunicataCCUG 44952T具有完全抑制作用,而对Paenicibacillus barengoltziiCAU904却没有影响。
在Han 等[6]、郑家敏等[29]的研究过程中除了进行金属离子对几丁质酶的影响之外还发现SDS对几丁质酶的活性有明显抑制作用;在Fu等[27]研究中发现SDS和EDTA对Bacillussp. R2没有影响。这就表明相同金属离子或相同溶液在不同菌属中的作用效果大不相同,这也许和酶的构象变化有着密切关系。
3.4 其他催化特性
最大反应速率Vmax和Michaelis-Menten constant(Km)是最重要的酶动力学参数。它们是根据Lineweaver-Burk法计算得出的,用于指导研究和工程设计。Km量越小,它对底物的亲和力越高,酶越灵活,它达到Vmax的速度就越快。表1给出了多种酶在最佳温度和pH条件下的Vmax和Km,Bacillussp.R2在Km为6.97时具有Vmax=69.63 (U/mL);Paenibacillus barengoltzii以壳聚糖为底物是在Km为7.91时具有Vmax=21.8 μmol/(min/mg)。
除此之外,各种纯化的几丁质酶分子量也是重要生化特性之一。在本文引用的大多数研究中,SDS-PAGE的分子量都已估算出来。来自不同海洋细菌的几丁质酶分子量介于Streptomycessp. DA11的34 kDa和Pseudoal teromonassp. DL-6(ChiA)的110 kDa之间,在研究的所有报告中,孤立的几丁质酶均以单条带出现,这表明它们是单体酶。
4 几丁质酶及其产物的应用
海洋为新型化合物提供了丰富资源,在酶制剂方面具有潜在市场价值,近年来由于工业酶的易于培养和生产等优点,尤其是对海洋微生物来源的酶的需求,对它们的应用日益增加[41]。通过几丁质酶处理制备多种几丁寡糖、N-乙酰氨基葡萄糖及其各类衍生物, 具有抗真菌活性[21]、抗肿瘤活性[42]及促进有益微生物生长等作用,已广泛应用于农业、医药、食品、环保等领域[43-44]。
4.1 在农业与生物防治领域的应用
几丁质是真菌和昆虫等生物体结构中的主要成分,植物和高等生物中不含几丁质。几丁质酶降解几丁质破坏有害生物体结构,而对农作物不产生危害,因此可将这一特性应用于病虫害防治[45]。在未来几年内增加对几丁质酶的深刻研究,对其作为生物农药的潜力进行更系统分析,研究合适配方,实现大规模生产,在几丁质酶制剂与其他农药协同的作用下,提高产品的稳定性和持久性,真正发挥其功效,不断提高农产品产量与质量[44]。
几丁质是真菌细胞壁的主要成分,几丁质酶可以通过抑制病原菌孢子萌发及菌丝的生长来发挥防御作用,这一原理已成为研究热点之一。例如,菌丝抑制试验证明RmChi44[46]对植物病原真菌具有很强的抗性,包括炭疽菌(Colletotrichumsp.)、尖孢镰刀菌(Fusarium oxysporum)、镰孢镰刀菌(Fusarium solani)以及绿色木霉(Trichoderma viride)。Li等[21]从Corallococcussp. EGB中获得的抗真菌几丁质酶对植物病原体米曲霉具有潜在抗真菌活性。Han等[6]研究的Streptomycessp. DA11所分离的出几丁质酶针对黑曲霉(Aspergillus niger)和白色念珠菌(Candida albicans)具有抗真菌能力。Brzezinska等[47]综述了有关几丁质酶抑制真菌生长的能力,改善植物病原真菌介导的植物疾病的能力。利用微生物和病毒几丁质酶作为生物技术工具,控制和对抗真菌、昆虫等植物病原体,可有效减少对农作物的危害,表明几丁质酶可能具有控制疾病的潜在应用。
4.2 在医药领域的应用
几丁质酶可对人体炎症反应起一定的生理作用,能够用于一些疾病的监控和诊断。几丁质酶水解几丁质生成的几丁寡糖具有提高机体免疫力、降血压、降血脂、降血糖、抑制癌细胞生长、抗肿瘤等多种功能,在医药领域具有广阔的应用前景[48-50]。例如,Bussink等[51]实验验证人类几丁质酶AMCase具有免疫调节和水解几丁质的双重功效,可用于哮喘病治疗药物的研发;壳六糖和壳庚糖具有抗肿瘤活性;酸性哺乳动物几丁质酶AMCase和壳三糖苷酶也可能与结膜炎,鼻息肉发病机制,腺样体肥大,神经脊髓炎和胃炎有关。
几丁质酶凝集素的生理功能尚未完全了解,但其似乎参与了不同的过程,例如组织重塑、受精和先天免疫,目前,已有研究指出,可以使用几丁质酶凝集素作为不同的疾病在评估阶段、预后和治疗反应的生物标志物。例如,人几丁质酶3-样蛋白1(CHI3L1)血浆水平可用于评估严重程度子痫前期、慢性子痫的预后心力衰竭、监测治疗反应银屑病[52]。Annamalai等[53]报道了从海鲜工业废水中分离出的粪便AU02通过发酵海洋废物显示出抗氧化活性。研究结果表明,具有抗氧化活性的寡糖可被存在于体外培养上清液中的几丁质酶水解,因此海洋废物可用于生产高附加值的成分,并且药理研究可扩展其在医学领域的用途。
4.3 在食品领域的应用
氨基葡萄糖以及衍生物N-乙酰氨基葡萄糖可以作为营养补品,而且可以对某些真菌和细菌的生长起到抑制作用,因此可以作为食品中的保鲜剂或者抗菌剂[52];几丁寡糖进入人体内并不会被胃酸分解,能够有效防止人体吸收过多的热量,可以预防肥胖症、糖尿病的发生。Bhuvanachandra等[11]在CsChiL中得到一种具有转糖基化活性的几丁质酶,可以用于制备食品工业中几丁质废物生物转化的鸡尾酒。Hou等[43]通过用超声的方法证实对几丁质降解的促进作用,相当于提供一种用于功能性食品等生产的实用方法。此外,可以根据几丁质及其衍生物的降血糖、降血脂、延缓衰老、抗疲劳等作用制成具有相关功能的保健品。
5 结语
本文综述了海洋细菌来源几丁质酶的作用方式、催化性质和应用。随着几丁质酶研究的深入,海洋中巨量的几丁质资源受到越来越多的关注。从生态学角度出发,几丁质酶为主的几丁质的降解过程能丰富海洋碳氮循环的理论。从工业应用角度,多种海洋细菌来源几丁质酶的纯化和鉴定为几丁质酶的工业化应用打下基础;为生产几丁质材料作为医疗、农业、食品等领域提供了更广阔的前景。几丁质酶有望成为一种新型的工业酶制剂。

