铜纳米簇荧光猝灭法测定林可霉素
李志英, 李健如
(忻州师范学院化学系,山西忻州 034000)
金属纳米簇是由几个或者几十个原子组成的相对稳定的结构体,尺寸小于10 nm,接近电子的费米波长,特有的量子尺寸效应使得其在光学和电学上具有随粒径大小变化而改变的性质[1]。相对于Au和Ag纳米簇,Cu纳米簇(Cu NCs)报道较少。Cu NCs由几个至几十个Cu原子所组成[2],是一种可代替有机荧光团的新型荧光探针[3],由于其独特的尺寸依赖性,具有不同于原子或块状Cu的物质的电子性质和光学性质,且使用广泛、原料廉价和自然含量丰富等优点[4],具有良好的应用前景。但是Cu NCs在水溶液中的粒径大小及稳定性都很难控制,目前对于Cu NCs的研究仍处于发展阶段[5],因此,研究一种稳定且粒径小的Cu NCs是科研工作的一个热点。
林可霉素(Lincomycin,Lin)为林可胺类抗生素,临床上主要用于治疗革兰氏阳性菌,特别是耐青霉素的革兰氏阳性菌所引起的各种感染,也可以直接乳房注射治疗奶牛的乳房炎;6],因此在牛奶和猪肉里可能有该抗生素残留,影响消费者的身体健康,所以研究一种快速、简单测定林可霉素的方法是非常必要的。现有测定林可霉素的方法有质谱法[7]、高效液相色谱法[8]、化学发光法[9]、酶联免疫吸附法[10]、背景荧光免疫层析法[11]等。这些方法有的仪器价格昂贵,有的样品前处理复杂,不适合现场快速检测。本方法采取化学还原的方法以CuCl2为原料,聚乙烯吡咯烷酮(PVP)为模板,2-巯基苯并噻唑(MBT)为稳定剂,葡萄糖为还原剂,于常温下合成水溶性好且稳定、发射黄绿色荧光的Cu NCs。林可霉素对Cu NCs的荧光具有猝灭作用,据此建立了检测林可霉素含量的荧光分析新方法。该方法具有操作简便、检出限低、准确度高,可用于测定猪肉、牛奶等动物源性食品中林可霉素残留量。
1 实验部分
1.1 仪器与试剂
RF-5301PC荧光分光光度计(岛津(苏州)公司);UV-2550紫外分光光度计(岛津(苏州)公司);Tecnai G2 F205-TWIN透射电子显微镜(美国,FEI公司)。
林可霉素标准品(江苏艾康生物医药研发有限公司,CAS No.:859-18-7,纯度88%)溶液:准确称取0.0044 g林可霉素,溶解后将其定容到100 mL的容量瓶中,得到1.0×10-4mol/L储备液,避光保存。林可霉素注射液(天方药业有限公司、山东方明药业集团股份有限公司2 mL:0.6 g)溶液:精密吸取盐酸林可霉素注射液1 mL,用二次蒸馏水稀释到10 mL比色管中,制得含林可霉素6.77×10-5mol/L的溶液。2-巯基苯并噻唑(MBT,天津市光复精细化工研究所)溶液:准确称取0.0417 g MBT,加1.0 mol/L NaOH溶液1 mL溶解后,将其定容到25 mL的容量瓶中,得1.0×10-2mol/L的储备液,在4 ℃的冰箱里放置12 h后使用。聚乙烯吡咯烷酮(K30)(PVP,天津市光复精细化工研究所)溶液;准确称取1.25 g PVP,溶解后定容到25 mL的容量瓶中,得1.0×10-3mol/L的储备液。CuCl2(天津市化学试剂三厂)。实验所用药品均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 Cu NCs的制备于25 mL比色管中,依次加入0.5 mL 1.0×10-2mol/L CuCl2溶液,1.5 mL1.0×10-3mol/L PVP溶液,1.5 mL 1.0×10-2mol/L MBT溶液,1.5 mL 1.0×10-4mol/L葡萄糖溶液,用二次蒸馏水定容到25 mL,混合均匀,静置10 min后,于4 ℃的冰箱中保存(48 h内使用)。
1.2.2 林可霉素的检测取两支25 mL比色管,各加入0.5 mL Cu NCs溶液,2 mL pH=5.0的HAc缓冲溶液,其中一支加入0.5 mL 1.0×10-4mol/L林可霉素溶液,用二次蒸馏水定容到25 mL。室温下放置40 min后,用1 cm比色皿,设定狭缝宽度为10 nm,在激发波长355 nm,发射波长580 nm下分别测量荧光强度F0、F,计算ΔF(ΔF=F0-F)。
2 结果与讨论
2.1 Cu NCs的合成条件优化
考察了合成Cu NCs各种原料的用量。按“1.2.1”,固定其它条件不变,分别改变1.0×10-2mol/L CuCl2溶液,1.0×10-2mol/L MBT溶液,1.0×10-3mol/L PVP溶液和1.0×10-4mol/L葡萄糖溶液的用量,定容到25 mL制备Cu NCs,在激发波长335 nm下测量荧光光谱。结果表明:葡萄糖用量为1.5 mL,PVP用量为2.5 mL,MBT用量为2.5 mL,CuCl2用量为0.7 mL时Cu NCs的荧光最强。所以以上用量为制备Cu NCs的最佳条件。
2.2 Cu NCs稳定性实验和荧光量子产率
取0.5 mL Cu NCs溶液,固定其他条件不变,只改变温度、放置时间,光照、pH、氧化还原剂,测定Cu NCs的稳定性。结果表明:pH为5~7、温度为30 ℃时荧光最强,Cu NCs放置时间为10 min以后2 h内基本稳定,光照影响较小,加入0.25%的H2O2溶液作为氧化剂,以30 mg/L的Na2SO3溶液作为还原剂,分别测定Cu NCs 荧光强度的变化。结果表明加入H2O2和Na2SO3,体系荧光强度变化较小。
测量所合成的Cu NCs在335 nm处的吸光度和荧光发射光谱。以上所测得的所有荧光发射光谱用Origin软件求得峰面积。Cu NCs的量子产率根据如下公式计算[12]:ΦX=ΦR×(IX/IR)×(AR/AX)。式中,I代表荧光发射曲线的峰面积,A指吸光光度值,Φ指荧光量子产率值,下标X代表待测物,R代表标准物选取硫酸奎宁作为基准物质,已知其在激发波长为335 nm处的荧光量子产率为0.54,计算得Cu NCs 的荧光量子产率为0.47。
2.3 Cu NCs的表征
为了表征原料和产物的关系,分别配制1.0×10-3mol/L CuCl2溶液,1.0×10-2mol/L MBT溶液,1.0×10-3mol/L PVP(K30),1.0×10-4mol/L葡萄糖溶液。取0.5 mL的Cu NCs溶液定容到25 mL,用1 cm比色皿,测定250~450 nm处的紫外-可见光谱,结果如图1。上述溶液在335 nm激发波长下测定荧光光谱,结果如图2。图1中曲线1、2、3说明CuCl2、PVP、葡萄糖在350 nm处没有吸收,曲线4说明MBT只在280 nm处有吸收,曲线5说明Cu NCs在368 nm处有吸收,说明其它原料不影响Cu NCs对紫外光的吸收;图2曲线1表明Cu NCs在335 nm激发波长下,于580 nm左右出现较强的荧光;其它曲线说明CuCl2、PVP、葡萄糖、MBT溶液在580 nm处没有荧光。说明生成了Cu NCs,并且原料对Cu NCs的荧光没有干扰。
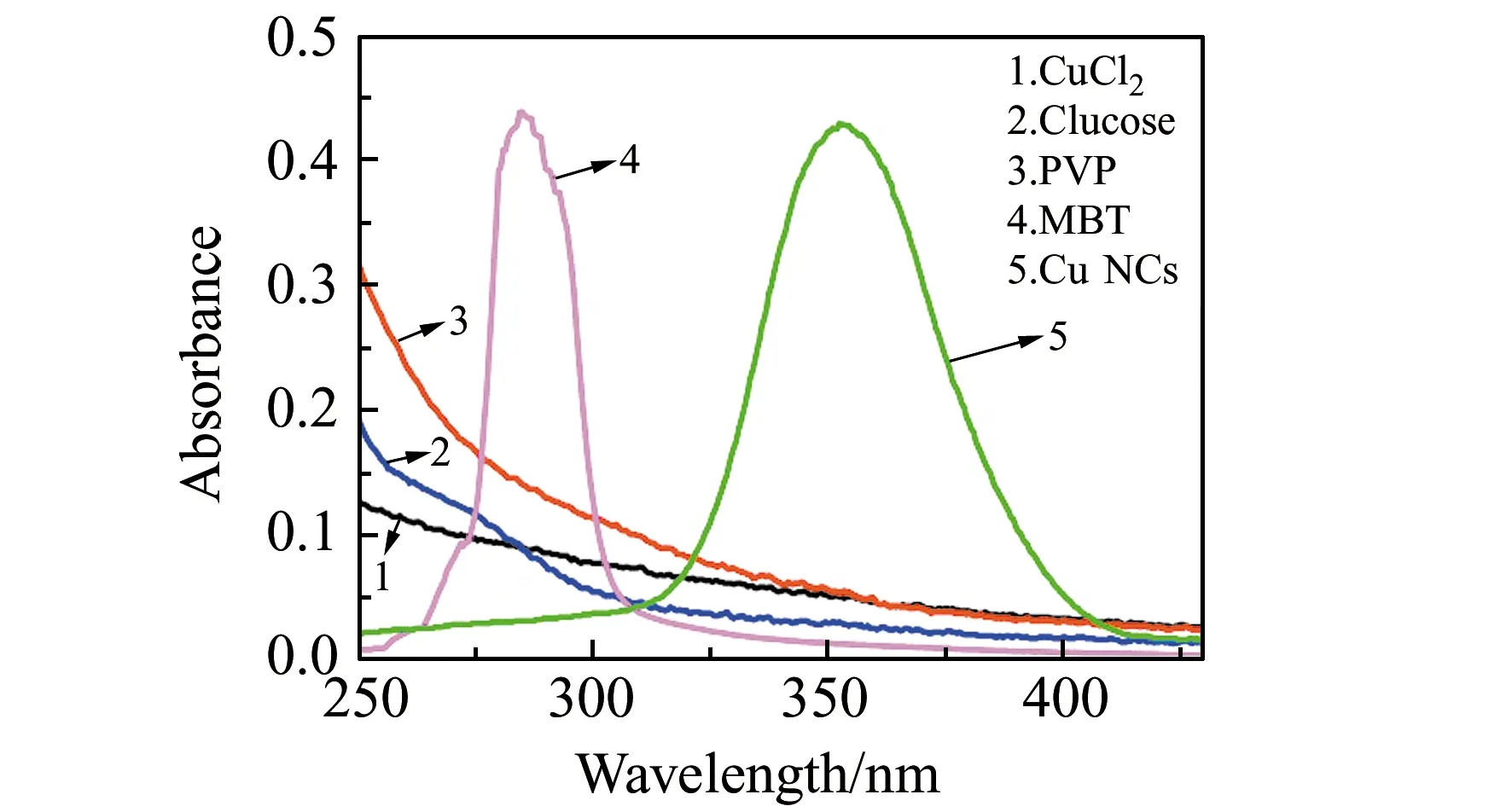
图1 Cu NCs体系的紫外光谱图Fig.1 The UV spectra of Cu NCs system
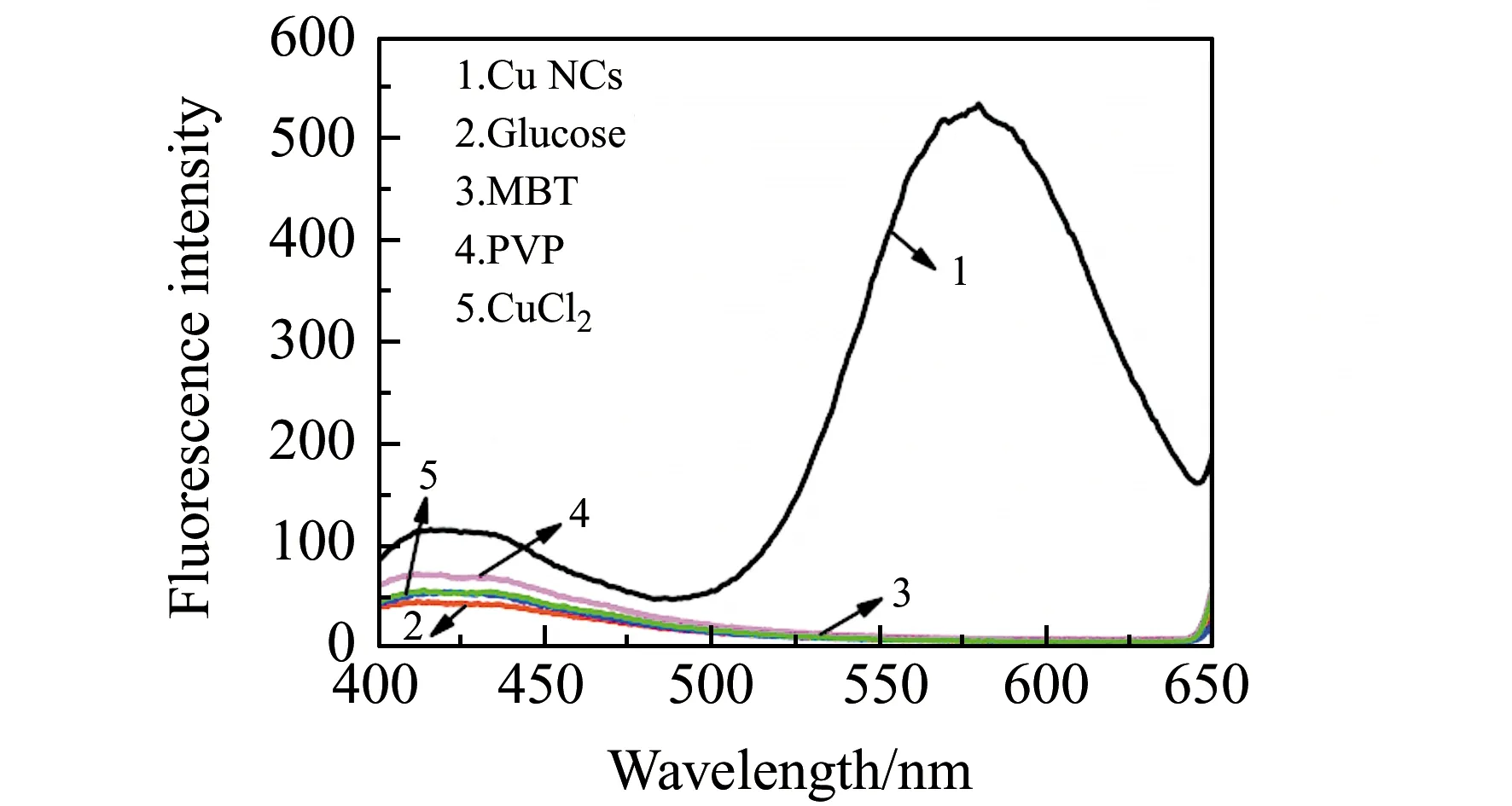
图2 Cu NCs及各原料的荧光光谱图Fig.2 Fluorescence spectra of Cu NCs and each raw material
为了表征是否生成了Cu NCs,把生成的Cu NCs溶液在普通微栅支持膜上附着三次,在红外灯下照射干燥,然后在Tecnai G2F205-TWIN透射电子显微镜(TEM)下进行检测,结果如图3。用X射线光电子能谱(XPS)测定Cu NCs体系各元素的化学状态,Cu的化学状态如图4。由图3可知,合成的Cu NCs的粒径分布均匀并基本呈球形,其平均粒径为5~7 nm左右。采用XPS测定样品中Cu的氧化状态,从全图来看,有C、O、N、S、Cu元素,从谱图4中看到,在932.3 eV和952.0 eV处观察到两个强烈的峰,这两个峰代表了Cu(0) 的2p3/2和2p1/2特征,证明合成了Cu NCs。

图3 Cu NCs透射电镜(TEM)图Fig.3 TEM image of Cu NCs
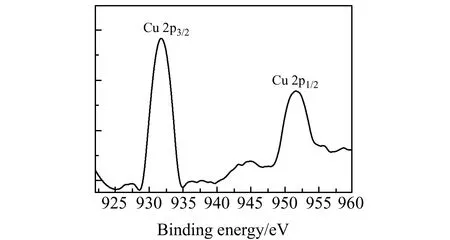
图4 Cu NCs 中Cu 2p的X射线光电子能谱(XPS)图Fig.4 XPS spectrum of Cu 2p for Cu NCs
2.4 测定林可霉素体系的荧光光谱图
于25 mL比色管中,各加入pH=5.0的乙HAc缓冲溶液2 mL,再分别加入0.5 mL Cu NCs,0.5 mL 1.0×10-4mol/L的林可霉素,同浓度的Cu NCs和林可霉素的混合物,用二次蒸馏水定容到25 mL,在激发波长335 nm处测得各自荧光强度,得到图5。图5表明:曲线1为Cu NCs 在580 nm处有较强的荧光,曲线3为林可霉素在580 nm处没有荧光,曲线2说明林可霉素加入Cu NCs溶液使其荧光猝灭,可以选择性测定林可霉素。实验测得林可霉素可以猝灭450 nm处MBT的荧光,推测林可霉素中季氨氮容易与巯基反应,结果MBT对Cu NCs的保护作用减弱,Cu NCs加大团簇趋势,荧光猝灭。
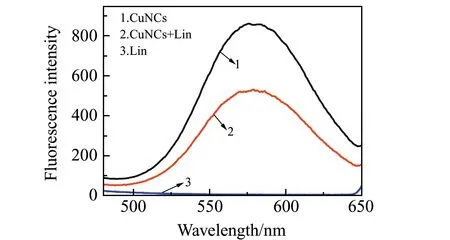
图5 林可霉素对Cu NCs作用的荧光光谱图Fig.5 Fluorescence spectra revealing the effects of lincomycin on Cu NCs
2.5 pH、反应时间和温度对体系的影响
用NaOH溶液和HCl调节测定体系的pH,研究pH对体系的影响。ΔF随pH的升高先增大后减小,当反应溶液pH=5.0,溶液的ΔF最大,即林可霉素对Cu NCs的荧光猝灭效果最好。所以本实验选用pH=5.0的HAc缓冲体系2 mL为反应介质。
体系在5 min后反应完全,并且在40 min时ΔF最大,以后基本不变,为方便测定故实验选择在40 min后测定。设定20 ℃、30 ℃、40 ℃、50 ℃、60 ℃不同的温度进行反应。结果表明:当反应温度为30 ℃时,溶液的ΔF最大,即林可霉素对Cu NCs的荧光猝灭效果最好。
2.6 工作曲线和检出限
按“1.2.2”的实验方法,取两支25 mL的比色管,准确加入0.5 mL的Cu NCs溶液,然后分别加入1.0×10-4mol/L、1.0×10-5mol/L、1.0×10-6mol/L、1.0×10-7mol/L林可霉素溶液,以不加林可霉素溶液作为空白,在激发波长335 nm处测定荧光强度,测定结果如图6。结果表明:林可霉素在浓度为4.0×10-8~8.0×10-7mol/L和8.0×10-7~2.0×10-5mol/L范围呈良好的线性关系,其线性关系式分别为:ΔF=210.8c+19.29(c,μmol/L);ΔF=28.42c+251.1(c,mol/L),相关系数(r)分别为0.9956 和0.9922。做11次空白试验,求得其标准偏差(δb),利用3δb/K公式求得检出限为1.01×10-8mol/L。
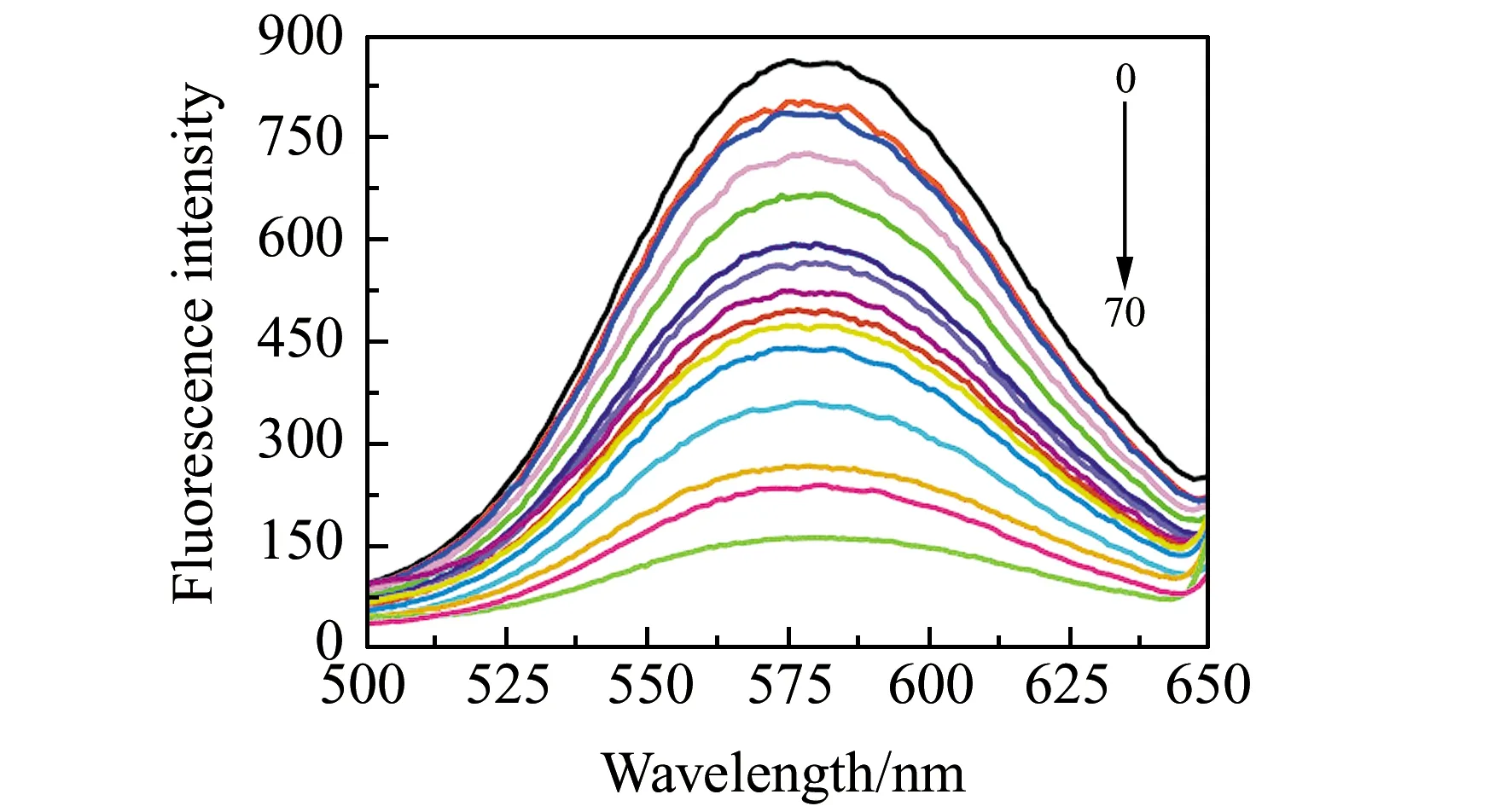
图6 不同浓度林可霉素下Cu NCs的荧光光谱Fig.6 Fluorescence spectra of Cu NCs with different concentrations of lincomycin
2.7 共存物质干扰测定
2.8 样品的检测和加标回收率
选择两个不同厂家的林可霉素注射液,取1 mL稀释后的林可霉素注射液分别为样品1和样品2。吸取伊利牛奶样品18 mL置于40 mL离心管中,加入1 mL 20%HAc溶液和1 mL二次蒸馏水。旋涡振荡5 min,于 4 ℃冷藏保存20 min。以6 000 r/min的转速离心10 min,吸取上清液。沉淀再加5 mL二次蒸馏水,旋涡振荡5 min,离心10 min,合并上清液[13],得样品3和样品4。4个样品按“1.2.2”的方法进行测定,平行测定3次,求得标准偏差较小,可知方法精密度较好;分别加入被测样的5、10、15 mL标准样品测定回收率,由回收实验可知,本实验系统误差较小。
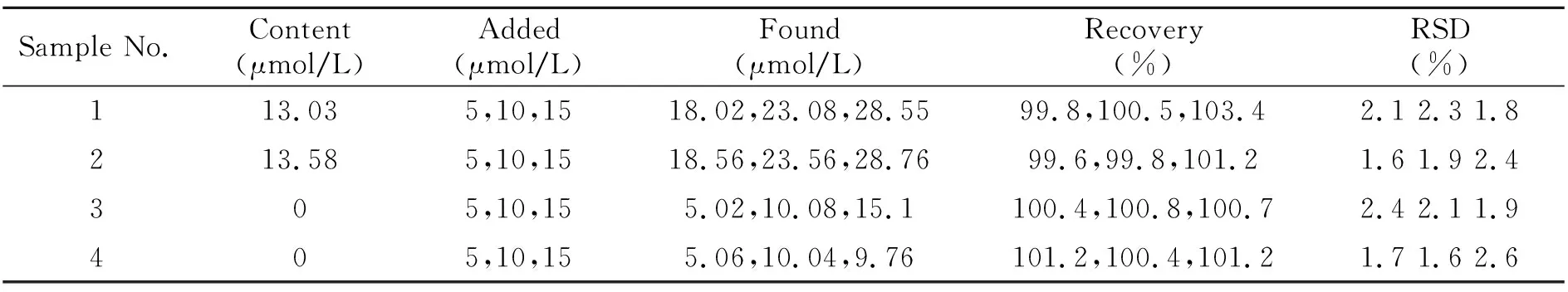
表1 样品的测定结果及回收率(n=3)Table 1 Determination results of sample and recoveries(n=3)
2.9 本法与液相色谱法比较
为了验证Cu NCs荧光猝灭法和国家标准方法(液相色谱法)的差异,取牛奶样品1 mL,分别加入一定量的林可霉素标准溶液,采用Cu NCs荧光猝灭法和国家标准方法检测结果如表2。采用 SPSS 17.0 软件,对Cu NCs荧光猝灭法测定值和国标法测定值经t检验分析(P>0.05),两种方法没有显著性差异。
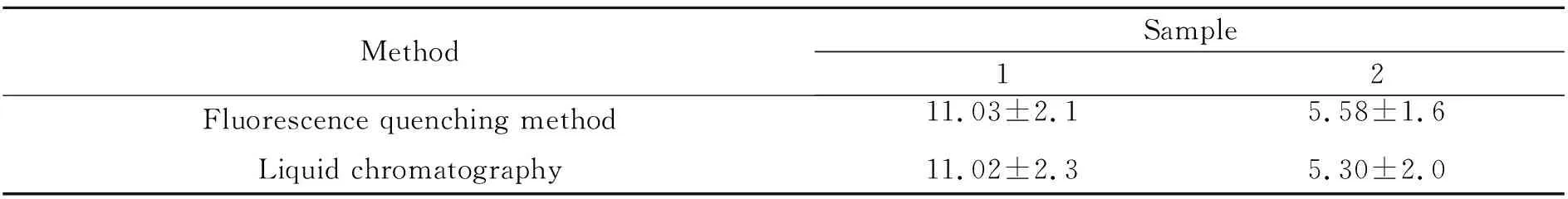
表2 本法和国标法测定结果比较(x+s,n=3,μmol/L)Table 2 Comparison of the determination results of this method and the national standard method
3 讨论
与传统测定林可霉素的方法相比,本方法在常温下合成水溶性好且稳定性好的Cu NCs,原料便宜,Cu NCs荧光量子产率较高,以此Cu NCs作为荧光探针检测林可霉素,紫外灯下可视黄绿色变深,方法检出限低,干扰较小,可用于制作光电传感器。本研究可用于检测林可霉素的残留,结果与国标法的检测结果用t检验分析,无明显差异。本方法操作简便,反应时间短,灵敏度高,可实现林可霉素的现场快速定量检测,为食品安全领域快速检测林可霉素奠定了基础。

