表皮生长因子诱导性成熟前绵羊卵母细胞体外成熟的机制研究
李玉杰,王海波,潘庆杰,颜 硕,李美玉,董焕声
(青岛农业大学动物科技学院,山东青岛 266109)
目前,利用幼畜体外胚胎移植技术挖掘优秀母畜的遗传潜力[1],在相对较短的时间里可以获得更多遗传稳定的优良后代[2],但由于性成熟前绵羊卵母细胞体外发育能力较低[3],从而影响体外胚胎生产的效率。相较体内成熟而言,卵母细胞体外成熟(In Vitro Maturation,IVM)脱离了体内微环境,导致卵丘扩散不完全或核质成熟不同步等现象,这严重影响着卵母细胞的成熟质量[4]。促黄体素(LH)诱导卵巢壁层颗粒细胞表达表皮生长因子(EGF)类因子[5],它们可以促进卵母细胞成熟、排卵等相关过程,EGF 类因子在颗粒细胞和卵丘细胞中提供了一种自分泌和旁分泌机制来调节卵母细胞生长发育的微环境[6]。性成熟后绵羊卵巢可以在LH 的周期性刺激下,促进卵巢壁层颗粒细胞表达EGF 类因子[7]。然而,绵羊在性成熟前阶段卵巢壁层颗粒细胞由于缺乏促性腺激素的周期性刺激,原始卵泡处于静息期[8]。在体内时,性成熟前阶段的绵羊卵母细胞在LH 峰到来前未启动EGF 信号[9]。因此,通过在性成熟前绵羊卵母细胞的体外成熟液中添加一定浓度的EGF 来模拟体内成熟微环境。目前,在国内尚未报道关于EGF 对性成熟前绵羊卵母细胞体外发育能力的影响。本实验旨在探究不同浓度EGF 对性成熟前绵羊卵母细胞卵丘扩展、第一极体排出、肌动蛋白(Actin)定位及纺锤体组装的影响,为改善性成熟前绵羊卵母细胞体外成熟培养体系和探究性成熟前绵羊卵母细胞体外成熟机制提供参考。
1 材料与方法
1.1 实验材料 促卵泡素(FSH)、LH 为RayBiotech公司产品;雌二醇(E2)、丙酮酸钠、EGF、透明质酸酶、Hoechest33342、聚乙烯醇(PVA)、矿物油等为Sigma 公司产品;胎牛血清(FBS)为Gibco 公司产品;DME/F-12、Medium199/EBSS 为Hyclone 公司产品;Actin-Tracker Green(肌动蛋白绿色荧光探针)为碧云天生物科技公司产品;小鼠来源的Anti-α-tubulin 为Proteintech 公司产品;山羊抗鼠 IgG DyLight®488 为Abcam 公司产品;青链霉素混合液、磷酸盐缓冲溶液(PBS)、TritonX-100、Tween 20 等为自索莱宝公司产品。
1.2 试剂配制 采卵液:M199 基础培养基、1%青链霉素混合液、0.1% PVA,0.22 μm 滤膜过滤除菌,4℃保存。
卵母细胞体外成熟液:M199 基础培养基、1% 青链霉素混合液、10% FBS、10 μg/mL FSH、10 μg/mL LH、1 μg/mL E2、2 mmol/L 丙酮酸钠、10 ng/mL EGF、100 ng/mL EGF,1 000 ng/mL EGF,0.22 μm 滤膜过滤除菌,4℃保存。
配制EGF 浓度:对照组为基础成熟液;实验组在基础培养液中添加10、100、1 000 ng/mL EGF 配成不同EGF 浓度的IVM 液,4℃保存。
1.3 卵母细胞的采集 绵羊(2~4 月龄性成熟前绵羊,1 年左右的性成熟后绵羊)卵巢均在山东省日照市东港区的绵羊屠宰场采集,采用抽吸法与切割法获取卵母细胞,即将抽取完卵泡液的卵巢使用手术刀片对卵巢表面的卵泡进行充分地切割,使卵泡内容物流到采卵液里。在体视显微镜下,挑选出卵丘颗粒细胞紧密包围和细胞质均匀的卵母细胞。用洗卵液清洗3 次后,在38.5℃、5% CO2的饱和湿度培养箱中体外成熟。
1.4 卵母细胞免疫荧光染色 将已在4%多聚甲醛中固定40 min 的卵母细胞用洗涤缓冲液洗涤3 次后,在1%Triton X-100(在PBS 中)中透化40 min。再洗涤3 次后,卵母细胞与1% BSA 孵育1 h,以阻断IgG 的非特异性结合,上述操作均在室温下进行。对于α-微管蛋白(纺锤体)染色,卵母细胞与抗α-微管蛋白抗体在4℃孵育过夜,然后洗涤5 次,并与二抗在室温孵育2.5 h。对于肌动蛋白染色,在室温下用Actin-Tracker Green 染色1 h。最终,细胞核在室温下用PI 染色30 min。然后在激光共聚焦显微镜下观察样品的荧光情况。
1.5 实验设计
1.5.1 年龄绵羊对卵巢中卵母细胞减数分裂进程的影响将取回的绵羊卵巢分为性成熟前组和性成熟后组,挑选出卵丘颗粒细胞紧密包围和细胞质均匀的卵母细胞。用透明质酸酶去除卵丘颗粒细胞,对性成熟前组和性成熟后组的卵母细胞分别做Hochest33342 染色,统计2 组卵母细胞减数分裂时期,进行6 次重复实验。
1.5.2 不同浓度 EGF 对性成熟前绵羊卵母细胞的卵丘扩展率和卵母细胞第一极体排出率的影响 使用含有不同浓度 EGF(0、10、100、1 000 ng/mL)的 IVM 培养基体外培养性成熟前绵羊卵母细胞24 h,依照Fagbohun 等[12]建立的主观评分方法统计卵丘扩展指数,根据第一极体排出情况,统计第一极体排出率。将收集的卵母细胞随机分为4 组,分别进行3 次重复。
1.5.3 不同浓度 EGF 对性成熟前绵羊卵母细胞成熟过程中肌动蛋白(Actin)定位和纺锤体(Tubulin)组装的影响 使用含不同浓度 EGF(0、10、100、1 000 ng/mL)的 IVM 培养基体外培养性成熟前绵羊卵母细胞6 h,此时大部分卵母细胞仍处于生发泡(GV)期,透明质酸酶去除颗粒细胞后,检测肌动蛋白定位。将体外培养16 h 的绵羊卵母细胞,此时的卵母细胞大部分处于MI 期,用Anti-α-tubulin(检测纺锤体组装情况)进行细胞免疫荧光染色。为了定量荧光强度,通过执行相同的免疫染色程序并在激光共聚焦显微镜上设置相同的参数,获得卵母细胞的荧光图像。将卵母细胞随机分为4组,分别进行3 次重复。
1.6 统计分析 利用 Image J 软件检测卵母细胞肌动蛋白荧光强度,采用Origin 2018 和Graphpad Prism 8 完成统计分析和图表绘制,使用SPASS 23.0 软件LSD 法进行单因素方差分析,以P<0.05 作为差异显著性的判断标准,结果采用平均值±标准误差表示。数据表示为至少3 个独立实验的统计结果。
2 结果
2.1 年龄对绵羊卵巢中卵母细胞减数分裂进程的影响GV 期卵母细胞,边缘区有1 个大而圆的细胞核,其中染色质呈松散的网状分布;生发泡破裂(GVBD)期卵母细胞,染色质凝聚,细胞核核膜破裂。如表1 和图1所示,性成熟前绵羊卵母细胞多数处于GV 期,极少数处于GVBD 期。性成熟前绵羊卵母细胞处于GV 期的比例高于性成熟后绵羊卵母细胞(P<0.05),GVBD 期的比例低于性成熟后绵羊(P<0.05)。

图1 Hoechst33342 标记绵羊卵母细胞的代表性图像

表1 性成熟前后绵羊卵巢中GV 期和GVBD 期的卵母细胞减数分析
2.2 不同浓度EGF 对性成熟前绵羊卵丘扩展指数和第一极体排出率的影响 如图2 所示,与0 ng/mL EGF 组相比,10 ng/mL EGF 组的卵丘扩展指数有提高趋势,但差异不显著,而100 ng/mL EGF 组的卵丘扩展指数显著提高。与100 ng/mL EGF 组相比,1 000 ng/mL EGF组的卵丘扩展指数有降低趋势,但无显著差异。如表2所示,100 ng/mL EGF 组第一极体排出率高于其他处理组(P<0.05),10 ng/mL EGF 和1 000 ng/mL EGF 组间第一极体排出率无显著差异。结果表明,100 ng/mL EGF 对卵母细胞核成熟有促进作用。性成熟前绵羊卵母细胞体外培养24 h 后的代表性图像见图3。

图3 性成熟前绵羊卵母细胞体外培养24 h 后的代表性图像
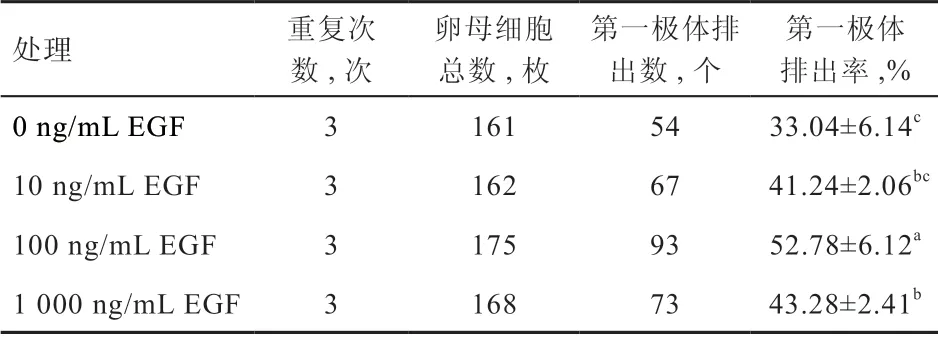
表2 不同浓度EGF 对性成熟前绵羊卵母细胞第一极体排出的影响

图2 不同浓度EGF 处理24 h 对性成熟前绵羊卵母细胞卵丘扩展的影响
2.3 不同浓度EGF 对性成熟前绵羊卵母细胞质膜肌动蛋白定位的影响 如图4 所示,沿着卵母细胞绘制截面将荧光信号进行量化,卵母细胞肌动蛋白定位正常时,肌动蛋白在质膜中分布均匀,信号较强;100 ng/mL EGF组性成熟前绵羊卵母细胞质膜肌动蛋白的正确定位率高于其他组(P<0.05)。结果表明,添加100 ng/mL EGF可促进性成熟前绵羊卵母细胞质膜肌动蛋白的正确定位。

图4 不同浓度EGF 对性成熟前绵羊卵母细胞GV 期肌动蛋白定位的影响
2.4 不同浓度EGF 对性成熟前绵羊卵母细胞纺锤体组装的影响 如图5 所示,在IVM 液中添加10 ng/mL EGF和100 ng/mL EGF 时,性成熟前绵羊卵母细胞纺锤体组装正确率分别为63.95%和68.10%,均高于0 ng/mL EGF 组(P<0.05),1 000 ng/mL EGF 组与0 ng/mL EGF组间无显著差异。结果表明,添加10 ng/mL 和100 ng/mL EGF 对性成熟前绵羊卵母细胞纺锤体的正确组装有促进作用。

图5 不同浓度EGF 对性成熟前绵羊卵母细胞MI 期纺锤体组装的影响
3 讨 论
哺乳动物的卵母细胞减数分裂经历细线期、合线期、粗线期后被阻滞在前期的双线期,阻滞期从数月长达几年或几十年,这种阻滞在绵羊中长达数月之久,直到性成熟后,在促性腺激素作用下卵泡周期性募集,排卵前LH 峰到来以后卵母细胞才恢复第一次减数分[13]。而且也有研究表明卵母细胞在LH 波峰诱导下恢复减数分裂后,生长充分的卵母细胞在排卵前会合成并储存大量蛋白质,为卵母细胞的后期发育提供物质基础,而仍处于生长阶段的卵母细胞未进行充分的物质储备[14]。研究发现,与性成熟后绵羊卵母细胞相比,性成熟前绵羊卵母细胞在IVM 0 h 时,其GV 率显著高于性成熟后绵羊卵母细胞,GVBD 率显著低于性成熟后绵羊卵母细胞,此结果表明性成熟前绵羊卵母细胞可能是因为大多数仍处于生长阶段,还没有为后期发育合成必需的储备物质,造成了体外发育能力低。Richani 等[16]研究发现,EGF 可以响应LH 信号并在促进卵母细胞发育中有重要作用,如促进卵丘扩展、卵母细胞生长、成熟及受精后的胚胎发育。研究发现,在IVM 液中添加10 ng/mL 和100 ng/mLEGF 时性成熟前绵羊卵丘细胞扩展指数有提高趋势,而当浓度增加至1 000 ng/mL 时卵丘扩展指数有所下降。卵丘细胞扩展指数是评估卵母细胞成熟质量的重要指标,卵丘细胞扩展指数越高,卵丘细胞产生有利于卵母细胞发育的成熟因子就越高[17],这将提高卵母细胞的体外发育能力。本研究发现,当在成熟液中添加10 ng/mL 和100 ng/mL EGF 后,第一极体排出率有提高趋势,而当浓度增加至1 000 ng/mL时第一极体排出率与100 ng/mL EGF 处理组相比显著下降,这可能因为卵丘扩展指数高增强了卵丘细胞和卵母细胞间的缝隙连接,从而激活了更多有利于卵母细胞成熟的信号通路[18],促进细胞核成熟,当添加1 000 ng/mL EGF 时,第一极体排出率下降,可能因为卵丘扩展指数的降低抑制了卵丘细胞向卵母细胞传递成熟信号。
除了卵丘细胞状态可判断卵母细胞成熟及质量外,DNA、RNA、蛋白质和其他必需物质的准备对于哺乳动物卵母细胞在GV 阶段恢复减数分裂也至关重要[19]。肌动蛋白是细胞骨架微丝的主要成分,它通过为细胞器的移动和染色体分离提供驱动力来介导真核卵母细胞的减数分裂活性[20]。本研究发现,成熟液中未添加EGF 时,性成熟前绵羊卵母细胞GV 期卵母细胞的肌动蛋白有定位失败的现象。Wang 等[21]报道,肌动蛋白细丝是细胞骨架网络的一个重要组成部分,它的动态变化在卵母细胞纺锤体定位、成熟和受精中起着至关重要的作用,所以当GV 期卵母细胞的肌动蛋白定位失败时会影响卵母细胞的后期发育能力。因此,本研究通过添加一定浓度的EGF 来验证EGF 是否可以帮助性成熟前绵羊卵母细胞肌动蛋白的正确定位,从而帮助卵母细胞提高体外发育能力。本研究结果显示,在添加10 ng/mL 和100 ng/mL EGF 时,性成熟前绵羊卵母细胞在体外培养6 h 时肌动蛋白定位正确率显著提高,并且当添加100 ng/mL 的EGF 时显著修复了性成熟前绵羊卵母细胞GV 期肌动蛋白聚合失败的现象,而高浓度1000 ng/mL EGF 试验组的肌动蛋白正确定位率与100 ng/mL EGF 试验组相比显著降低,发现GV 期肌动蛋白的正确定位与第一极体排出情况呈正相关。卵母细胞减数分裂的成熟与纺锤体的准确组装密切相关。Radek 等[22]研究表明,EGF 可以通过响应LH 信号促进微丝F-actin 的重排。而且Jo等[23]研究发现,在减数分裂成熟过程中,纺锤体受到微丝的牵引,逐渐由细胞中心区域向一侧的皮质区域移动,最后锚定在一侧的皮质区,发生不对称分裂并排出体积较小的极体。因此,本研究又进一步验证了一定浓度的EGF 对MI 期纺锤体形态的影响。在添加10 ng/mL和100 ng/mL EGF 时,纺锤体的组装正确率显著高于0 ng/mL 和1 000 ng/mL EGF 组,这可能是因为0 ng/mL和1 000 ng/mL EGF 组的微丝形成受阻,从而阻止稳定的梭形纺锤体建立和正确的同源染色体排列,造成不能挤出第一极体。但EGF 对性成熟前绵羊卵母细胞相关成熟基因表达的影响以及早期胚胎发育的作用有待进一步研究。
4 结 论
本实验结果显示,性成熟前绵羊卵母细胞IVM 培养液中添加100 ng/mL EGF 能够提高卵母细胞核成熟率,同时可以通过帮助肌动蛋白和纺锤体的正确组织来提高性成熟前绵羊卵母细胞在体外的发育能力。

