α-桐酸酰胺类化合物的合成及抑菌、抗癌活性研究
成 江,谢普军,黄立新*,张彩虹
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏 南京210042;2.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京210037)
桐油是我国特色的可再生林产资源,主要由多不饱和脂肪酸的三甘油酯组成[1]。α-桐酸是桐油中的主要脂肪酸,其分子结构为具有三共轭结构的十八碳烯酸,其质量占总脂肪酸的77%~82%[2]。α-桐酸可作用于生物体内多种受体,具有抗肿瘤、抗炎和调节脂质的作用[3-5]。此外,α-桐酸作为一种动物的饲料添加剂也有应用[6],其在动物体内可有效代谢为共轭亚油酸[7-8]。近年来,随着饲用抗生素的禁用,寻找安全、高效的饲用抗生素替代品成为研究的热点,以天然产物为先导化合物来设计新型的生物活性制剂是开发新药的重要思路。脂肪酸及脂肪链作为前体化合物,被广泛用于合成具有生物活性的脂肪酸衍生物。脂肪酸酰胺衍生物是具有酰胺基团的脂肪酸衍生物,具有广泛的生物活性,目前已被应用于抑菌、抗肿瘤等许多方面[9-10]。Matysiak等[11]以蓖麻油酸甲酯为原料合成了12种蓖麻油酸酰胺衍生物,并评价了蓖麻油酸酰胺衍生物对结肠癌细胞、骨髓瘤细胞和乳腺癌细胞的细胞毒性。结果表明:所有产物对这些癌细胞均有抑制作用,其中,左旋蓖麻油酸乙醇酰胺对结肠癌细胞的半数抑制浓度为6.9 mmol/L。Mohini等[12]通过将氨基酸、脂肪酸和3,3'-二氨基二丙基胺结合,合成分离得到了一系列脂肪酸酰胺衍生物,部分脂肪酸酰胺衍生物显示出良好的抗菌活性,其对金黄色葡萄球菌和大肠杆菌的半数抑制质量浓度范围为3~49 mg/L。Araujo等[13]通过多相催化的方法合成得到了亚马逊棕榈果油的酰胺衍生物,其对金黄色葡萄球菌的抗菌试验结果显示,半数抑制质量浓度为1.9 g/L。为了寻求具有潜在生物活性的脂肪酰胺类化合物,本研究以α-桐酸为原料合成一系列α-桐酸酰胺化合物,并对其抗菌和抗癌活性做出评价,以期为α-桐酸的利用开辟新途径。
1 实 验
1.1 材料、试剂和仪器
α-桐酸,通过文献[14]中的方法制备得到,纯度98%;草酰氯、三乙胺、二氯甲烷、间甲基苯胺、对甲氧基苯胺、对三氟甲氧基苯胺、对氟苯胺、间氯苯胺、2,3-二氯苯胺、邻甲基环己胺均为市售分析纯。金黄色葡萄球菌(Staphyloccocusaureus)、大肠杆菌(Escherichiacoli),购自北京北纳创联生物技术研究所;肝癌细胞(HepG2)、直肠癌细胞(DLD-1)、乳腺癌细胞(MCF-7),由江苏凯基生物技术有限公司提供。
Nicolet iS10型傅里叶红外光谱(FT-IR)仪,美国Thermo公司;Avance III型核磁共振(NMR)仪,瑞士Bruker公司;Q Exactive型高效液相-电喷雾质谱联用(HPLC-MS)仪,美国Thermo公司。
1.2α-桐酸酰胺衍生物的制备
以α-桐酸(1)和草酰氯为原料,在二氯甲烷中反应制得α-桐酸酰氯(2),再与不同的伯胺化合物反应,设计合成了一系列酰胺类化合物3a~3g,合成路线见图1。
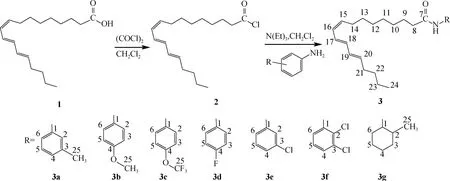
图1 α-桐酸酰胺衍生物的合成路线Fig.1 The synthetic route ofα-eleostearic amide derivatives
在150 mL烧瓶中加入56 g自制的α-桐酸(1),并加入50 mL二氯甲烷作溶剂,搅拌溶解,并充入氮气保护。将30 g的草酰氯溶解在30 mL二氯甲烷中,并缓慢滴加到反应的烧瓶中,30 min滴加完毕。室温反应3 h后,减压浓缩,蒸除溶剂和多余的草酰氯,得到α-桐酸酰氯(2),置于冰箱中备用。称取1 g三乙胺(10 mmol)和10 mmol不同取代的苯胺溶于10 mL二氯甲烷中倒入50 mL的烧瓶中。同时,称取3.3 gα-桐酸酰氯(11 mmol)溶于10 mL二氯甲烷中。在冰水浴条件下,往烧瓶内缓慢滴加α-桐酸酰氯的二氯甲烷溶液。滴加完毕后继续搅拌,薄层色谱(TLC)法跟踪反应进程。反应结束后用饱和碳酸氢钠溶液和蒸馏水洗涤有机相至中性,收集有机相。减压蒸馏后得到的粗产品通过硅胶柱层析,分离得到α-桐酸酰胺衍生物3a~3g。
1.3 化合物的表征
将得到的目标化合物通过HPLC-MS仪进行表征。液相色谱条件为:反向C18色谱柱(Thermo Fisher,250 mm×4.6 mm,5μm),紫外检测器检测波长254 nm;柱温30℃;进样量20μL。流动相为甲醇/水(体积比95∶5),流速为1 mL/min。使用红外光谱仪于400~4000 cm-1的范围内对目标化合物进行扫描,扫描次数32次,分辨率为4 cm-1。目标化合物的1H NMR和13C NMR分析分别使用氘代氯仿和氘代二甲亚砜作为溶剂,在600 MHz的核磁共振仪中进行测定。
1.4 生物活性测定
1.4.1抗肿瘤活性用噻唑蓝(MTT)法测定α-桐酸酰胺衍生物对于癌细胞活力的影响[15]。受试细胞用10%的胎牛血清配制成细胞悬液,之后将细胞接种在96孔板中,每孔约3×104个细胞,并用浓度为20和200μmol/L的α-桐酸酰胺衍生物处理72 h。同时,设置阳性对照组和阴性对照组,阳性对照组中加入等量的5-氟尿嘧啶,阴性对照组中加入等量的对应溶剂。处理后,将MTT(0.5 g/L)加入96孔板中,并将细胞在37℃下、5%CO2饱和湿度条件下培养4 h,用酶标仪在490 nm处测量溶液的吸光度(OD值)。实验中每组设置5个平行,化合物对癌细胞的抑制率按下式计算:

式中:η—抑制率,%;NOD—阴性对照组OD值;EOD—实验组OD值。
各化合物对癌细胞的半数抑制浓度(IC50)由各药物浓度的对数值和各浓度下的抑制率作线性关系计算出。
1.4.2抑菌活性参考Maneedaeng等[16]的方法进行抑菌实验。分别用接种环从斜面培养基中挑取少量金黄色葡萄球菌和大肠杆菌,接种至装有100 mL Mueller-Hinton肉汤的锥形瓶中,然后在37℃下孵育24 h。孵育后,将细菌悬浮液用盐水(0.9%NaCl)调节至菌液浓度为1×108个/mL。在96孔板的第一个孔中加入200μL溶于二甲基亚砜(DMSO)的α-桐酸酰胺衍生物,质量浓度为500 mg/L。之后的各孔均稀释为前一孔质量浓度的一半,各孔的质量浓度范围为0.977~500 mg/L。同时,设置阴性对照组和阳性对照组,阳性对照组中加入等量的氨苄青霉素钠,阴性对照组中加入等量的对应溶剂。然后,在每个孔中加入75μL先前制备的细菌悬液,并将板在37℃下孵育24 h,用酶标仪在600 nm处测量各孔的OD值。实验中每组设置5个平行,化合物对测试菌种的抑制率按公式(1)计算。各化合物对细菌的IC50由各药物浓度的对数值和各浓度下的抑制率作线性关系计算出。
2 结果与讨论
2.1α-桐酸酰胺衍生物合成与结构鉴定
3a:α-桐酸-3-甲基苯酰胺,黄色液体,熔点15~16℃。FT-IR(ν/cm-1):3292(N—H),2922(—CH2),1658(Ar,C==C),1089(C—O—C);LC-MS(m/z):366.28[M-H]-;1H NMR(600 MHz,CDCl3)δ:8.84(s,1H,H-N),7.41(s,1H,H-2),7.30(s,1H,H-6),7.21(m,1H,H-5),6.93(d,1H,H-4),6.10(t,2H,H-17,H-18),6.08(s,1H,H-19),6.05(s,1H,H-16),5.68(m,2H,H-15,H-20),2.35(t,2H,H-8),2.27(s,3H,H-25),2.09(m,4H,H-14,H-21),1.73(d,2H,H-9),1.38(m,4H,H-12,H-23),1.31(s,2H,H-10),1.28(s,6H,H-11,H-13,H-22),0.90(s,3H,H-24);13C NMR(600 MHz,CDCl3)δ:171.33(C-7),138.90(C-1),137.90(C-3),134.53(C-20),134.43(C-15),134.27(C-17),130.85(C-18),130.61(C-19),130.43(C-4),128.79(C-5),124.97(C-16),120.46(C-2),116.84(C-6),37.84(C-8),34.90(C-21),32.78(C-22),32.48(C-13),31.94(C-11),31.52(C-12),29.71(C-14),29.32(C-23),25.64(C-9),22.53(C-10),21.48(C-25),14.13(C-24)。
3b:α-桐酸-4-甲氧基苯酰胺,浅黄色液体,熔点10~12℃。FT-IR(ν/cm-1):3320(N—H),2917(—CH2),1622(Ar,C==C),1029(C—O—C);LC-MS(m/z):384.29[M+H]+;1H NMR(600 MHz,DMSO)δ:9.68(s,1H,H-N),7.50(d,2H,H-2,H-6),6.85(d,4H,H-3,H-5),6.08(t,2H,H-17,H-18),6.04(s,1H,H-19),6.02(s,1H,H-16),5.64(m,2H,H-15,H-20),3.35(s,3H,H-25),2.25(t,2H,H-8),2.03(m,4H,H-14,H-21),1.57(d,2H,H-9),1.33(m,4H,H-12,H-23),1.28(s,2H,H-10),1.23(s,6H,H-11,H-13,H-22),0.86(s,3H,H-24);13C NMR(600 MHz,DMSO)δ:171.11(C-7),155.42(C-3),134.54(C-1),134.49(C-20),134.45(C-15),134.24(C-17),133.06(C-18),131.22(C-19),131.09(C-4),130.91(C-5),120.98(C-16),114.16(C-2),108.68(C-6),55.54(C-25),36.76(C-8),34.74(C-21),32.62(C-22),32.31(C-13),31.46(C-11),29.56(C-12),29.26(C-14),25.66(C-23),22.48(C-9),22.14(C-10),14.20(C-24)。
3c:α-桐酸-4-三氟甲氧基苯酰胺,浅黄色液体,熔点14~16℃。FT-IR(ν/cm-1):3319(N—H),2917(—CH2),1652(Ar,C==C),1029(C—F);LC-MS(m/z):439.25[M+H]+;1H NMR(600 MHz,CDCl3)δ:9.78(s,1H,H-N),7.42(d,2H,H-2,H-6),6.86(d,2H,H-3,H-5),6.10(t,2H,H-17,H-18),6.07(s,1H,H-19),6.04(s,1H,H-16),5.66(m,2H,H-15,H-20),2.33(t,2H,H-8),2.09(m,4H,H-14,H-21),1.72(d,2H,H-9),1.37(m,4H,H-12,H-23),1.32(s,2H,H-10),1.27(s,6H,H-11,H-13,H-22),0.91(s,3H,H-24);13C NMR(600 MHz,CDCl3)δ:171.38(C-7),156.34(C-3),134.53(C-1),134.43(C-20),134.31(C-15),131.09(C-17),130.90(C-18),130.84(C-19),130.76(C-4),130.60(C-5),130.52(C-16),130.41(C-25),121.79(C-2),114.11(C-6),37.61(C-8),34.89(C-21),32.77(C-22),32.48(C-13),31.51(C-11),29.32(C-12),29.27(C-14),25.68(C-23),22.53(C-9),22.22(C-10),13.93(C-24)。
3d:α-桐酸-4-氟苯酰胺,黄色液体,熔点13~14℃。FT-IR(ν/cm-1):3294(N—H),2920(—CH2),1654(Ar,C==C),1097(C—F);LC-MS(m/z):372.26[M+H]+;1H NMR(600 MHz,CDCl3)δ:8.96(s,1H,H-N),7.48(d,2H,H-2,H-6),7.00(d,2H,H-3,H-5),6.09(t,2H,H-17,H-18),6.07(s,1H,H-19),6.04(s,1H,H-16),5.66(m,2H,H-15,H-20),2.34(t,2H,H-8),2.08(m,4H,H-14,H-21),1.70(d,2H,H-9),1.37(m,4H,H-12,H-23),1.29(s,2H,H-10),1.27(s,6H,H-11,H-13,H-22),0.90(s,3H,H-24);13CNMR(600 MHz,CDCl3)δ:171.64(C-7),160.08(C-4),134.57(C-1),134.38(C-20),134.25(C-15),130.93(C-17),130.87(C-18),130.74(C-19),130.55(C-5),130.49(C-16),121.73(C-2),115.60(C-3),115.45(C-6),37.57(C-8),34.89(C-21),32.73(C-22),32.48(C-13),31.51(C-11),29.31(C-12),29.27(C-14),25.63(C-23),22.52(C-9),22.22(C-10),13.92(C-24)。
3e:α-桐酸-3-氯苯酰胺,浅黄色液体,熔点17~18℃。FT-IR(ν/cm-1):3301(N—H),2923(—CH2),1663(Ar,C==C),724(C—Cl);LC-MS(m/z):410.22[M+Na]+;1H NMR(600 MHz,CDCl3)δ:8.75(s,1H,H-N),7.68(s,1H,H-2),7.40(s,1H,H-6),7.16(m,1H,H-5),7.02(d,1H,H-4),6.08(t,2H,H-17,H-18),6.02(s,1H,H-19),5.99(m,1H,H-16),5.64(m,2H,H-15,H-20),2.34(t,2H,H-8),2.06(m,4H,H-14,H-21),1.67(d,2H,H-9),1.34(m,4H,H-12,H-23),1.27(s,2H,H-10),1.23(s,6H,H-11,H-13,H-22),0.89(s,3H,H-24);13C NMR(600 MHz,CDCl3)δ:172.78(C-7),139.54(C-1),134.35(C-3),130.92(C-20),130.85(C-15),130.64(C-17),130.55(C-18),130.50(C-19),130.45(C-5),129.78(C-16),123.99(C-4),120.18(C-2),118.11(C-6),37.45(C-8),34.89(C-21),32.78(C-22),32.48(C-13),31.52(C-11),29.34(C-12),29.26(C-14),25.69(C-23),22.52(C-9),22.23(C-10),13.93(C-24)。
3f:α-桐酸-2,3-二氯苯酰胺,浅黄色液体,熔点14~16℃。FT-IR(ν/cm-1):3280(N—H),2923(—CH2),1668(Ar,C==C),737(C—Cl);LC-MS(m/z):446.19[M+Na]+;1H NMR(600 MHz,CDCl3)δ:8.34(s,1H,H-N),7.72(s,1H,H-6),7.21(s,1H,H-4),7.00(m,1H,H-5),6.09(t,2H,H-17,H-18),6.06(s,1H,H-19),6.02(s,1H,H-16),5.66(m,2H,H-15,H-20),2.45(t,2H,H-8),2.07(m,4H,H-14,H-21),1.75(d,2H,H-9),1.39(m,4H,H-12,H-23),1.33(s,2H,H-10),1.27(s,6H,H-11,H-13,H-22),0.90(s,3H,H-24);13C NMR(600 MHz,CDCl3)δ:171.47(C-7),136.28(C-1),134.26(C-3),132.64(C-20),130.87(C-15),130.83(C-17),130.61(C-18),130.57(C-19),130.51(C-5),127.80(C-16),125.11(C-4),119.57(C-2),117.50(C-6),38.01(C-8),34.89(C-21),32.77(C-22),32.32(C-13),31.52(C-11),29.27(C-12),29.09(C-14),25.46(C-23),22.53(C-9),22.23(C-10),13.94(C-24)。
3g:α-桐酸-2-甲基环己酰胺,无色液体,熔点16~17℃。FT-IR(ν/cm-1):3291(N—H),2923(—CH2),987(C==C);LC-MS(m/z):372.33[M-H]-;1H NMR(600 MHz,CDCl3)δ:9.76(s,1H,H-N),6.08(t,2H,H-17,H-18),6.07(s,1H,H-19),6.04(s,1H,H-16),5.63(m,2H,H-15,H-20),3.65(s,1H,H-1),2.29(t,2H,H-8),2.15(s,1H,H-2),2.05(m,4H,H-14,H-21),1.71(d,4H,H-4,H-5),1.67(d,4H,H-3,H-6),1.61(d,2H,H-9),1.40(m,4H,H-12,H-23),1.28(s,2H,H-10),1.25(s,6H,H-11,H-13,H-22),0.90(s,6H,H-24,H-25);13C NMR(600 MHz,CDCl3)δ:172.60(C-7),134.38(C-20),134.19(C-15),130.81(C-17),130.59(C-18),130.45(C-19,C-16),53.82(C-1),38.47(C-8),37.11(C-2),34.86(C-21),34.31(C-3),33.81(C-6),32.75(C-22),31.90(C-11),29.67(C-13),29.30(C-5),29.25(C-12),29.07(C-14),25.96(C-4),25.77(C-23),25.44(C-9),22.50(C-10),19.06(C-25),13.66(C-24)。
2.2 化合物3a~3g的生物活性
2.2.1抗癌活性采用MTT法分别测定了α-桐酸酰胺衍生物在浓度为20和200μmol/L时对肝癌细胞(Hep G2)、直肠癌细胞(DLD-1)和乳腺癌细胞(MCF-7)的抑制活性,结果见表1。从表1可以看出,当α-桐酸酰胺衍生物的浓度为200μmol/L时,化合物3c对3种癌细胞均有较高的抑制率,对肝癌细胞、直肠癌细胞和乳腺癌细胞的抑制率分别为66.11%、70.46%和62.59%。当化合物浓度为20μmol/L时,7种α-桐酸酰胺衍生物对3种人体肿瘤细胞的抑制率均较低,抗肿瘤效果不明显,说明药物浓度对抗肿瘤活性具有较大的影响。

表1 不同浓度的化合物3a~3g对人体癌细胞的抑制率Table 1 Inhibition rates of different concentrations of compounds 3a-3g on human cancer cells
7种α-桐酸酰胺衍生物的抗癌活性实验结果表明:酰胺结构片段上取代基的类型对α-桐酸酰胺衍生物的体外抗癌活性具有重要影响。化合物3b与化合物3c的取代基在苯环上具有相同取代位置,但更多卤素原子的存在导致化合物3c的脂溶性更好,更加有利于透过细胞膜[17],从而影响化合物对癌细胞的抑制作用。此外,在苯环的间位引入氯原子和甲基后,衍生物的体外抗肿瘤活性也不同。从表1可知,化合物3a和3e在浓度为200μmol/L时,对3种人癌细胞的抑制率表现出显著差异,含有氯原子的化合物3e对3种人癌细胞的抑制效果优于甲基取代的化合物3a。由此表明,取代基的种类影响了α-桐酸酰胺衍生物体外抗癌活性。
根据表1中各化合物对3种人体肿瘤细胞的抑制活性的测定结果,选取具有抑制人癌细胞活性的化合物3c和5-氟尿嘧啶,采用1.4.1节中的MTT比色法测定其半数抑制浓度(IC50)值。经测定,化合物3c对人体肿瘤细胞HepG2、DLD-1和MCF-7的IC50值分别为55.58、59.09和94.28μmol/L;相应的,5-氟尿嘧啶对3种肿瘤细胞的IC50值分别为42.21、29.90和40.72μmol/L。其中,化合物3c对肝癌细胞HepG2的IC50(55.58μmol/L)和阳性对照药物5-氟尿嘧啶IC50(42.21μmol/L)相近,显示出良好的抗肿瘤活性,可作为抗肿瘤药物筛选参考。此外,化合物3c对3种人体肿瘤细胞的IC50均小于100μmol/L,优于文献[18]中α-桐酸对3种人体癌细胞的抑制效果(IC50值为100~200μmol/L)。
2.2.2抑菌活性7种α-桐酸酰胺衍生物对大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)的抑菌活性结果见表2。从表2可以看出,7种α-桐酸酰胺衍生物对2种细菌均有一定的抑制作用,而α-桐酸在500 mg/L的质量浓度下无抑菌活性,这意味着酰胺结构的引入有利于提高α-桐酸酰胺衍生物的抑菌活性。其中,化合物3f对金黄色葡萄球菌有良好的抑菌活性,IC50为0.022 mmol/L,与氨苄青霉素钠的抗菌效果(IC50值0.010 mmol/L)相近。结合α-桐酸在动物饲料中的应用[6],化合物3f具有作为替抗饲料添加剂的潜力。化合物3g和3d对大肠杆菌具有良好的抑菌活性,IC50分别为0.327和0.326 mmol/L。化合物3e对2种受试细菌均具有较好的抑菌活性,其IC50均为0.651 mmol/L。此外,取代基对α-桐酸酰胺衍生物的生物活性产生了重要的影响。化合物3e和3f均为苯环上的氯取代,其对革兰氏阳性菌的抑菌活性有一定的差异,而抑菌活性差异可能是苯基上的氯原子的数量不同造成的[12]。这些结果表明:取代基上的氯原子对α-桐酸酰胺衍生物的生物活性产生了积极的影响。

表2 化合物3a~3g的对细菌的半数抑制浓度(24 h)Table 2 The median inhibition concentration of compounds 3a-3g
3 结 论
3.1以α-桐酸为原料,经过酰氯化得到中间产物α-桐酸酰氯,再与不同取代基的六元环胺类化合物反应,制备得到7种α-桐酸酰胺类化合物:α-桐酸-3-甲基苯酰胺(3a)、α-桐酸-4-甲氧基苯酰胺(3b)、α-桐酸-4-三氟甲氧基苯酰胺(3c)、α-桐酸-4-氟苯酰胺(3d)、α-桐酸-3-氯苯酰胺(3e)、α-桐酸-2,3-二氯苯酰胺(3f)、α-桐酸-2-甲基环己酰胺(3g)。采用FT-IR、1H NMR、13C NMR和HPLC-MS对化合物结构进行了表征验证,确证了这些化合物的合成。
3.2探讨了7种α-桐酸酰胺类化合物的抑菌及抗肿瘤活性,结果表明:化合物3c对肝癌细胞的抑制效果和阳性对照药物5-氟尿嘧啶的效果相近,有望作为前体化合物用于进一步的结构衍生化。化合物3f对金黄色葡萄球菌具有很好的抑菌活性,接近氨苄青霉素钠的抗菌活性。构效关系分析表明,酰胺的引入有助于提高抑菌活性。取代基种类对α-桐酸酰胺衍生物的生物活性影响显著,卤素有利于提高衍生物的抑菌抗癌活性。

