生物预处理对油樟精油组成、油细胞和内生菌群的影响
程 贤,毕良武*,李胜男,陈玉湘,赵振东,莫开林
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室;江苏省林业资源高效加工利用协同创新中心,江苏 南京210042;2.四川省林业科学研究院,四川 成都610081)
油樟(Cinnamomumlongepaniculatum)是中国特有的樟科樟属树种,主要分布在我国的四川省,此外,湖南、广东、重庆等省市也有种植[1]。油樟精油的主要成分包括醇类、烃类、酯类、醛类等[2],醇类成分以1,8-桉叶素和α-松油醇为主,烃类以萜类为主,包括γ-松油烯、α-蒎烯和石竹烯等[3]。研究表明油樟精油的主要成分具有抗菌、抗氧化、抗肿瘤等作用,应用前景广阔[4-6]。目前油樟精油的生产还是沿袭传统的蒸馏工艺,导致粗油提取效率普遍偏低,因此,如何提高油樟精油提取得率,保障油樟资源高效利用值得深入思考和研究[7]。随着多学科的相互渗透和交叉,生物技术与天然产物研究的结合日益密切,微生物辅助技术已经开始作为生物预处理手段,应用于天然产物的提取分离[8-10]。李军集等[11]以桂叶渣为原料进行生物发酵,结果发现:发酵后桂叶渣的化学成分发生明显变化,产生了其他具有挥发性芳香气味的化学成分,该研究表明生物预处理使桂叶渣生成了酯、烯、醛等具有芳香气味的有机化合物,使无味的桂叶渣具有了芳香气味。梁开朝等[12]利用微生物菌株M-5对K326烟叶进行预处理后,烟叶提取物中苯乙醇、丁酸乙酯等天然香精、精油成分显著提高,该研究说明M-5菌株不仅可以进一步用于烟叶纯化还具有生产香精香料的能力。因此,本研究以新鲜采集的油樟叶为研究对象,分别进行水预处理、酵母菌预处理和复合菌预处理,并从精油提取得率、精油成分组成、油细胞形态和内生菌群落结构等多方面探索预处理对油樟叶的影响,揭示生物预处理促进油樟精油提取的潜在作用机制,以期为油樟叶生物预处理技术的开发提供理论参考。
1 实 验
1.1 原料、试剂与仪器
新鲜油樟叶,春季采集于四川省宜宾市翠屏区思坡镇会诗村。油樟(Cinnamomumlongepaniculatum(Gamble)N.Chao ex H.W.Li.),树龄10年。
无水乙醇、甲醇均为市售分析纯;无菌水,上海麦克林生化科技有限公司;高活性干酵母,安琪酵母股份有限公司;腐熟剂,河南沃宝生物科技有限公司;PCR扩增引物,美国Omega生物科技公司;AxyPrep DAN Gel提取试剂盒,美国Axygen生物科技公司。
岛津GC-2014AF气相色谱仪,配有Rtx-5型石英毛细管色谱柱(30 mm×0.25 mm×0.25 mm),FID检测器,日本岛津仪器有限公司;QuantiFluorTM-ST微型荧光计,美国TurnerBio Systems公司;7890A-5975C型气相色谱-质谱联用(GC-MS)仪,美国安捷伦公司;LD-UPW-V超纯水制备仪;FZ102型植物粉碎机;TGL-16B高速离心机。
1.2 油樟叶的生物预处理
1.2.1水预处理首先准确称取40 g新鲜的油樟叶置于烧杯中备用,然后准确量取8 mL蒸馏水并均匀喷洒在油樟叶表面,平行制备4份;置于烧杯中,并用封口膜密封,阴凉的环境中静置一周,预处理结束。
1.2.2酵母菌预处理首先准确称取40 g新鲜的油樟叶置于烧杯中备用,然后准确称量40 mg高活性干酵母菌溶解于8 mL蒸馏水中,迅速搅拌使其充分溶解,将酵母溶液均匀喷洒在油樟叶表面,平行制备4份;置于烧杯中,并用封口膜密封,阴凉的环境中静置一周,预处理结束。
1.2.3复合菌预处理以腐熟剂作为复合菌种,参照1.2.2节的方式进行预处理。同时准确称取40 g新鲜的油樟叶4份,不做任何处理,作为空白对照。
1.3 油樟精油的提取及成分研究
1.3.1精油的提取将油樟叶片适度粉碎,碎片约5 mm×5 mm,准确称量40 g粉碎后的叶片放入蒸馏器中,连接好挥发油提取器,开始加热蒸馏,待挥发油提取器中有冷凝水流出开始计时,5 h后停止加热,收集上层精油,并精确称质量,在2~8℃冰箱内保存备用。针对3种预处理后的油樟叶和新鲜的油樟叶分别进行3次平行实验,以油樟叶片的湿质量计算精油的提取得率。
1.3.2GC-MS分析 将提取所得油樟精油样品用乙醇稀释5倍,使用0.45μm滤头过滤,采用7890A-5975C型GC-MS分析其化学成分和相对峰面积。GC-MS分析所采用的气相色谱条件:色谱柱为石英毛细管柱(30 m×0.25 mm×0.25μm);载气为He,1.6 mL/min;进样口温度为280℃;进样量为0.2μL;分流比为100∶1;色谱柱升温程序为50℃保持2 min,以5℃/min的速率升至280℃保持20 min。质谱条件:EI电离源,电离源温度为230℃,电子轰击能量为70 eV,扫描质核比范围为50~500。
1.4 油樟油细胞形态研究
分别将油樟鲜叶和3种不同预处理后的油樟叶表面清洗干净,在油樟叶片中下部且无叶脉处,剪取5 mm×5 mm的样本,浸泡在5%的氢氧化钠水溶液中,在65℃恒温箱内放置48 h。取出后先用水冲洗2次,然后于双氧水中浸泡15 min,最后取出样本置于载玻片上,小心盖上盖玻片,避免产生气泡,尽快使用生物显微镜对处理好的样本进行观察和拍摄。在10倍视野下拍摄样本,并记录油细胞数目作为该样本中油细胞的密度[13]。
1.5 油樟叶内生菌群结构研究
1.5.1DNA提取 先用无菌水洗净油樟叶表面的预处理溶液和灰尘,以75%的乙醇进一步除去油樟叶表面的细菌,然后用无菌棉球吸干残留在油樟叶表面的乙醇溶液,将油樟叶片适度粉碎,碎片约1 cm×1 cm。参照该方法将3种预处理后的油樟叶和新鲜的油樟叶完成灭菌,并将每组油樟叶均分成6份(每份6 g,总共24份)。最后使用MP-soil试剂盒,按照说明书流程提取24份油樟叶样本的内生菌的DNA[14]。
1.5.2PCR扩增和Miseq测序 使用引物799F(5’-AACMGGATTAGATACCCKG-3’)和1193R(5’-ACGTCATCCCCACCTTCC-3’)对植物内生细菌16SrRNA的V3~V4可变区进行聚合酶链式反应(PCR)扩增[15-17],利用AxyPrep DNA凝胶提取试剂盒对回收的PCR产物进行纯化;然后利用QuantiFluorTM-ST进行检测定量,根据Illumina Miseq平台标准操作规程将纯化后的扩增片段构建PE文库(2×300 bp);最后利用Illumina公司的MiseqPE300平台进行测序。
1.5.3生物信息学分析原始测序序列借助美吉生物交互式微生物群落多样性云分析平台进行生物信息学分析。利用RDPclassifier(版本号:2.11)贝叶斯算法对97%相似水平的OTU代表序列进行物种分类注释,通过比对16s细菌数据库(Silva和RDP),统计油樟叶样本经过不同生物预处理后在纲水平含有何种微生物以及各种微生物的相对丰度。利用R语言(版本号:3.3.1)vegan包对油樟叶样本内生菌群与生物预处理影响因子进行距离冗余分析(dbRDA)和相关性热图分析(heatmap)分析,获取菌群与生物预处理方式之间的关系,生物预处理影响因子见表1。
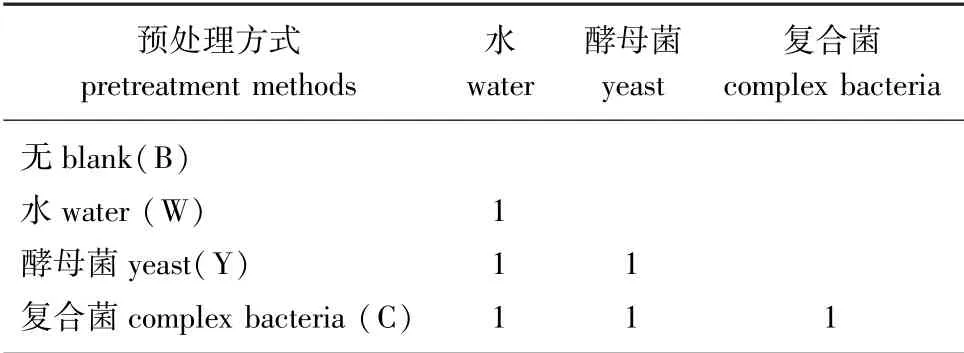
表1 生物预处理影响因子Table 1 Impact factor of biological pretreatment
2 结果与讨论
2.1 油樟精油提取得率及成分分析
2.1.1油樟精油提取得率通过计算可知,新鲜油樟叶、水预处理油樟叶、酵母菌预处理油樟叶和复合菌预处理油樟叶的油樟精油提取得率(以湿质量计)分别为2.71%、2.97%、3.62%和4.06%。酵母菌预处理和复合菌预处理使得油樟精油提取得率提高分别提高了33.6%和49.8%,水预处理的作用效果不明显。
2.1.2油樟精油化学成分将新鲜油樟叶、水预处理油樟叶、酵母菌预处理油樟叶和复合菌预处理油樟叶提取所得精油进行GC-MS分析,通过NIST标准质谱库及Pub Med数据库,共鉴定出16个化合物,利用峰面积归一化法计算各化合物的相对峰面积,结果见表2。

表2 不同生物预处理后樟叶精油的成分分析Table 2 Volatile compounds identified in C.longepaniculatum leaves after different pretreatment
由表2可知,不同预处理油樟叶及新鲜油樟叶精油的主要化学成分相同,1,8-桉叶素为质量分数最高的成分,超过50%,其次为α-松油醇(>20%),β-水芹烯5%左右,其他质量分数超过1%的化合物分别为β-蒎烯、4-松油醇和γ-松油烯。生物预处理会导致主成分1,8-桉叶素的相对峰面积略有降低,β-蒎烯、α-松油醇和γ-松油烯成分略有提高。
2.2 油细胞形态分析
不同预处理油樟叶油细胞在普通光学显微镜10倍视野下呈现的形态见图1。

图1 不同预处理后油樟叶片中油细胞形态(×10)Fig.1 Oil cell morphology in leaves of C.longepaniculatum under different pretreatment(×10)
由图可知,油细胞以单个的形式分散于薄壁组织中,与其他组织细胞分布有明显的区别。统计10倍视野下轮廓清晰的油细胞的数量作为细胞密度,结果表明:新鲜油樟叶(空白)、水预处理油樟叶、酵母菌预处理油樟叶和复合菌预处理油樟叶油细胞密度分别为(37±3)、(37±2)、(27±2)和(25±5)个/mm2。由图1(c)可以看出,酵母菌预处理油樟叶的少部分油细胞在10倍视野下的细胞边缘不明确,数量不便于统计,因此导致油细胞密度降低。图1(d)中大部分油细胞轮廓不清晰,导致复合菌预处理油樟叶的油细胞密度相对于新鲜油樟叶显著降低。由此推测:酵母菌和复合菌的预处理可能对油细胞的细胞壁造成一定程度的破坏,甚至导致油细胞的破裂,最终促进了油樟精油提取得率的提高,并且复合菌的作用更明显。
2.3 内生菌群结构分析
2.3.1内生菌的群落结构在纲的水平上统计了不同预处理后油樟叶的内生菌相对丰度,并与新鲜油樟叶进行对比,结果见表3。
由表3可见,新鲜油樟叶(空白)、水预处理和酵母菌预处理油樟叶内生菌以γ-变形菌为主,相对丰度均超过40%,其次为放线菌,相对丰度分别为15.22%、26.74%和22.94%。与新鲜油樟叶相比,水预处理油樟叶类杆菌相对丰度显著提高,由2.64%提高到22.74%。与新鲜油樟叶相比,酵母菌预处理油樟叶α-变形菌相对丰度发生显著性变化,由1.32%提高到6.04%。复合菌预处理对油樟叶内生菌的群落结构影响最明显:1)α-变形菌的相对丰度接近50%,成为最主要的菌群;2)γ-变形菌的相对丰度下降至16%,导致其他菌群相对丰度均有所提高;3)蓝细菌(17.88%)和酸杆菌(9.99%)的相对丰度相对于其他3组有显著提高。由此表明:3种预处理方式对油樟叶的内生菌群落结构影响较大,其中γ-变形菌、α-变形菌、蓝细菌和酸杆菌为受影响最大的菌群。

表3 不同预处理方式油樟叶片中内生菌群落结构Table.3 Endophyte community structure in C.longepaniculatum under different pretreatment
2.3.2内生菌群落与生物预处理的相关性为了进一步研究内生菌群落结构变化与生物预处理的相关性,在对不同预处理后油樟叶内生菌群落结构进行距离冗余分析(dbRDA)时,加入生物预处理影响因子(表1)进行约束,分析结果见图2。
通过样本点的空间距离可以判断样本间的聚类情况,由图2可知,4组样本都有较好的聚类,表明同一组样本中样品间的差异较小。3个生物预处理组与空白组(B)都有分离,表明生物预处理对油樟内生菌群落结构产生了影响。复合菌预处理组(C)和其他3组分离最明显,说明复合菌预处理对油樟内生菌群落结构的影响最显著。上述结果与油樟叶内生菌群落结构的分析结果一致。通过箭头的长短可以判断影响因子对菌群落结构影响的程度,3种预处理方式影响程度的大小顺序为复合菌预处理>酵母菌预处理(Y)=水预处理(W)。样本点向生物预处理影响因子做垂线,投影点在箭头方向上,表示为影响因子与样本之间呈正相关,反之呈负相关,由图2可知,复合菌预处理组的油樟叶内生菌群落结构到影响因子向量的投影点在箭头方向上,而大部分水预处理组和酵母菌预处理组的投影点不在影响因子向量箭头方向上,表明只有复合菌预处理组的油樟叶内生菌群落结构与影响因子呈正相关。
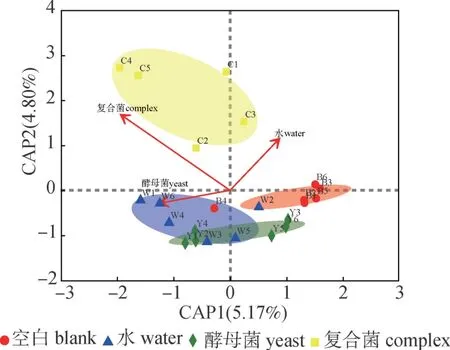
图2 油樟叶内生菌群落的距离冗余分析Fig.2 Distance-based redundancy analysis of bacterial community in C.longepaniculatum
在种水平上相对丰度前20的细菌是内生菌群落的核心物种,本研究对核心物种进行相关性热图分析,获得相关性P值,并用相关性热图直观展现计算结果,如图3,红色部分表示正相关,蓝色部分表示负相关。图3表明复合菌种的加入与多种核心内生菌种显著相关,尤其是对浮霉菌、酸杆菌和梭状芽孢杆菌丰度的影响最为显著,并且呈现正相关。相关研究表明,酸杆菌和浮霉菌容易产生纤维素酶[18],因此可以推断油樟叶内生菌群中酸杆菌和浮霉菌相对丰度的提高促进了油细胞的裂解,从而有助于油樟精油提取得率的提高。
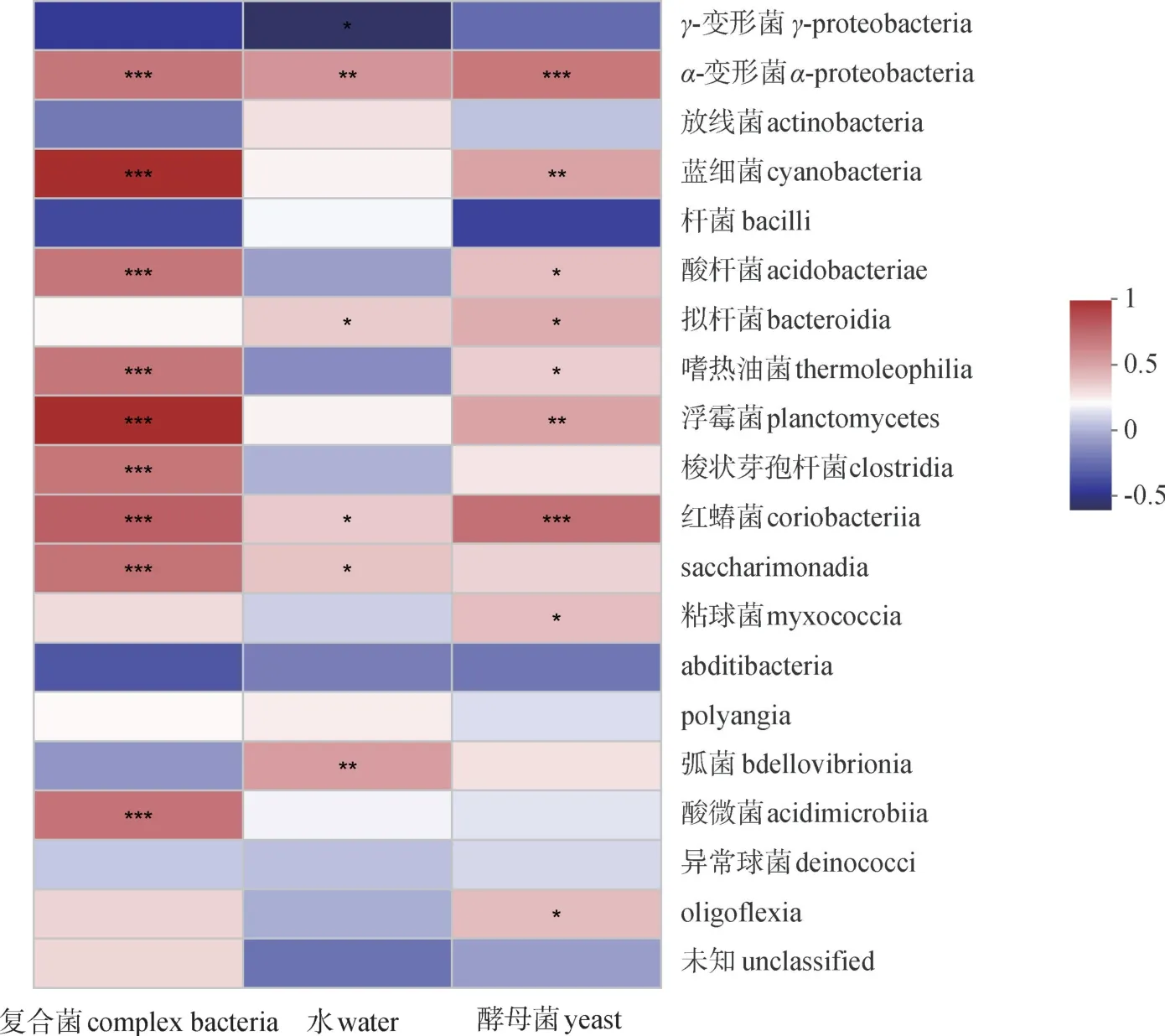
图3 内生菌分类与预处理相关性热图Fig.3 Spearman correlation heatmap between pretreatment and bacterial community
3 结 论
3.1对新鲜油樟叶进行生物预处理,然后提取油樟精油,并鉴定其化学成分。结果表明:酵母菌和复合菌预处理使油樟精油提取得率分别提高了33.6%和49.8%,水预处理的作用效果不明显;生物预处理使主成分1,8-桉叶素的含量略有降低,β-蒎烯、α-松油醇和γ-松油烯含量略有提高。
3.2新鲜油樟叶,以及水、酵母菌和复合菌预处理油樟叶油细胞密度分别为(37±3)、(37±2)、(27±2)和(25±5)个/mm2。由于酵母菌和复合菌预处理导致细胞边缘不明确、细胞轮廓不清晰,因此统计所得油细胞密度偏低。
3.33种预处理方式对油樟叶的内生菌群落结构影响较大,其中γ-变形菌、α-变形菌、蓝细菌和酸杆菌为受影响最大的菌群,3种预处理方式对内生菌群落结构影响的程度从大到小顺序为复合菌预处理>酵母菌预处理=水预处理,复合菌种的加入与多种核心内生菌种显著相关,尤其是对浮霉菌、酸杆菌和梭状芽孢杆菌丰度的影响最为显著。

