派特灵治疗高危型人乳头瘤病毒(HR-HPV)感染疗效的Meta分析
刘莲慧,秦文敏,张莹雪,刘 洁
·循证医学与临床用药·
派特灵治疗高危型人乳头瘤病毒(HR-HPV)感染疗效的Meta分析
刘莲慧1, 2,秦文敏2*,张莹雪2,刘 洁2
1.南京中医药大学,江苏 南京 210023 2.南京中医药大学徐州附属医院,江苏 徐州 221000
系统评价派特灵治疗高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)感染的疗效和安全性。计算机检索中国知网(CNKI)、万方(Wangfang)、维普网(VIP)、中国生物医学文献数据库(CBM)、PubMed、EMbase、Cochrane Library数据库建库至2021年3月的随机对照试验(randomized controlled trial,RCT),由2名研究评价员根据纳入和排除标准独立对文献进行筛选、数据提取和质量评价后,采用RevMan 5.3软件进行Meta分析。共纳入22篇文献,总样本量为2248例。用药结束3、6、9、12个月后派特灵组的HR-HPV转阴率分别是随访对照组的2.54、2.61、2.02、1.47倍。用药结束3个月后派特灵组HPV病毒载量明显低于随访对照组,2组临床疗效对比具有统计学意义[MD=−486.72,95% CI(−505.90,−467.54),<0.000 01];用药结束6个月后派特灵组HPV病毒载量明显低于随访对照组,2组临床疗效对比具有统计学意义 [MD=−617.34,95% CI(−855.12,−39.55),<0.000 01]。用药结束6、9、12个月后非手术派特灵组HPVmRNA拷贝水平下降幅度高于随访对照组,差异具有统计学意义(值分别为−4.216、−4.151、−4.359,均<0.001)。用药结束6、9、12个月后术后派特灵组HPVmRNA拷贝水平下降幅度高于随访对照组,差异具有统计学意义(值分别为−2.880、−3.226、−2.914,值均<0.05)。用药结束3、6、9个月派特灵组病灶消退率明显高于随访对照组,差异均具有统计学意义(值分别为0.017、0.009、0.023)。派特灵与保妇康栓相比,2组临床疗效不具有统计学意义 [RR=1.24,95% CI(0.75,2.03),=0.40];派特灵与干扰素相比,2组临床疗效对比具有统计学意义 [RR=1.95,95% CI(1.57,2.41),<0.000 01],表明派特灵对HR-HPV的疗效优于干扰素。派特灵治疗HR-HPV疗效显著,安全性较高值得临床进一步推广。相较于干扰素,派特灵疗效更为显著。但由于受纳入研究样本量所限,研究结果有可能存在偏倚,尚需更多高质量大样本的临床研究予以验证。
人乳头瘤病毒;HPV感染;派特灵;Meta分析;随机对照试验
宫颈癌的发生被证实与HR-HPV的持续性感染相关,通常在病毒持续感染10~20年转变为宫颈癌[3],宫颈高级别病变或宫颈癌行宫颈或子宫切除术的患者术后仍有可能再次因HPV的持续感染导致外阴及阴道壁的癌变,病毒感染严重威胁着女性的生命健康。在漫长的疾病自然演变过程中,实施有效的药物来清除病毒是预防疾病进展的首要措施。目前世界范围内尚无公认有效的HPV清除治疗方法,从宫颈癌预防到治疗主要包括疫苗接种、口服及外用抗病毒及免疫增强药物、物理治疗和手术治疗,带来一定治疗作用的同时不可避免地产生宫颈狭窄、宫颈机能不全致使早产及低体质量儿发生率增加等远期并发症。
近年来中药制剂广泛用于HPV的清除治疗。中医学中,根据病毒感染后出现的临床症状将其归属于“带下病”范畴,认为HPV感染病机不离“湿邪为患”又有”脾肾亏虚”“湿热湿毒”从而导致“任脉损伤,带脉失约”[4]。中药制剂派特灵中含金银花、大青叶、鸦胆子、苦参等清热解毒燥湿及黄芪等扶正驱邪药物,其优点在于能提高细胞免疫,发挥免疫清除作用,有效清除HPV病毒[5]。运用派特灵治疗HPV感染的文献报道证实其具有一定的疗效,但尚缺乏对大样本数据统计研究进行高质量的系统评价,本研究对派特灵治疗HR-HPV感染的RCT进行Meta分析,以期为HR-HPV感染的临床治疗提供循证医学证据。
1 资料与方法
1.1 文献检索
计算机检索中国知网(CNKI)、万方(Wangfang)、维普网(VIP)、中国生物医学文献数据库(CBM)、PubMed、EMbase、Cochrane Library数据库中公开发表的派特灵治疗HR-HPV感染的RCT,检索时间为建库至2021年3月1日,最后检索日期为2021年3月25日。中文检索词为人乳头瘤病毒、派特灵、随机;英文检索词为human papillomavirus、papillomavirus infection、gamma papillomavirus、HPV、paiteling等,连接词“OR”和“AND”连接。
1.2 纳入标准
(1)研究语言为中、英文;(2)研究类型为随机对照试验(randomized controlled trial,RCT);(3)研究对象为①正常非手术或因宫颈CIN II-III、宫颈癌行宫颈锥切术或子宫切除术后使用HR-HPV分型检测为阳性或HC2检测RLU/CO>1.0 pg/mL确诊为一型或多型宫颈或阴道残端HR-HPV感染;②细胞学检测或阴道镜病理检查诊断排除宫颈癌或阴道残端见恶性细胞者;(4)干预措施:试验组单用派特灵药物治疗,对照组观察随访或单用保妇康栓或单用干扰素药物治疗。具体分组如下:①派特灵组与随访对照组;②派特灵组与保妇康栓组;③派特灵组与干扰素组。(5)结局指标:①HPV转阴率,结局评价标准区分转阴、治愈和有效,结局数据包括完全转阴人数(原亚型完全清除视为转阴,其他情况不视为转阴);②HPV-DNA负荷量;③HPVmRNA拷贝水平;④病灶消退率;⑤不良反应。
1.3 排除标准
(1)文献综述、系统评价、个案病例报道、细胞实验及动物实验;(2)资料不全、无法获得完整数据的科技成果及会议论文、单组例数<10例;(3)数据重复发表的相同文献;(4)合并低危型HPV感染伴发或不伴发尖锐湿疣;(5)孕期及哺乳期妇女;(6)结局数据中未包含原亚型感染治愈或转阴的模糊数据。
1.4 文献筛选与资料提取
由2位研究人员独立进行文献筛选,通过阅读文献标题及摘要剔除重复文献,再对剩下的文献全文阅读,保留符合纳入与排除标准的文献。对纳入文献进行资料提取,填写资料提取表后进行交叉核对,如双方出现意见分歧通过协商、咨询相关专家或联系原作者解决,无法解决者由公认的第3方仲裁决定。提取的资料包括:(1)文献的第一作者、标题、发表年限、是否为基金科研项目;(2)研究对象:样本量、纳入和排除标准、平均年龄及病程等基线资料、药物治疗方案;(3)结局指标:HPV转阴率、HPV-DNA负荷量、HPVmRNA拷贝水平、病灶消退率、不良反应。
1.5 质量评价
由2位研究员单独参照Cochrane偏倚风险工具从以下方面对纳入文献进行质量评价,如遇分歧通过协商或公认的第3方仲裁决定:(1)是否随机分配及随机分配序列是否详细描述以评估组间的可比性;(2)分配方案是否隐蔽;(3)是否采用盲法(研究者、受试者、评估者);(4)结果数据的完整性,有无较多脱落案例;(5)是否选择性报告研究结果,隐瞒研究方向不利结果;(6)基线非均衡、样本量小、利益冲突等其他偏倚来源评估。根据上述标准对纳入文献采用“高风险”“低风险”“未知风险”3项偏倚选择进行评估。
乔-彼得·威特金并没有使用电脑处理图像,而是采用传统的摄影方法,以使事物更接近其本来面目。他使用一台1960年代的老式双镜头禄莱福莱相机与传统胶卷,从不使用蒙太奇之类的手法制作拼贴画。他将自己与那些普通摄影手段区别开来的唯一方法,正是对负片的使用。
1.6 统计方法
用RevMan 5.3软件对纳入文献进行Meta分析。二分类变量及连续性变量分别选用相对危险度(relative risk,RR)、均数差(mean difference,MD)为效应指标。²判断异质性大小,2≤50%表示存在同质性,采用固定效应模型;²>50%表示存在异质性,采用随机效应模型。制作漏斗图,若漏斗图呈明显不对称分布提示研究存在较大发表偏倚可能;同时对纳入研究进行逐一剔除,观察剔除后合并效应量与异质性的变化,评估研究结果的稳定性和可靠性。
2 结果
2.1 文献检索结果
初检共获得309篇文献,其中中文文献303篇,英文文献6篇;删除重复文献163篇,其中中文文献162篇,英文文献1篇;阅读标题及摘要获得86篇,进一步阅读全文复筛,最终纳入22项RCT[6-27]。文献筛选流程见图1。
2.2 纳入研究基本特征
共纳入22个RCT,均为中文文献,发表时间为2011—2020年,总样本量为2248例。派特灵组与随访对照组(无任何干预)共13项RCT纳入1379例,派特灵组与保妇康栓组共2项RCT纳入100例,派特灵组与干扰素组共7项RCT纳入769例。所有RCT派特灵均由专门培训过的医生专人负责上药,19项RCT[6-12,14-16,19-27]均完整描述派特灵的具体使用剂量及操作方法,有3项RCT[13,17-18](均为无任何干预组)未完整描述派特灵具体使用方法。所纳入的22项RCT派特灵用法均为经净第3、4天取药液1~5 mL宫颈湿敷,时间为3~6 h,每1~2天用药1次,用药3~4 d停药3~4 d,共治疗12~24次。其中7项RCT[9-11,16,22-24]外加阴道涂擦或灌洗1~3个月。保妇康栓及干扰素组均为每晚睡前1粒塞阴,保妇康栓总用量为14、24粒,干扰素总用量为14、30粒。具体基本特征见表1。
2.3 纳入研究偏倚风险评估
所有研究均为随机对照研究,其中2项研究[8,13]虽描述为病例对照研究但其研究方法为随机分配,故将其归属于RCT。有2项研究[7,22]采用随机数字表法,判定为低风险,20项研究[6,8-21,23-27]均未描述随机序列产生方法,无充足信息判定等级风险,均为未知风险;22项研究均未描述分配过程,无充足信息判定等级风险,均为未知风险。1项研究[6]提及实施双盲,21项研究[7-27]未提及盲法,但因本研究的试验组和对照组干预措施不同且缺乏使用安慰剂对照,不太可能都设盲,即使设盲也有可能破盲,且结局结果可能会受盲法缺失的影响,故干预过程中的盲法均判定为高风险。因HPV检测结果为客观实验检测数据,结局不受结果评价者主观影响,故评价结果测量过程中的盲法均判定为低风险。所有文献均无脱落缺失数据及非选择性报告研究结果,故该2项判定为低风险。因纳入的22项研究均无足够信息明确是否存在高低偏倚,故均判定为未知风险。具体偏倚风险评估见图2。

图1 文献筛选流程

表1 纳入文献的基本特征

续表1
T-试验组 C-对照组 P-派特灵 A-保妇康栓 B-干扰素 ①HPV转阴率 ②HPV-DNA负荷量 ③HPVmRNA拷贝水平 ④病灶消退率 ⑤不良反应
T-test group C-control group P-Paiteling A-Baofukang Suppository B-interferon ①HPV negative rate ②HPV-DNA load ③HPVmRNA copy level ④regression rate of lesions ⑤adverse reactions

图2 偏倚风险评估
2.4 Meta分析结果
2.4.1 HPV转阴率
(1)派特灵组与随访对照组:11项研究[6-14,17-18]报道了用药结束3个月后的HPV转阴率,采用随机效应模型(2=56%,=0.01),结果显示派特灵组HPV转阴率为64.31%(346/538),随访对照组HPV转阴率为24.15%(121/501);2组HPV转阴率对比具有统计学意义 [RR=2.54,95% CI(1.93,3.34),<0.000 01]。见图3。
11项研究[6-11,14-18]报道了用药结束6个月后的HPV转阴率,采用随机效应模型(2=74%,<0.000 1),结果显示派特灵组HPV转阴率为71.19%(471/662),随访对照组转阴率为29.00%(194/669);2组HPV转阴率对比具有统计学意义[RR=2.61,95% CI(1.96,3.46),<0.000 01]。见图4。

图3 用药结束3个月后的HPV转阴率Meta分析

图4 用药结束6个月后的HPV转阴率Meta分析
7项研究[6-8,10-11,14-15]报道了用药结束9个月后的HPV转阴率,采用随机效应模型(2=79%,<0.000 1),结果显示派特灵组HPV转阴率为77.77%(336/432),随访对照组转阴率为40.32%(177/439);2组HPV转阴率对比具有统计学意义 [RR=2.02,95% CI(1.52,2.69),<0.000 01]。见图5。
6项研究[6,8,10-11,15-16]报道了用药结束后12个月的HPV转阴率,采用随机效应模型(2=75%,=0.001),结果显示派特灵组HPV转阴率为87.01%(402/462),随访对照组HPV转阴率为61.41%(288/469);2组HPV转阴率对比具有统计学意义[RR=1.47,95% CI(1.25,1.74),<0.000 01]。见图6。
(2)派特灵组与保妇康栓组:2项研究[19-20]报道了派特灵与保妇康栓的疗效对比,采用固定效应模型(2=0,=0.96),结果显示派特灵组HPV转阴率为42%(21/50),保妇康栓组HPV转阴率为34%(17/50);2组HPV转阴率对比不具有统计学意义 [RR=1.24,95% CI(0.75,2.03),=0.40]。见图7。
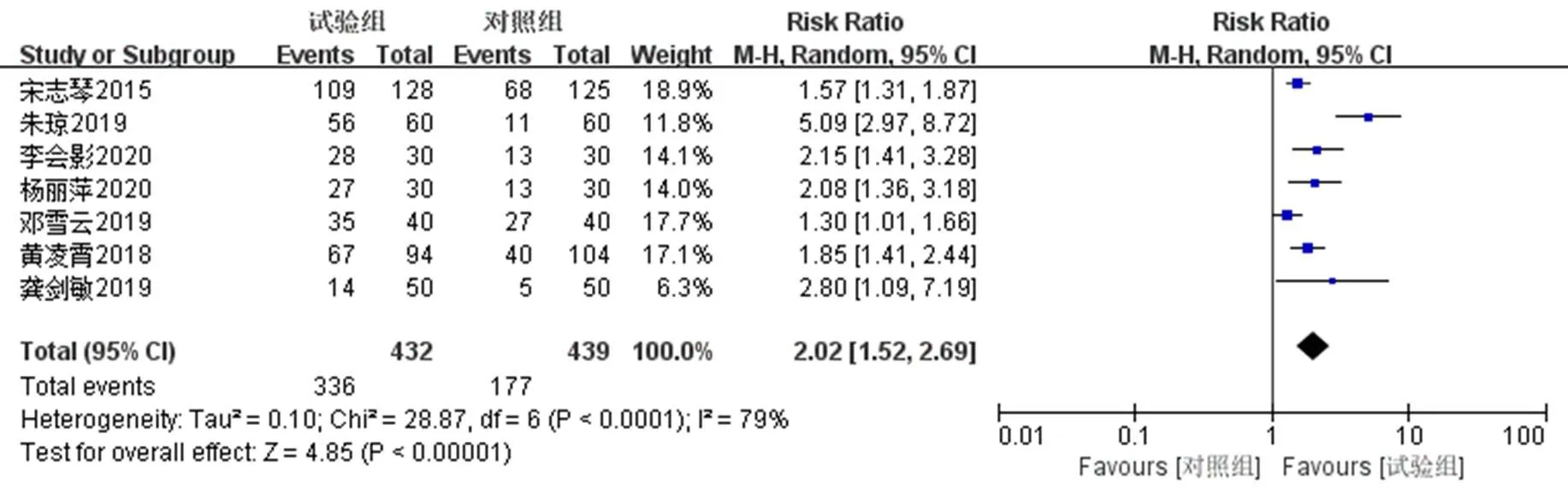
图5 用药结束9个月后的HPV转阴率Meta分析

图6 用药结束12个月后的HPV转阴率Meta分析
(3)派特灵组与干扰素组:7项研究[21-27]报道了派特灵与干扰素的HPV转阴率对比,采用随机效应模型(2=53%,=0.05),结果显示派特灵组HPV转阴率为75.0%(318/424),干扰素组HPV转阴率为37.97%(131/345);2组HPV转阴率对比具有统计学意义[RR=1.95,95% CI(1.57,2.41),<0.000 01]。见图8。
2.4.2 HPV-DNA负荷量 2项研究[17-18]报道了治疗结束3个月及6个月后派特灵组与随访对照组的HPV-DNA负荷量变化,分别采用固定效应模型(2=0,=0.51)及随机效应模型(2=56%,=0.13)进行Meta分析。Meta结果显示,派特灵组用药结束后3个月及6个月HPV-DNA负荷量明显低于随访对照组,2组在2个时间段HPV-DNA负荷量对比均具有统计学意义[用药结束后3个月:MD=−486.72,95% CI(−505.90,−467.54),<0.000 01;用药结束后3个月:MD=−617.34,95% CI(−855.12,−39.55),<0.000 01]。用药结束后6个月HPV-DNA负荷量较3个月下降明显。见图9、10。
2.4.3 HPVmRNA拷贝水平 1项研究[16]报道了派特灵组与随访对照组用药结束后6、9、12个月HPVmRNA拷贝水平下降值。派特灵组用药后6、9、12个月HPVmRNA拷贝水平分别下降56.8%、72.5%、71.5%,随访对照组HPVmRNA拷贝水平分别下降13.6%、20.4%、15.7%,派特灵组下降幅度高于随访对照组,差异有显著性(分别为−4.216、−4.151、−4.359,均<0.001)。用药后6、9、12个月术后派特灵组HPVmRNA拷贝水平分别下降74.2%、82.8%、83.9%,随访对照组分别下降45.9%、53.0%、56.4%,派特灵组下降幅度高于随访对照组,差异有显著性(分别为−2.880、−3.226、−2.914,均<0.05)。

图7 派特灵vs保妇康栓HPV转阴率的Meta分析

图8 派特灵vs干扰素HPV转阴率的Meta分析
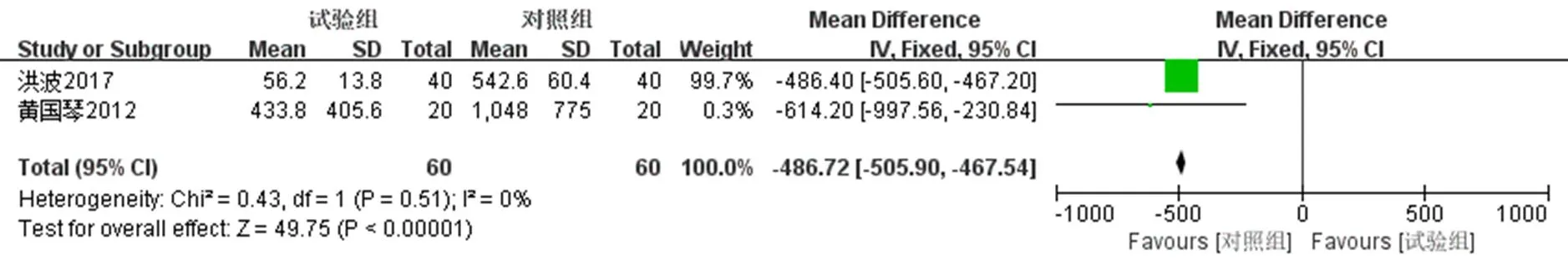
图9 用药结束3个月后HPV-DNA负荷量的Meta分析
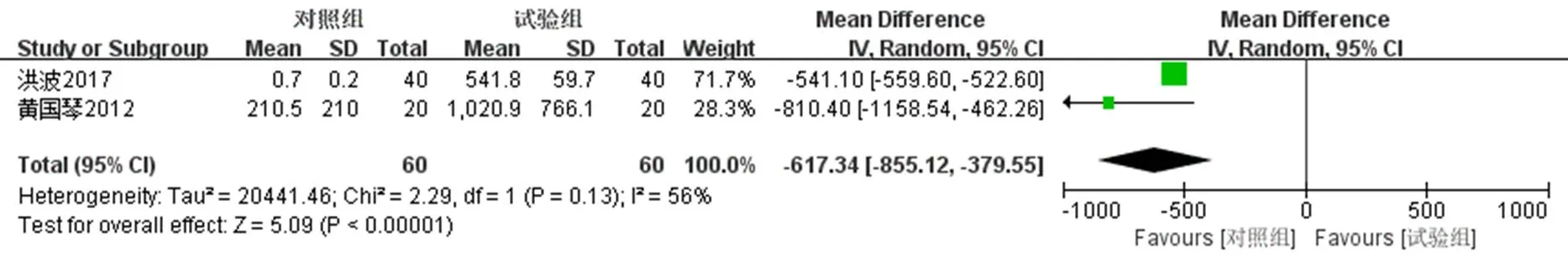
图10 用药结束6个月后负荷量的Meta分析
2.4.4 病灶消退率 1项研究[7]报道了派特灵组与随访对照组治疗后3、6、9个月病灶消退情况,派特灵组用药结束3、6、9个月后50例患者中分别有13、17、18例消退,随访对照组分别有4、6、8例消退,派特灵组病灶消退率明显高于随访对照组,差异均具有统计学意义(分别为0.017、0.009、0.023)。其中用药结束后9个月病灶消退率高于用药结束后3、6个月。
2.4.5 不良反应发生情况 9项研究[10-14,19-20,22,25]观察了派特灵的不良反应,其中1项[12]报道了派特灵治疗中出现1例局部灼热刺痛及1例恶心呕吐症状,1项[14]报道了4例患者出现阴道分泌物增多及下腹酸胀症状,2项[10-11]报道了派特灵用于绝经后及子宫全切术后女性出现阴道烧灼症状,1项[22]报道出现1例阴道轻度瘙痒症状;3项[13,20,25]表明未见明显不良反应,1项[19]描述了不良反应但未描述导致不良反应的具体药物。保妇康栓组未见明显不良反应报道,1项[22]报道了干扰素组出现阴道瘙痒3例、烧灼样疼痛2例、内分泌失调2例、流感样综合2例。
2.5 发表偏倚分析
本研究的分组均分别进行了发表偏倚分析,漏斗图显示2侧分布基本对称,提示存在发表偏倚的可能性较小。见图11。

图11 发表偏倚分析
3 讨论
派特灵为由中国科学院实验室研制的一种外用涂抹或湿敷、稀释冲洗下生殖道的纯中药液体制剂,较早运用于HPV感染导致的疣性病变或病毒的清除。带下病的描述最早见于《黄帝内经》:“任脉为病……带下瘕聚”,张景岳认为“妇女带下,总由命门不固”,《傅青主女科》又云:“夫带下俱是湿症”。《中医妇科学》第9版[28]将带下病辨证分型为脾阳虚证、肾阳虚证、阴虚夹湿证、湿热下注证和湿毒蕴结证5型,有学者对所有现代相关研究文献中常见分型进行研究统计发现宫颈HPV感染的中医证型以湿热下注型最为常见[29]。派特灵以苦参、白花蛇舌草等清热解毒、活血燥湿中药为基础,鸦胆子、蛇床子等去腐除蚀杀虫中药为辅,经现代科学流程提取精制而成。苦参中含有解热、抗炎、抗过敏及抗滴虫等多种活性的成分,苦参碱能促使癌细胞的胞核染色体数量及结构变化并破坏胞膜的完整性,发挥抑制携带HPV16基因的SiHa细胞增殖作用并诱导其凋亡,对HPV的预防治疗起到重要作用[30]。刘运华等[31]的实验证实派特灵可能通过抑制Wnt/β-catenin通路发挥抑制Ect1/E6E7细胞增殖迁移能力的作用,抑制癌基因表达来降低宫颈癌的发生率。许荣[32]在研究不同种类药物对HPV病毒的免疫激发作用的小鼠实验中,证实派特灵能够激发免疫作用、增强小鼠免疫应答从而降低感染组织的HPV病毒载量。
本研究首次对派特灵用于HR-HPV感染的RCT进行了系统评价。派特灵组与随访对照组的研究结果表明用药结束3、6、9、12个月后派特灵组对HR-HPV的疗效均优于随访对照组,HPV转阴率分别是随访对照组的2.54、2.61、2.02、1.47倍,最高HPV转阴率时间点出现在用药结束6个月后,1年后的转阴率最低。用药结束6个月最高转阴率及1年最低转阴率的结论分别与岳阿兰等[33]、张数丹等[34]发表的5-氨基酮戊酸光动力疗法及重组干扰素α2b阴道泡腾胶囊用于治疗HPV的Meta分析结果相同。本研究对不同时期HPV转阴率、HPV-DNA负荷量、HPVmRNA拷贝水平、病灶消退率分别进行了Meta分析,所得结论能够给临床治疗HPV感染提供一定的参考价值。依据目前研究,临床医生完全评估后患者可以在结束用药后的半年为停药观察时间分界,再行HPV复查检测,在一定程度上能够缓解患者紧张焦虑,有利于机体发挥自身免疫清除作用以及减少医疗浪费。派特灵组与保妇康栓组相比结果显示2组临床疗效差异不具有统计学意义;派特灵组与干扰素组相比结果显示2组临床疗效差异具有统计学意义,派特灵治疗组对HR-HPV的疗效优于干扰素组。对用药结束3、9个月及干扰素组HPV转阴率的异质性行敏感性分析,发现朱琼等[14]、宋元梓[25]的研究是产生异质性的原因,考虑与其HPV转阴评判标准有关致使2组间数据差异较为明显。
文献中派特灵治疗HR-HPV感染的不良反应主要包括阴道瘙痒、灼热疼痛及分泌物增多、下腹酸胀症状,大多和患者自身激素水平下降导致生殖道敏感性相关,停药可自行消失,未产生用药局部出血、感染及宫颈损伤等严重反应,故未行Meta分析。同时证实派特灵疗效明显,副作用小,操作可重复性强,对于有生育需求的患者能够避免宫颈结构的损伤,为一种较为良好的选择。
通过对文献的阅读及数据的提取整理,研究尚存在以下局限性:①部分纳入文献并未对患者病毒感染的具体时间、类型及病程、初次性生活年龄、孕产史、性生活伴侣数量及治疗期间是否采取安全措施避免交叉感染等做出统计,未描述进行了完整的基线比对;②药物的使用剂量及方法、用药后HPV转阴评判指标不尽相同;③HR-HPV分型众多,纳入的文献并未对所有临床常见分型进行检测,有仅对其中一两种或限定几种分型感染情况的研究;④纳入文献缺乏安慰剂对照;⑤派特灵组与保妇康栓组及干扰素组的研究纳入数量偏少,疗效对比结果具有不稳定性;⑥纳入文献时间横跨2011—2020年,年代久远文献质量参差不齐;以上因素势必对研究的准确性造成影响,增加研究的异质性,造成其他的偏倚产生的几率。
笔者通过对目前相关文献的广泛阅读并未发现国内外有关此药物的安慰剂对照试验,因此并未拓宽研究的纳入标准。HR-HPV感染在一定程度上具有较强的私密性,部分女性患者容易产生紧张、焦虑负面情绪,给机体免疫力发挥对病毒的清除作用带来阻碍,延缓甚至加重了疾病的进程,心理疏导逐渐成为疾病治疗中的关注点[35]。安慰剂能够在一定程度上避免不良情绪对疾病的影响,使研究更具可靠性,既往关于HPV感染治疗的Meta分析中未出现纳入安慰剂的对照试验。综上,对于派特灵治疗HPV感染的临床疗效尚需更多的多中心、大样本的高质量RCT进行结果验证,为临床治疗提供更可靠的循证证据。
利益冲突 所有作者均声明不存在利益冲突
[1] Forman D, de Martel C, Lacey C J,.Global burden of human papillomavirus and related diseases [J]., 2012, 30(Suppl 5): F12-F23.
[2] Bray F, Ferlay J, Soerjomataram I,.Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2018, 68(6): 394-424.
[3] Zuna R E, Allen R A, Moore W E,.Distribution of HPV genotypes in 282 women with cervical lesions: Evidence for three categories of intraepithelial lesions based on morphology and HPV type [J]., 2007, 20(2): 167-174.
[4] 刘丽菲, 张淑芬, 寇海梅.张玉芬教授治疗宫颈HPV感染临床经验 [J].光明中医, 2017, 32(10): 1393-1395.
[5] 陈君霞, 陶萍萍, 王运根, 等.派特灵与膦甲酸钠治疗宫颈人乳头瘤病毒感染的疗效比较 [J].国际流行病学传染病学杂志, 2014, 41(2): 98-100.
[6] 邓雪云, 刘卫良, 胡志文.派特灵宫颈治疗对宫颈高危型人乳头瘤病毒的效果及预后探讨 [J].当代医学, 2019, 25(27): 128-129.
[7] 龚剑敏.派特灵在高危型人乳头状瘤病毒感染治疗中的应用 [J].河南医学研究, 2019, 28(16): 2994-2995.
[8] 宋志琴, 王蔼明.派特灵治疗宫颈高危型人乳头瘤病毒感染的临床观察 [J].转化医学杂志, 2015, 4(5): 300-301.
[9] 尤丽, 刘赛, 张艳.派特灵治疗HR-HPV 16/18/31/52/ 58/33高危亚型效果观察 [J].临床医药文献电子杂志, 2019, 6(21): 47-48.
[10] 杨丽萍, 沙丽, 周津曼, 等.派特灵在下生殖道高危型HPV16、18感染治疗中的临床应用研究 [J].世界最新医学信息文摘, 2020, 20(55): 118-119.
[11] 李会影, 杨丽萍, 周津曼, 等.派特灵在下生殖道高危型HPV16感染治疗中的临床应用研究 [J].世界最新医学信息文摘, 2020, 20(95): 109-110.
[12] 顾卉晴, 陈雪峰, 骆亚琴.派特灵宫颈治疗对宫颈高危型人乳头瘤病毒感染转归的影响 [J].中国生化药物杂志, 2017, 37(5): 122-124.
[13] 陈锐, 赵健, 廖秦平.派特灵治疗宫颈上皮内瘤变1、2级临床疗效观察 [J].中国实用妇科与产科杂志, 2011, 27(9): 703-705.
[14] 朱琼, 姜翙, 苏素文, 等.派特灵干预治疗宫颈高危型HPV感染的效果 [J].现代医学与健康研究电子杂志, 2019, 3(1): 69-70.
[15] 陈瑞英, 朱丽萍, 杜莉, 等.派特灵对持续性高危型人乳头瘤病毒感染的治疗效果评价 [J].中国妇幼保健, 2017, 32(5): 910-911.
[16] 黄凌霄, 郭敏, 董晓霞, 等.派特灵宫颈用药对HPV E6/E7 mRNA表达的影响 [J].中国现代医生, 2018, 56(25): 74-78.
[17] 洪波.派特灵治疗宫颈高危型人乳头瘤病毒感染的临床观察 [J].实用妇科内分泌杂志: 电子版, 2017, 4(28): 101.
[18] 黄国琴.派特灵治疗宫颈高危型人乳头瘤病毒感染的临床观察 [J].中国妇幼健康研究, 2012, 23(5): 675-677.
[19] 支雄莉, 陈海霞, 胡志君, 等.保妇康栓联合派特灵治疗HR-HPV感染的疗效比较 [J].河北医药, 2016, 38(16): 2468-2470.
[20] 王彤彤, 张世红, 乔羽佳, 等.派特灵与保妇康栓治疗高危型HPV感染的疗效比较 [J].药物与人, 2014, 27(12): 49.
[21] 李亚光, 张炜悦, 王伟杰, 等.派特灵治疗宫颈持续HR-HPV感染疗效分析 [J].华北理工大学学报: 医学版, 2020, 22(6): 436-440.
[22] 杨永萍, 赵东怡.派特灵治疗宫颈高危HPV感染的效果分析 [J].中国现代药物应用, 2018, 12(12): 121-122.
[23] 孙璞, 芮广海, 金锋.派特灵治疗持续性HPV16、18感染的临床效果分析 [J].中国实用医药, 2020, 15(27): 1-4.
[24] 牛凤萍.派特灵治疗宫颈上皮内瘤变Ⅰ、Ⅱ期临床疗效 [J].肿瘤基础与临床, 2013, 26(4): 355-356.
[25] 宋元梓.中药派特灵治疗宫颈CIN1、CIN2的临床观察 [J].母婴世界, 2016(1): 47.
[26] 陈锐, 冯凌, 付艳, 等.派特灵治疗宫颈病变术后高危型人乳头瘤病毒持续呈阳性的临床研究 [J].中华妇幼临床医学杂志: 电子版, 2020, 16(4): 438-443.
[27] 赵卉.派特灵治疗宫颈病变手术后持续高危HPV感染疗效观察 [J].基层医学论坛, 2019, 23(14): 2071-2072.
[28] 马宝璋, 齐聪.中医妇科学[M].第3版.北京: 中国中医药出版社, 2012: 127.
[29] 王文莹, 张敏, 杜敏.宫颈人乳头瘤病毒(HPV)感染的中西医防治 [J].中医药信息, 2020, 37(2): 86-91.
[30] 王芳.甘肃陇南宫颈癌人乳头瘤病毒感染的区域特征及药物防治研究 [D].兰州: 兰州大学, 2011.
[31] 刘运华, 赵宗江, 张新雪, 等.派特灵对HeLa细胞增殖迁移能力及PI3K/Akt信号转导通路的影响 [J].中国实验方剂学杂志, 2020, 26(17): 56-63.
[32] 许荣.5种药物对HPV感染裸小鼠模型免疫反应的影响 [D].天津: 天津医科大学, 2019.
[33] 岳阿兰, 韩霞.5-氨基酮戊酸光动力疗法治疗宫颈高危型HPV感染疗效的Meta分析 [J].临床皮肤科杂志, 2020, 49(7): 403-408.
[34] 张树丹, 李琪, 李戈.重组人干扰素α2b阴道泡腾胶囊治疗HPV感染的Meta分析 [J].中国医药导报, 2017, 14(31): 111-115.
[35] 管艳兰, 何萍, 金建凤.家属协同健康教育结合心理疏导模式在HPV感染宫颈炎患者中的应用 [J].中国妇幼保健, 2021, 36(7): 1657-1659.
Meta-analysis on effect of Paiteling on high-risk HPV infection
LIU Lian-hui1, 2, QIN Wen-min2, ZHANG Ying-xue2, LIU Jie2
1.Nanjing University of Chinese Medicine, Nanjing 210023, China 2.Xuzhou Hospital Affiliated to Nanjing University of Chinese Medicine, Xuzhou 221000, China
To systematically evaluate the efficacy and safety of Paiteling (派特灵) in the treatment of high-risk human papillomavirus (HR-HPV) infection.Randomized controlled trials (RCT) in CNKI, Wanfang database, VIP database (VIP), CBM database, PubMed, EMbase and the Cochrane Library were all searched from their inception to March, 2021.Two researchers independently screened the articles, extracted the data and evaluated the quality of the articles according to the inclusion and exclusion criteria, the RevMan 5.3 software was used for Meta-analysis.A total of 2248 cases were included in 22 RCTs.Three, six, nine, 12 months after the end of the medication, the efficacy of the Paiteling group on HR-HPV infection was better than that of the follow-up control group, and the negative conversion rate was 2.54, 2.61, 2.02 and 1.47 times that of the follow-up control group, respectively.Three months after the end of the medication, the HPV viral load of the Paiteling group was significantly lower than that of the follow-up control group, and the clinical efficacy comparison between the two groups was statistically significant [MD = −486.72, 95% CI (−505.90, −467.54),< 0.000 01]; Six months after the end of the medication, the HPV viral load of the Paiteling group was significantly lower than that of the follow-up control group, and the clinical efficacy comparison between the two groups was statistically significant [MD = −617.34, 95% CI (−855.12, −39.55),< 0.000 01].The decrease of HPVmRNA copy levels in the non-surgical Paiteling group was higher than that in the follow-up control group at six, nine, and 12 months after the end of the medication, and the difference was significant (thevalues were −4.216, −4.151, and −4.359, respectively, all< 0.001).The decrease of HPVmRNA copy levels in the Paiteling group was higher than that of the follow-up control group at six, nine, and 12 months after after the end of the medication, and the difference was significant (thevalues were −2.880, −3.226, −2.914, all< 0.05).At three, six, and nine months after the medication, the regression rate of the lesions in the Paiteling group was significantly higher than that of the follow-up control group, and the differences were statistically significant (thevalues were 0.017, 0.009, 0.023).The comparison of clinical efficacy between the two groups of Paiteling and Baofukang Suppository (保妇康栓) was not statistically significant [RR = 1.24, 95% CI (0.75, 2.03),= 0.40].Compared with interferon, the comparison of clinical efficacy between the two groups is statistically significant [RR = 1.95, 95% CI (1.57, 2.41),< 0.000 01].The efficacy of Paiteling on HR-HPV was better than the interferon.Paiteling has significant efficacy in treating HR-HPV infection, and its high safety is worthy of further clinical promotion.Compared with interferon, Paiteling has a more obvious effect.However, due to the limited sample size of the included studies, the results of the study may be biased, and more high-quality and large-sample clinical studies are needed for verification.
human papillomavirus (HPV); HPV infection; Paiteling; Meta-analysis; randomized controlled trial
R285.64
A
0253 - 2670(2021)22 - 6928 - 11
10.7501/j.issn.0253-2670.2021.22.019
2021-05-13
江苏省中药药效与安全性评价重点实验室—江苏正阳药业联合开放课题(JKLPSE201902)
刘莲慧(1995—),女,硕士研究生,研究方向为妇科疾病的研究。E-mail: 1352517861@qq.com
通信作者:秦文敏(1977—),女,硕士生导师,医学博士,主要从事中医妇科临床研究工作。E-mail: qwmin128@sina.com
[责任编辑 潘明佳]

