南疆四种盐生植物根际土壤真菌群落结构特征
李明源,王继莲,周 茜,张 甜,美合热阿依·木台力甫
1 喀什大学生命与地理科学学院,喀什 844006 2 叶尔羌绿洲生态与生物资源研究自治区高校重点实验室,喀什 844006 3 新疆帕米尔高原生物资源与生态自治区重点实验室,喀什 844006
盐生植物是一类能在盐浓度200 mmol/L NaCl或更高的环境中生长并完成生活史的植物,其对盐分胁迫的适应性具有复杂的生化和遗传机制[1]。多数盐生植物是盐碱地中唯一能够正常生存的植物种类,它们在盐碱地植被建植、水土保持及生态平衡的维系等方面起着至关重要的作用[2- 4]。在过去的几十年,有关盐生植物耐盐碱胁迫的生理机制和基因表达变化等方面取得了很大进展[5-6],但单纯利用传统育种方法或基因工程改造技术来培育抗盐碱植物,提升作物抗盐碱能力的成效有限。研究发现,采用生物接种方法,即将盐生植物根际的少数有益微生物如丛枝菌根真菌(AMF)接种于植物,能有效缓解盐碱胁迫对非盐生植物生长的抑制作用[7- 9],对非盐生植物在盐碱环境中的生长、养分吸收及改善土壤质量有积极影响[8, 10-11]。挖掘盐生植物根际的有益微生物作为促进非盐生植物生产的有效生物接种剂,被认为是可持续提高非盐生植物耐盐碱性的有效策略[12-13]。
根际微生物与植物关系最为密切,它们以植物根系分泌物为营养进行生长繁殖, 通过分泌各种胞外酶分解、矿化土壤中的有机物质等增加土壤有效养分含量, 提高植物对养分的吸收[14-15]。而植物在生长过程中通过根系主动向根际土壤分泌生物活性物质, 吸引大量有益微生物在根际聚居并促进其生长发育, 进而对根际微生物种类和数量产生影响[16-17]。研究显示,盐碱化问题的加剧不仅会对土壤微生物活性和群落组成产生直接影响,还能通过影响植物根系和土壤动物活动等对其产生间接作用[18-19]。在盐碱土壤种植盐生植物后,既能有效降低根际土壤盐度,使土壤微生物数量增加,同时还会促使根际微生物群落结构发生改变,通过介导土壤环境反过来影响盐生植物生长[13, 20- 21]。诸多学者相继开展了荒漠区、高寒草地等生境土壤真菌群落研究[22-23],分析了其与环境因子的互作效应,但有关盐生植物根际土壤真菌多样性和群落结构的研究鲜见报道。
不同盐生植物的耐盐碱能力不同,导致盐生植被的空间格局受盐碱化程度影响呈现一定地域性差异。新疆作为我国最大的盐土区,土壤盐分高,碱性重,严重限制了植物的分布和生存。而南疆又是全疆盐碱化趋势最严重的区域[24],在这样的生境中却生长着丰富的盐生植物,其中一些种群还在盐碱荒漠植被形成过程中起着主要建群作用,被认为是适合土壤修复的类群。这些土著盐生植物根际微生物群落结构特征如何?同一盐碱环境中不同种类的盐生植物根际微生物群落有何共性特征和个性差异?对这类环境中不同盐生植物根际微生物群落结构进行研究,有助于发现对盐生植物耐盐碱胁迫有贡献的有益微生物类群,对其开发利用在增强非盐生植物抗逆性方面有巨大潜力。本研究以新疆南疆伽师县同一盐碱地中的四种盐生植物为材料,采用Illumina NovaSeq测序平台对其根际土壤真菌群落结构和多样性进行分析,并研究真菌群落结构与土壤环境因子间的相关性,旨在探究对盐生植物耐受盐碱胁迫有显著影响的关键微生物群落,为盐碱地合理开发利用提供理论依据。
1 材料与方法
1.1 研究区概况及根际土壤样品采集
伽师县堪称新疆南疆水苦低产的盐碱窝,位于天山南麓,塔里木盆地西缘,是塔克拉玛干沙漠西缘的一块绿洲。该区域地理坐标76°20′—78°00′E,39°16′—40°00′N,属温带干旱荒漠气候,多年平均降水量56 mm,年蒸发量是年降水量的40倍。20世纪80年代全国第二次土壤普查结果表明,伽师县非盐碱化农耕土地面积仅占全县耕地面积的1.9%,轻度盐碱化土地占14.2%,中度盐碱化土地占21.0%,重度盐碱化土地达63.0%[25]。土壤盐碱化已成为限制该地区植物生存和演替的主要因子,导致土壤结构改变和肥力下降,加速了土地退化进程。研究区内植被主要包括柽柳(Tamarixchinensis)、盐穗木(Halostachyscaspica)、黑果枸杞(Lyciumruthenicum)、花花柴(Kareliniacaspia)、盐爪爪(Kalidiumfoliatum)、旱生芦苇(Phragmitesaustralis)、骆驼刺(Alhagisparsifolia)和碱蓬(Suaedaglauca),交错分布。
2019年8月,依据典型性和代表性原则,采集伽师县夏普吐勒乡境内非开垦干旱盐碱荒地(76°55′E,39°49′N)盐爪爪、黑果枸杞、花花柴和旱生芦苇四种优势土著盐生植物根际土壤。采样方法为多点混合采样法,即在样区内采取“S”型路线随机布点12处,样点之间距离不少于20 m。每种植物在每个采样点均选取生长旺盛且冠幅大小一致的健康个体采集1—2株。先去除0—5 cm的表土,深挖取出整株根系(约20—40 cm),轻轻抖去根系上附着较松散的土壤,保留与根系紧密结合的土壤(约1—3 mm),小心剪下根系装入50 mL无菌离心管中,每3个相邻样点采集的相同植物根系再混合为一个样品,最终得到每种植物4个重复样品,4种植物共16个样品,于低温下带回实验室,迅速进行根际土壤基因组提取。
1.2 研究方法
1.2.1土壤理化性质分析
相同植物根际土壤样品以四分法混匀,过筛去除杂草、砾石等杂质,参照《土壤农化分析》方法测定土壤理化指标[26]。采用电位法测定土壤pH;水土比5∶1混合测定土壤电导率(EC);105℃烘干称重法测定土壤含水量(SWC);重铬酸钾容重法测定土壤有机质(SOM);重铬酸钾-硫酸消煮法测定土壤全氮(TN);硫酸-高氯酸消煮、钼锑抗比色法测定土壤全磷(TP);NaOH熔融-火焰光度法测定土壤全钾(TK);碱解扩散法测定土壤速效氮(AN);NaHCO3浸提-钼锑抗比色法测定土壤速效磷(AP);NH4OAc浸提-火焰光度法测定土壤速效钾(AK)。
1.2.2土壤基因组DNA提取
采用土壤基因组DNA提取试剂盒(OMEGA E.Z.N.A. Soil DNA Kit, USA)提取总DNA。向装有植物根系的50 mL离心管中加入生理盐水(0.85% NaCl)30 mL,约30颗无菌玻璃珠(φ3 mm),涡旋振荡10 min后弃根系,所得根际土壤溶液经4℃、16000 g离心10 min弃上清,参照土壤基因组DNA提取试剂盒说明书提取DNA。采用0.7%琼脂糖凝胶电泳检测,利用微量紫外分光光度计(Nanodrop 2000)检验基因组纯度和浓度后于-20℃保存。
1.2.3真菌ITS基因扩增与测序
以土壤总DNA为模板,采用引物ITS1- 1F-F(5′-CTTGGTCATTTAGAGGAAGTAA- 3′)和ITS1- 1F-R (5′-GCTGCGTTCTTCATCGATGC- 3′)扩增真菌ITS1基因片段,每个DNA模板做三个重复。PCR反应条件参照Miao等[27]方法:95℃,2 min;95℃,30 s;55℃,30 s;72℃,45 s;30个循环;72℃再延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后送测序公司(北京诺禾致源生物信息科技有限公司),采用Illumina NovaSeq测序平台进行双末端测序。
1.2.4数据分析
依据PCR扩增引物和Barcode序列对Illumina NovaSeq下机数据进行初步拆分,得到各样品的原始数据。去除Barcode序列和低质量碱基后,使用FLASH(V1.2.7)软件拼接各样品的原始序列,得到Clean Tags,再进行嵌合体过滤,得到最终有效数据[28]。利用Uparse软件(Uparse V7.0.1)对各样品有效数据在97%相似性水平上进行操作分类单元(OTU)截断聚类,同时筛选OTUs中出现频数最高的序列作为代表序列。利用Qiime软件(V1.9.1)中的blast方法与Unit(V7.2)数据库进行物种注释,并分别在各个分类水平统计各样本的群落组成。使用MUSCLE(3.8.31)软件进行快速多序列比对建树,获取全部OTUs代表序列的系统分类地位。各样品最终数据经均一化处理后使用Qiime软件计算丰富度和多样性指数;利用R软件绘制Rank Abundance曲线、稀释曲线以及PCA图等;通过典范对应分析(CCA)研究土壤真菌群落和理化因子之间的相关性。利用SPSS 21.0软件对所有数据进行单因素方差分析(One-Way ANOVA)和Duncan新复极差法检验。数据为平均值±标准差。
2 结果与分析
2.1 土壤理化性质
四种盐生植物根际土壤理化特征不尽相同(表1)。土壤pH均超过8.0,但盐爪爪与旱生芦苇显著高于黑果枸杞和花花柴。EC由高到低为旱生芦苇>盐爪爪>花花柴>黑果枸杞,说明旱生芦苇与盐爪爪根际土壤中混合盐含量明显高于花花柴和黑果枸杞,能聚集盐离子或更偏好高盐碱环境。黑果枸杞根际土壤的SOM、TN、TP、TK、AN和AP值均最高,旱生芦苇根际土壤的SOM、TN、TP、TK和AN值均最低,但SWC和EC值最高。
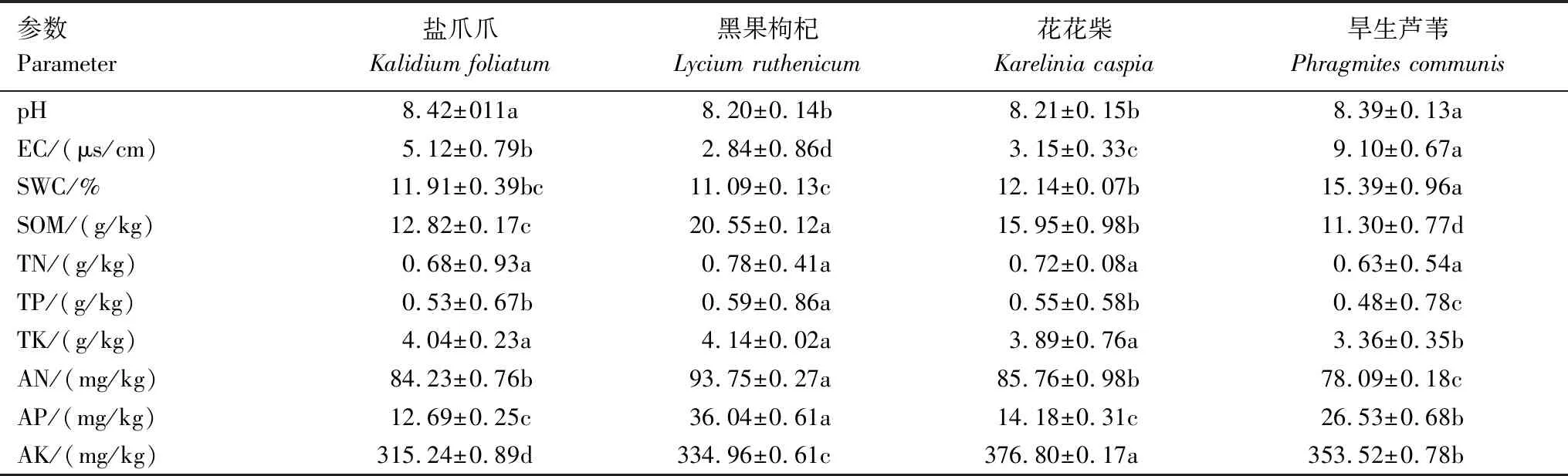
表1 四种盐生植物根际土壤理化特征
2.2 真菌群落丰度及多样性分析
测序结果表明,各样本测得有效数据长度在238—241 bp之间,平均长度239左右。测序数据质控后共得到981983条有效序列(表2),以97%的一致性将序列聚类成564个OTUs。由各样本稀释曲线可见(图1),随测序深度增加,曲线趋向平坦,说明样本测序数据量合理,能够准确反映四种盐生植物根际土壤真菌群落特征。四种盐生植物根际土壤真菌群落丰富度(ACE、Chao 1指数)依次为盐爪爪>旱生芦苇>黑果枸杞>花花柴,黑果枸杞与花花柴根际真菌丰富度指数无显著差异(P>0.05)。Shannon指数和Simpson指数依次为盐爪爪>黑果枸杞>旱生芦苇>花花柴,旱生芦苇与黑果枸杞之间无显著差异(P>0.05)。表明四种盐生植物根际真菌群落多样性和丰富度各不相同。

表2 四种盐生植物根际土壤真菌ITS测序数据统计及alpha多样性分析

图1 样本稀释曲线Fig.1 Rarefaction curves for samplesA. 盐爪爪; B. 黑果枸杞; C. 花花柴; D. 旱生芦苇
根据聚类结果分析它们共有和特有的OTUs(图2)。盐爪爪和黑果枸杞共有的OTUs数量为250个,盐爪爪和花花柴共有的OTUs数量为216个,盐爪爪和旱生芦苇共有的OTUs数量为332个,黑果枸杞和花花柴共有的OTUs数量为192个,花花柴和旱生芦苇共有的OTUs数量为171个,四种盐生植物之间共有OTUs数量为153个。盐爪爪、黑果枸杞、花花柴和旱生芦苇特有的OTUs数量分别为51、19、11和53个,占各自根际土壤真菌OTUs总数的9.04%、3.37%、1.95%和9.40%。
2.3 四种盐生植物根际土壤真菌群落分布特征
2.3.1门水平群落组成与结构
四种盐生植物根际土壤样品中共检测出真菌8门、21纲、44目、89科、124属。如图3所示,子囊菌门 (Ascomycota)是四种盐生植物根际土壤真菌的绝对优势菌群,其相对丰度在花花柴根际占比最高(94.8%),在旱生芦苇根际占比最低(74.6%)。担子菌门(Basidiomycota)为亚优势菌门,在四种植物根际的相对丰度在0.3%—1%之间。排列第三的是壶菌门(Chytridiomycota),但该门仅分布在盐爪爪和旱生芦苇根际土壤中,相对丰度分别为0.93%和0.74%。被孢霉门(Mortierellomycota)在黑果枸杞根际土壤的相对丰度达1.1%,但在其它三种植物中几乎没有检测到。基于Unweighted Unifrac距离的UPGMA聚类树也可以发现(图4),四种盐生植物根际土壤真菌群落在门水平上相对丰度不一,盐爪爪和旱生芦苇根际土壤真菌群落组成更相似。
2.3.2属水平群落组成与结构
如图5所示,四种盐生植物根际土壤真菌群落在属水平上相对丰度各不相同,优势菌属和特有菌属也不尽相同,镰孢菌属(Fusarium)、支顶孢属(Acremonium)和曲霉属(Aspergillus)是它们共有优势菌属。从植物种类看,盐爪爪根际土壤中相对丰度大于1%的属分别为镰孢菌属(22.31%)、微囊菌属(Microascus)(9.74%)、梨孢帚霉属(Scopulariopsis)(7.37%)、青霉菌属(Penicillium)(5.16%)、支顶孢属(4.41%)、曲霉属(2.97%)、瓶霉菌属(Phialophora)(2.81%)、翅孢壳属(Emericellopsis)(2.03%)、格孢腔菌属(Pleospora)(2.03%)、单胞瓶霉属(Phialemonium)(1.96%)和链格孢属(Alternaria)(1.93%),其中镰孢菌属占主导地位。黑果枸杞根际土壤中相对丰度大于1%的属分别为镰孢菌属(30.83%)、曲霉属(15.26%)、链格孢属(10.25%)、梨孢帚霉属(9.85%)、青霉菌属(4.21%)、支顶孢属(3.25%)、茎点霉属(Phoma)(2.77%)、翅孢壳属(2.52%)和微囊菌属(1.51%),其中镰孢菌属、曲霉属和链格孢属占主导地位。花花柴根际土壤中相对丰度大于1%的属分别为支顶孢属(43.65%)、镰孢菌属(14.28%)、梨孢帚霉属(9.46%)、翅孢壳属(8.73%)、闭小囊菌属(Kernia)(6.80%)、青霉菌属(3.23%)、曲霉属(2.56%)和帚枝霉属(Sarocladium)(1.01%),其中支顶孢属和镰孢菌属占主导地位。旱生芦苇根际土壤中相对丰度大于1%的属分别为镰孢菌属(38.41%)、支顶孢属(8.96%)、曲霉属(7.98%)、链格孢属(6.16%)、青霉菌属(1.51%)和地丝霉属(Geomyces)(1.04%),其中镰孢菌属占主导地位。

图3 门水平上四种盐生植物根际土壤真菌群落分布特征 Fig.3 Histogram of relative abundance of fungal species at phylum level

图4 基于Unweighted Unifrac距离的UPGMA聚类树Fig.4 UPGMA cluster tree based on Unweighted Unifrac distance

图5 属水平上四种盐生植物根际土壤真菌群落分布特征 Fig.5 Distribution characteristics of rhizosphere fungal communities of four halophytes at genus level
相比而言,四种盐生植物根际优势真菌在群落组成上具有一定相似性,但相对丰度存在明显差异。从属水平物种系统发生关系和相对丰度聚类分析可以看出(图6),镰孢菌属是四种盐生植物根际的共同优势菌属,但它在花花柴根际的相对丰度显著低于其它三种植物。支顶孢属在花花柴根际土壤中占绝对优势,相对丰度达43.65%,但在另外三种植物根际的相对丰度却均低于10%。曲霉属在黑果枸杞根际的丰度最高(15.26%),是黑果枸杞根际土壤中的次优势菌属,但在其它三种植物根际却不占主导地位。链格孢属在黑果枸杞根际土壤中相对丰度排列第三,是旱生芦苇根际土壤中的第四优势菌属,但在盐爪爪和花花柴根际土壤真菌群落中却不占优势(相对丰度小于1%)。茎点霉属在黑果枸杞根际土壤中的相对丰度达2.77%,而在其它植物根际的丰度均低于0.2%。梨孢帚霉属在旱生芦苇根际的丰度仅0.2%,而在其它植物根际的分布丰度却均超过7%,属于亚优势菌属。微囊菌属在盐爪爪根际土壤中是仅次于镰孢菌属的亚优势菌属,而在另外三种植物根际土壤中的相对丰度却较低。闭小囊菌属在花花柴根际的相对丰度达6.79%,而在其它植物根际分布极少。格孢腔菌属在盐爪爪根际的相对丰度达2.03%,而在其它植物根际几乎没有发现。

图6 属水平上物种系统发生关系Fig.6 Phylogenetic tree constructed with representative sequences of species at genus level分支和扇形的颜色表示其对应的门,扇环外侧的堆积柱形图表示该菌属在不同样本中的丰度分布信息
2.4 根际土壤真菌群落结构与土壤理化因子间的相互关系
通过CCA分析真菌群落与土壤理化因子间的相关性(图7),第一、二排序轴累计解释率分别为51.72%和29.6%,累计解释率达到81.32%,说明第一、二排序轴能较好地反映出真菌群落与土壤理化因子之间的相互关系。真菌群落的差异性分布主要约束在第一轴和第二轴。对于第一轴,较重要的环境因子分别是AK、AP和EC,因为这些因子与第一轴夹角很小(分别为46.5°、48.4°和12.0°),即投影较长。约束在第二轴上的重要的环境因子为AK、AP和pH。镰孢菌属、曲霉属和链格孢属与AP、EC和SWC箭头方向相同,说明这3属真菌的分布丰度与AP、EC和SWC之间呈正相关。青霉菌属和梨孢帚霉属与pH、TK箭头方向相同,说明其群落丰度与土壤TK和pH呈正相关。支顶孢属、翅孢壳属和闭小囊菌属与AK呈正相关,与pH、AP和EC呈负相关。
综上,对真菌群落结构具有重要影响因素的土壤指标有:AK(r2=0.893,P<0.01),AP(r2=0.725,P<0.01),pH(r2=0.505,P<0.01)和EC(r2=0.334,P<0.05)(表3)。土壤速效钾、速效磷、pH和电导率是影响四种盐生植物根际土壤真菌群落分布的主要驱动因子。
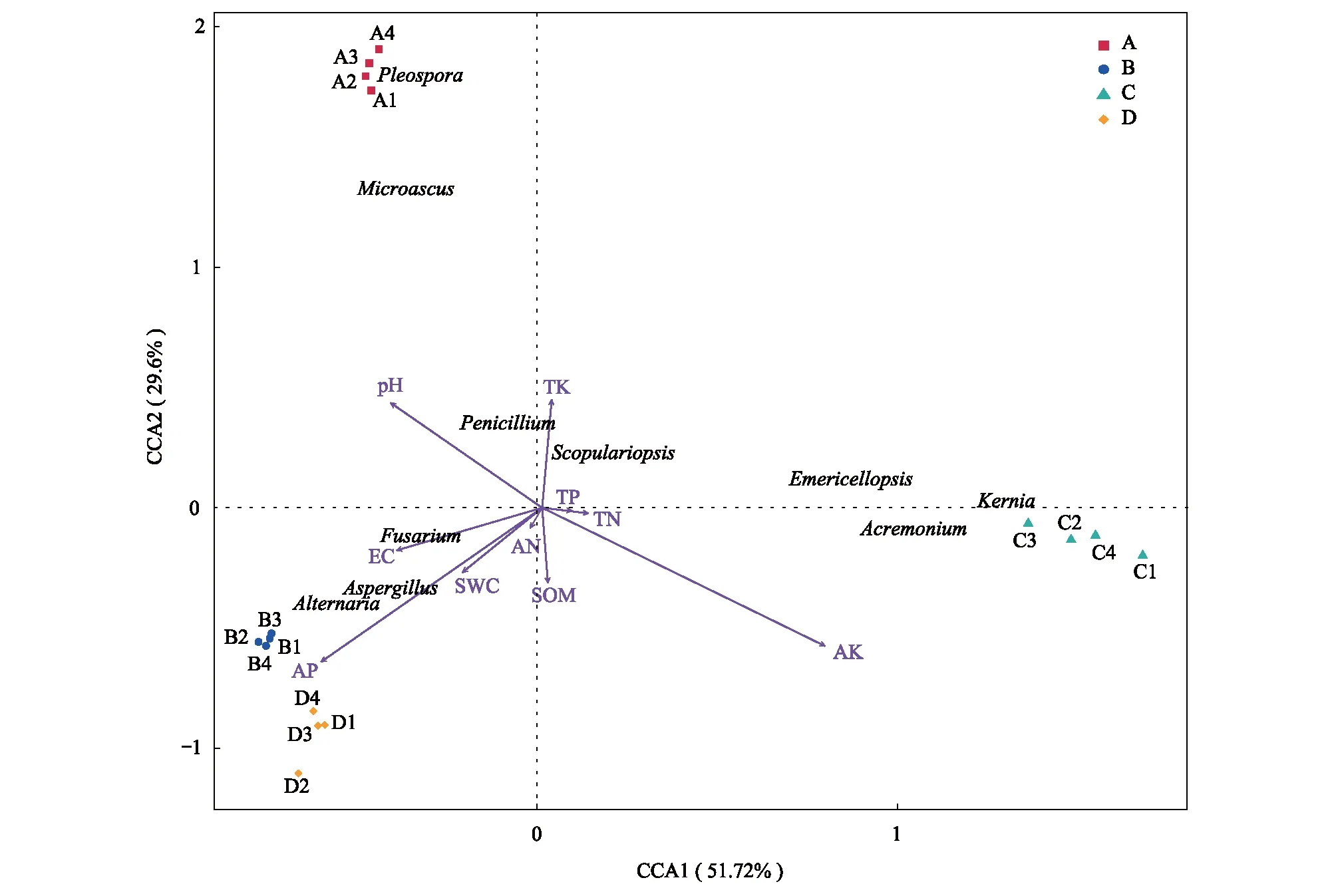
图7 优势真菌类群与土壤环境因子的 CCA 分析Fig.7 Canonical correspondence analysis of dominant fungal groups and soil environmental factors
从属水平上物种丰富度与环境因子Spearman相关性分析发现(图8),优势菌属中镰孢菌属、曲霉属和链格孢属与AP呈极显著正相关(P<0.01),与其它环境因子无显著关系。支顶孢属和帚枝霉属与AK呈极显著正相关(P<0.01),与TK呈极显著负相关(P<0.01)。梨孢帚霉属和翅孢壳属与AN、SOM、TN和TP呈极显著正相关(P<0.01),但与pH、EC和SWC呈极显著负相关(P<0.01)。微囊菌属、青霉菌属和茎点霉属与TK呈极显著正相关(P<0.01),但与AK呈极显著负相关(P<0.01)。非优势菌属分布丰度与土壤环境因子之间的关系各有不同。
3 讨论
植物对盐碱、旱、寒等逆境的抗性或耐性并不纯粹源于植物基因组本身,根际土壤微生物对宿主适应逆境胁迫也有积极影响,是植物基因组的有效延伸[16, 29-30]。同时,宿主植物能够通过根际分泌物成分的复杂变化来塑造对自身生长代谢有益的根际微生物群落[31-32]。接种健康土壤中的少量“供体”微生物有助于恢复退化的生态系统,这或许是不同盐碱化土壤深度开发利用的新思路[33]。本研究发现南疆四种盐生植物根际土壤真菌群落组成既具有相似性,也存在一定差异,表现为优势真菌菌群组成相似,但相对丰度各异,低丰度菌群组成也不同。四种植物虽然生长在同一盐碱地中,但根际土壤理化特性不同,根际微环境各异,形成了多样的真菌群落结构。这反映了根际真菌群落结构的宿主特异性,印证了不同植物对根际土壤微生物群落结构具有主动选择性[34-35]。即使在同一盐碱生境中,不同盐生植物也具有不同的根际微环境和真菌群落。

表3 优势真菌类群与土壤环境因子envfit函数检验
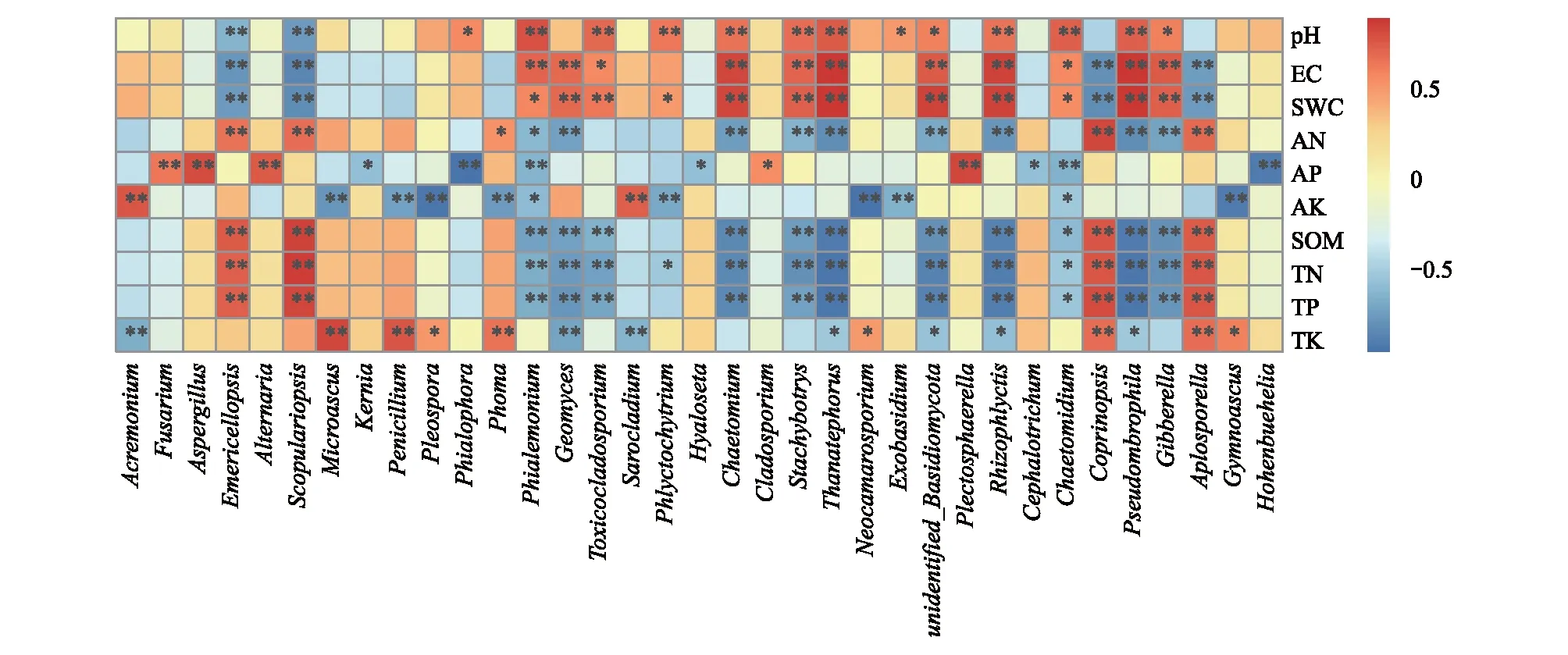
图8 属水平上物种丰富度与环境因子Spearman相关性分析Fig.8 Spearman correlation analysis of species richness and environmental factor at genus level“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)
四种盐生植物根际土壤真菌在门水平上的多样性并不丰富,仅注释到8门,且优势门只有3门,这可能与干旱区荒漠盐碱地贫瘠的土壤养分有关。子囊菌门在四种盐生植物根际土壤中占绝对主导地位,与高寒草甸、荒漠等生境相似[22-23, 36]。这与子囊菌门的生活习性有关,该门是目前真菌中数量最多的类群,主营腐生生活,是土壤中最重要的有机质分解者,在土壤养分循环方面起着重要作用[37]。就植物种类而言,子囊菌门在花花柴根际的相对丰度占比最高(94.8%),而在旱生芦苇根际占比相对较低(74.6%),这一方面与这两种植物的根际微环境有关,花花柴植株冠幅大,根系粗壮;而旱生芦苇根系呈匍匐状生长,须根少且光滑,进而导致两种植物根际土壤微环境和真菌群落结构差异。另一方面可能因为子囊菌门作为植物木质素最主要的分解者,偏好于木质素含量高的环境,旱生芦苇地上冠幅较小,所能形成的茎、叶和根的木质化残屑较少,且难以堆积在根际;而盐爪爪、黑果枸杞、花花柴植株相对冠幅大,形成的茎秆、碎叶等木质化残屑容易堆积的根部,进而被分解进入根际形成了一定的肥岛效应[38-39]。壶菌门主要分布在盐爪爪和旱生芦苇根际,在黑果枸杞和花花柴根际几乎没有分布,推测也与该门的生活习性有关。壶菌门是真菌界中唯一在生活史中可产生游动孢子的成员,多为水生,大多腐生在动植物残体上或寄生于水生植物上。旱生芦苇虽属旱芦,但根系十分发达,喜水且能借助根系吸取更多水分,近而营造出适宜该门真菌生长繁殖的根际微生境。
从属水平上看,镰孢菌属、支顶孢属和曲霉属是四种盐生植物根际土壤的共同优势菌属,但相对丰度上具有植物特异性。镰孢菌属在花花柴根际的相对丰度显著低于其它三种植物,但花花柴根际的支顶孢属和翅饱壳属丰度却显著高于其它植物,且以支顶孢属占绝对主导地位。菌群相对丰度表现出植物特异性,这可能与不同宿主植物的生长特性和根际微环境有关。植物通过茎、叶、根的凋落物以及根系分泌物向地下输送C物质,供根际微生物菌群分解利用,同时根际土壤微生物又通过感染根部形成共生关系(如菌根),或通过产生植物激素促进植物生长,或减少植物胁迫信号,从而与植物互作[40]。有研究显示,镰孢菌属通过产生木质纤维素酶对C的分解起作用,并与曲霉属共同参与土壤中难溶性磷的溶解,在促进植物对磷的吸收方面意义重大[41],曲霉属被大量报道属于嗜盐真菌,普遍分布于各类高盐环境中[42]。支顶孢属被认为是一类生防菌,对多种致病真菌有抑制作用,它作为花花柴根际土壤中的绝对优势真菌很可能与其根际病原真菌帚枝霉属丰度的大幅增加有关,而该属病原菌在其它植物根际的丰度极低。
不同植物的遗传背景和物质代谢过程造就了不同的根际微环境,影响微生物群落结构。从真菌群落与土壤理化因子的相关性看,土壤速效钾、速效磷、pH和电导率是影响四种盐生植物真菌群落分布的主要驱动因子。盐爪爪与旱生芦苇根际土壤pH和EC值较高,真菌群落丰富度和多样性指数也相对较高,推测土壤pH和EC可能是决定盐碱生境中植物根际真菌群落丰富度的关键因子。从四种盐生植物根际土壤真菌群落聚类分析结果看,盐爪爪和旱生芦苇共有的OTUs数量最多,而且壶菌门是它们的次优势菌门,但该门真菌在另外两种植物根际没有发现,表明土壤pH和EC不仅会影响盐生植物根际真菌群落丰富度,还会影响其多样性。镰孢菌属、曲霉属和链格孢属中很多具有解磷功能,能够分解土壤中的难溶性磷供植物吸收[41-42],它们作为黑果枸杞根际的主要优势菌属,与其根际土壤AP含量最高有直接对应关系。说明这些真菌有效溶解了黑果枸杞根际土壤中的难溶性磷,转化为可溶态,增加了其对磷的吸收利用。
ITS(Internal Transcribed Spacer)扩增子测序技术,具有传统真菌分类方法不可比拟的优势,已成为当前研究真菌群落多样性的首选之策。但就扩增子测序而言,对其结果准确性影响最大的因素是样品采集和基因组提取工作。本研究采取多点混合采样法得到每种植物4个重复样品,在一定程度上代表了样本的真实情况,但无法绝对准确代表样本。增加样品数量可以在一定意义上解决这一问题,但随之测序成本也会显著提高,因此需要在最经济的成本下确定样品数量。根际是植物根系-土壤界面数毫米区域内受植物根系影响最大,呈现独特的土壤理化和生物学特性且处于动态变化的土壤微域。目前运用较多的根际土壤获取方法一是抖落与根系结合松散的土壤后用无菌毛刷刷取紧贴根系的土壤;二是用缓冲液混合玻璃珠振荡以取得根际样品。两种方法各有利弊,须结合实际选用并不断改进。

