ARHI通过Wnt/自噬通路调控口腔鳞癌细胞凋亡的研究
李建豪,吕少华,李吉辰,朴松林
0 引言
口腔鳞癌(Oral squamous cell carcinoma,OSCC)是最常见的头颈部恶性肿瘤[1],约占全球人类癌症总数的1%~3%,在口、咽恶性肿瘤中约占90%,且发病率有逐年增高趋势[2]。OSCC中以舌鳞癌最多见,后者恶性程度高,严重威胁人类健康[3]。在过去的30年内,尽管早期诊断、诱导化疗、功能性手术及辅助放疗等对OSCC的治疗取得了长足的进步,但OSCC患者的5年生存率仍然维持在50.0%~55.0%[3-4]。因此,新的OSCC诊断标志物以及预后相关因子的发现尤为重要。
自噬是真核细胞主要的降解途径之一,属于程序性细胞死亡[5]。大量研究表明,自噬与肿瘤的发生发展密切相关[6-9]。
Aplasia-Ras同源物成员I(Aplasia ras homolog I,ARHI)又称DIRAS3,是与Ras相关的母体印迹肿瘤抑制基因,已有研究表明,ARHI在胶质瘤[10]、卵巢癌[11]、乳腺癌[12]以及OSCC[13]中低表达,但ARHI对OSCC生物学活性的作用以及潜在的作用机制有待研究。
本研究通过生物信息学、免疫组织化学、Western blot等方法,探讨ARHI在OSCC中的表达情况,验证ARHI能否通过Wnt信号通路调控OSCC细胞凋亡,诱导自噬,从而为OSCC的临床治疗提供实验参考。
1 材料与方法
1.1 材料 所有材料均选自2016-2019年于哈尔滨医科大学口腔医院行OSCC根治术的20例OSCC石蜡组织标本,并收集20例癌旁健康组织作为对照。鳞癌组织标本中男性10例,女性10例;高分化10例,中分化5例,低分化5例。患者年龄30~72岁,平均(48.0±8.5)岁。所有患者均未接受过术前放疗或化疗,且排除其他部位患有原发性癌症。所有材料均符合哈尔滨医科大学伦理委员会的规定,患者均签署知情同意书。
1.2 数据分析
1.2.1 数据来源 使用的OSCC数据集从美国国家生物技术信息中心(NCBI)基因表达综合总线(GEO)(www.ncbi.nlm.nih.gov/geo/)下载。原始基因表达谱从GSE9844和GSE75540数据集获得。使用R包affy和Annotate处理原始数据,制作表达矩阵并使探针与它们的基因符号匹配,R包sva用于组合和校正两个数据集。使用UALCAN数据库筛选ARHI在头颈部鳞癌中的表达。
1.2.2 差异基因的筛选 如果存在重复的基因,则采用平均值。随后使用微阵列数据线性模型(LIMMA)封装来筛选OSCC样品和对照样品之间的DEG。调整后的P值<0 .01和|对数倍数变化(FC)| > 1/2作为筛选标准。
1.2.3 共表达基因和富集分析 使用GEPIA数据库查找ARHI的共表达基因。随后,使用Metascape数据库富集ARHI的共表达基因。
1.3 所需试剂 ARHI过表达质粒(锐博生物,中国),ARHI、β-catenin、GSK-3β、Bcl-2、Caspase-3、LC3、Beclin-1以及β-actin(CST,美国),吖啶橙/溴化乙锭(AO/EB)(Solarbio Biotechnology,中国),mRFP-GFP-LC3腺病毒(汉恒生物,中国)。
1.4 细胞转染 ARHI过表达质粒购自锐博生物有限公司,使用专用的转染试剂转染ARHI 48 h后,检测不同过表达质粒的ARHI蛋白表达。
1.5 免疫组化分析 所有标本均用10%中性甲醛溶液浸泡固定,常规脱水后用石蜡包埋,切片机连续切片,切片厚度为4 μm,每5张去1张。进行免疫组化染色,ARHI抗原均采用免疫组化DAB 染色法,严格按照兔抗人ARHI单克隆抗体试剂盒说明书进行。然后使用DAB进行显色。经自来水洗涤、苏木精复染、乙醇脱水、二甲基苯透明后,将切片用树脂固定,置显微镜下观察。石蜡切片由我院2名病理学家在未知肿瘤级别的情况下进行双盲阅片。
1.6 Western blot分析 Western blot分析检测过表达ARHI后,CAL-27和SCC-115细胞中凋亡以及自噬相关蛋白的变化。将含有蛋白酶抑制剂以及细胞裂解液(1∶50)加入转染后的细胞中,通过BCA(碧云天,中国)检测蛋白浓度。在80 V电压下恒压电泳1.5 h后,200 mA恒流转印2 h,之后在5%脱脂牛奶室温封闭2 h,然后将转印好的硝酸纤维素膜与相应的一抗(β-catenin、GSK-3β、Bcl-2、Caspase-3、LC3、Beclin-1以及β-actin)在相宜的浓度下进行结合,然后置于4 ℃摇床中孵育过夜。清洗硝酸纤维素膜后,用阳离子化辣根过氧化物酶(CHRP)结合二级抗体(山羊抗兔1∶2 000,中国中山金桥)孵育1 h。然后在紫外光下显影,用图像分析系统检查。
1.7 吖啶橙/溴化乙锭荧光染色 分别将过表达ARHI以及其对照转染于CAL-27和SCC-115细胞中48 h。随后将细胞与吖啶橙/溴化乙锭(AO/EB)(Solarbio biotechnology,China)按1∶1的比例培养5 min。采用以下公式计算凋亡细胞百分比:凋亡率(%)=凋亡细胞数/计数细胞总数×100%。
1.8 免疫荧光检测细胞自噬 将过表达ARHI以及ARHI对照组分别转染到CAL-27和SCC-115细胞中,然后感染mRFP-GFP-LC3腺病毒。12 h后更换培养基,24 h后采集荧光图像。GFP和mRFP荧光共定位,表明一个小室没有与溶酶体融合;没有GFP的mRFP信号表明一个小室已经与溶酶体融合。
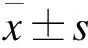
2 结果
2.1 ARHI基因在头颈部鳞癌中的表达 通过GEPIA数据库,头颈部鳞癌患者组织的ARHI mRNA表达谱结果显示,与健康样本相比,ARHI在头颈部鳞癌患者中表达降低(P=0.038)(图1A)。UALCAN数据库检测头颈部鳞癌患者不同亚组分析数据集,证明头颈部鳞癌患者组织与正常样本相比,ARHI的表达明显降低(图1B)。在头颈部鳞癌患者中,不同病理学分级、年龄、种族以及肿瘤分期的ARHI基因具有差异表达(图1C-1F)。不同人种中不同ARHI表达水平的头颈部鳞癌患者的生存时间也不相同(P=0.047,图2),这些结果表明,ARHI参与了头颈部鳞癌的恶性进展,影响患者生存。

图2 UALCAN数据库比较不同人种、不同ARHI表达水平的头颈部鳞癌患者的Kaplan-Meier生存曲线
2.2 ARHI基因在OSCC中低表达 利用整合表达谱(GSE9844和GSE75540)对OSCC癌和癌旁组织进行比较,筛选出68个差异基因。通过在P值和FC之间绘制DEG来构造“火山图”。芯片图中显示了差异基因表达的热图。结果显示,ARHI基因表达降低(图3A)。同时,与癌旁组织相比,OSCC癌组织中的ARHI基因表达显著降低(P=0.027,图3B)。20例免疫组化结果显示,ARHI在OSCC中表达降低(P=0.035,图3C)。

图3 ARHI在OSCC组织中的表达注:A.整合GSE75540以及GSE9844芯片数据后的热图;B.ARHI在OSCC中的mRNA表达;C.ARHI在OSCC患者组织中蛋白表达(免疫组化)。*与对照组比较,P<0.05
2.3 过表达ARHI抑制OSCC细胞增殖活性并诱导细胞凋亡 过表达ARIⅡ后,在CAL-27以及SCC-115细胞中ARHI明显升高(P=0.042,图4A)细胞增殖活性明显降低(P=0.035,图4B),而空质粒组的细胞增殖活性相对于正常组没有任何改变(P=0.083,图4B)。相对于正常对照组,过表达ARHI组的细胞凋亡率明显升高(P=0.027,图4C)。过表达ARHI能够明显使Bax蛋白升高(P=0.035,图4D),同时Cleaved-caspae-3/Caspae-3的表达也升高(P=0.029,图4D)。以上结果表明,OSCC细胞中过表达ARHI能够抑制细胞增殖活性,诱导凋亡。
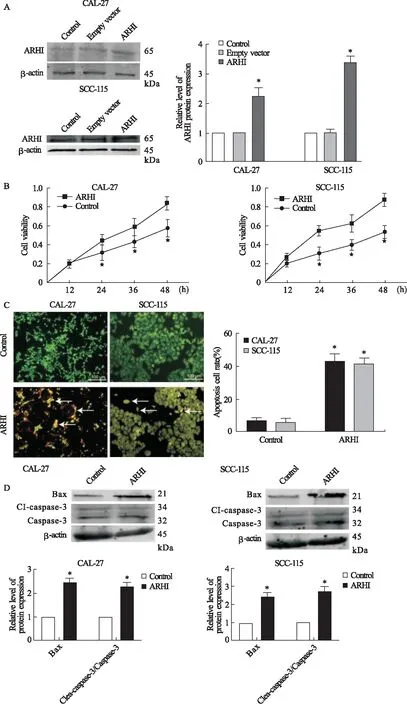
图4 过表达ARHI对于口腔鳞癌细胞增殖活性的影响注:A.Western blot 检测过表达ARHI后CAL-27、SCC-115细胞中ARHI蛋白的表达;B.CCK-8检测过表达ARHI后CAL-27、SCC-115细胞的增殖活性变化;C.AO/EB检测过表达ARHI后,CAL-27以及SCC-115细胞凋亡的变化;D.过表达ARHI后CAL-27、SCC-115细胞中Bax蛋白及 Cleaved-caspase-3/Caspase-3的表达。*与对照组比较,P<0.05
2.4 OSCC细胞中过表达ARHI对于Wnt信号通路的影响 在GEPIA数据库中找到了200个ARHI共表达基因,使用Metascape进行富集分析,发现这些途径主要集中在叶酸生物合成、Wnt信号转导、小分子转运和翻译后蛋白磷酸化(图5A)。而Wnt 信号通路是参与OSCC恶性进展的经典通路之一。为了进一步探讨Wnt 信号通路在ARHI参与OSCC恶性进展中的作用,我们检测了过表达ARHI后Wnt信号通路的经典蛋白GSK-3β以及β-catenin的变化,发现过表达ARHI后,GSK-3β的蛋白表达上调(P=0.035,图5 B),且β-catenin蛋白表达明显降低(P=0.031,图5 C)。以上结果表明,过表达ARHI后能够调控Wnt 信号通路,进而诱导OSCC细胞凋亡。

图5 过表达ARHI对CAL-27以及SCC-115细胞中Wnt信号通路的影响注:A.ARHI在OSCC中可能的作用通路;B.过表达ARHI后CAL-27以及SCC-115细胞中GSK-3β蛋白的变化;C.过表达ARHI后CAL-27以及SCC-115细胞中β-catenin蛋白的变化。*与对照组比较,P<0.05
2.5 OSCC细胞中过表达ARHI促进细胞自噬 为了进一步确定过表达ARHI诱导OSCC细胞凋亡的途经,我们通过透射电镜检测了CAL-27以及SCC-115细胞中自噬小体的变化。结果显示,相对于正常组,过表达ARHI后,CAL-27以及SCC-115细胞中自噬小体数量明显增多(P=0.043,图6A)。采用免疫荧光法检测LC3在过表达ARHI后的变化,结果显示,相对于正常对照组,LC3表达明显增多(P=0.044,图6B)。随后,通过Western blot方法检测CAL-27以及SCC-115细胞中自噬相关蛋白的变化,结果显示,过表达ARHI后,能够使Beclin-1及LC3II/I表达升高(P=0.031,P=0.042,图6C)。以上结果表明,自噬参与了过表达ARHI诱导OSCC细胞凋亡。
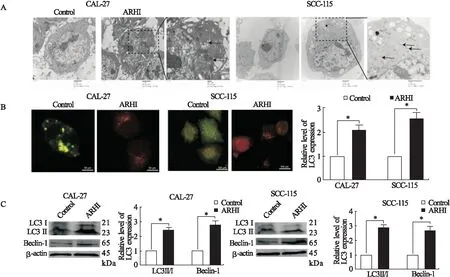
图6 过表达ARHI对CAL-27、SCC-115细胞中自噬相关因子的影响注:A.透射电镜显示自噬小体;B.免疫荧光显示LC3表达;C.自噬相关蛋白LC3II/I以及Beclin-1的表达
3 讨论
越来越多的研究发现,ARHI在多种恶性肿瘤中异常表达[13]。然而,ARHI在OSCC中的作用尚未明确。本研究首先通过GEPIA以及UALCAN数据库证明了ARHI在头颈部鳞癌中低表达,同时,通过整合GEO芯片数据,发现ARHI在OSCC中低表达,且免疫组化结果进一步证明了ARHI在OSCC中低表达。通过分子生物学方法,过表达ARHI能够调控Wnt信号通路经典蛋白,进而使细胞自噬增加,诱导OSCC细胞凋亡,提示ARHI可能是治疗OSCC的新靶点。
细胞凋亡和自噬是两个重要的过程,在生理和病理上维持细胞内稳态,两条通路之间可能发生串扰。以往的研究表明,细胞的自噬可以通过消除潜在毒性大分子和受损细胞器进而参与细胞活性的调控[14]。此外,一些自噬与OSCC的研究发现,OSCC细胞自噬能够诱导其细胞凋亡[8-9,15]。本研究中,我们发现ARHI在OSCC组织中低表达,且影响OSCC患者的生存期。而细胞凋亡与肿瘤恶性进展密切相关[16]。随后我们的实验结果表明,过表达ARHI后,在CAL-27以及SCC-115细胞中观察到自噬现象,包括自噬小体增多、LC3II/I的表达升高、Beclin-1的表达水平增加。本研究的结果表明,过表达ARHI可能通过促进OSCC细胞自噬导致细胞凋亡。此前,Wei等[17]曾报道Genipin通过PI3K/AKT/mTOR途径诱导OSCC细胞自噬和抑制细胞生长。同时,Chen等[18]证明Erianin诱导OSCC细胞凋亡和自噬。这也进一步印证了我们之前的结果。因此,ARHI在癌细胞的生物学功能依赖细胞自噬。进一步研究结果表明,ARHI在OSCC中是通过促进OSCC细胞自噬,进而发挥多种生物学功能的。
Wnt信号通路在OSCC的恶性进展中发挥着重要作用[19],并且参与调控细胞自噬[20]。本实验结果表明,过表达ARHI后,能够使细胞自噬增加,诱导细胞凋亡。目前,ARHI促进细胞自噬进而诱导细胞凋亡的机制尚不明确。本研究结果显示,过表达ARHI后,Wnt信号通路中经典蛋白β-catenin蛋白表达下调,且GSK-3β蛋白表达上调,说明Wnt信号通路在ARHI诱导细胞凋亡时被调控。这一结果与Li等[21]的报道相一致:LRP6通过Wnt/β-catenin途径调节Rab7介导的自噬调节滋养层细胞的迁移和侵袭。以上结果表明,ARHI通过调控Wnt信号通路,进而影响细胞自噬,参与过表达ARHI后OSCC细胞凋亡。本研究虽然证明了Wnt信号通路参与了ARHI诱导OSCC细胞凋亡,然而,其作用机制尚不明确,有待开展后续研究。
综上,本研究表明,ARHI可能作为口腔鳞癌细胞的抑癌基因,通过调控Wnt信号通路相关蛋白,进而加速细胞自噬,诱导细胞凋亡。而过表达ARHI基因抑制了细胞的增殖活性,并提高了诱导细胞凋亡的能力。在未来的研究中,我们将着重研究ARHI在OSCC侵袭迁移以及动物模型中的作用,为ARHI在OSCC中的作用提供更多的实验数据支持。

