α-倒捻子素对奶牛乳房炎源性金黄色葡萄球菌诱导奶牛乳腺上皮细胞促炎反应的抑制作用
傅业全 , 侯晓林 , 崔德凤 , 胡 格 , 王建舫 , 刘 洋 , 韩 博
(1.中国农业大学动物医学院,北京 海淀 100193; 2.北京农学院动物科学技术学院,北京 昌平 102206)
奶牛乳房炎是危害奶牛行业的世界性难题,全球范围内每年因此造成巨大的经济损失。该病是由多种因素引起的奶牛乳腺组织炎症,其主要原因是病原微生物的入侵[1]。金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是引起奶牛乳房炎的主要致病菌之一[2],尤其是隐性奶牛乳房炎。由于金黄色葡萄球菌具有能够产生多种毒力因子、易产生耐药性以及侵入奶牛乳腺上皮细胞(bMECs)逃避抗生素的作用等特点,使得金黄色葡萄球菌性奶牛乳房炎的防治更加困难,找寻合适的药物成为防控金黄色葡萄球菌性奶牛乳房炎的关键。
山竹是一种分布在东南亚国家及我国的广西壮族自治区和海南、福建、台湾等省的热带水果,其营养成分丰富,有“水果皇后”之称。在泰国等地山竹果皮一直作为传统医药被长期应用,主要用来治疗皮肤感染、腹泻、痢疾、霍乱、慢性溃疡等疾病。山竹果皮中含有多种药物活性成分,主要包括α-倒捻子素、β-倒捻子素和γ-倒捻子素。研究表明,α-倒捻子素具有抗炎、抗菌、抗癌、抗氧化等多种功效[3-4]。α-倒捻子素虽然在人类医学中表现出多种生物活性与药理作用,但在畜禽方面的报道甚少,更未见其对奶牛乳房炎作用的相关报道,为此本试验借助金黄色葡萄球菌感染bMECs,研究α-倒捻子素对奶牛乳房炎源性金黄色葡萄球菌引起bMECs的炎性反应的影响,以期为防治奶牛乳房炎提供参考。
1 材料与方法
1.1 试验材料 bMECs细胞系(MAC-T)和金黄色葡萄球菌临床分离株均由中国农业大学动物医学院兽医内科学实验室提供。
1.2 试验分组 试验分为对照组(Control,C)和试验组。其中对照组为未进行任何处理的bMECs;试验组分为金黄色葡萄球菌组(S)、α-倒捻子素低、中和高浓度组,分别用金黄色葡萄球菌和终浓度为0、0.4、0.8 μg/mL和1.6 μg/mL的α-倒捻子素对bMECs进行处理。
1.3 仪器设备 CO2恒温培养箱(日本SANYO);超净工作台(泰斯特仪器有限公司);倒置显微镜(日本奥林巴斯);Real-time PCR System(美国Applied Biosystem公司);低速离心机(湖南湘仪);高速离心机(美国Sigma公司);移液器(德国Eppendorf公司)。
1.4 试验试剂和耗材 DMEM/F12培养液(美国Gibco公司);胎牛血清(FBS,美国Gibco公司);青链霉素合剂(100×,北京索莱宝科技有限公司);CCK-8试剂盒(碧云天生物技术有限公司);RNAprep Pure细胞总RNA提取试剂盒(碧云天生物技术有限公司);Quant cDNA 第1链合成试剂盒;SuperReal PreMix Plus(SYBR Green,碧云天生物技术有限公司);细胞培养板(美国康宁公司);α-倒捻子素标准品(北京索莱宝科技有限公司);肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)、白细胞介素-1β (Interleukin-1β, IL-1β)、白细胞介素-6 (Interleukin-6, IL-6) ELISA试剂盒(上海仁捷生物科技有限公司);NF-κB p65相关抗体(北京博奥森生物技术有限公司)。
1.5 试验方法
1.5.1 bMECs的复苏和准备 冻存的bMECs迅速解冻后,用DMEM/F12完全培养基(含10% FBS、1%双抗)悬浮细胞,然后接种于25 cm2培养瓶中,放于细胞培养箱(37 ℃、5% CO2)中进行培养,至细胞汇合后进行常规传代。传代24 h后接种至细胞培养板进行试验。
1.5.2 金黄色葡萄球菌的培养 冻存的菌种融化后,用细菌接种环挑取适量菌液在MHA平板上划线,将平板置于37 ℃生化培养箱中培养,24 h后可见平板培养基表面出现边缘光滑、透明的单个菌落。挑取单个菌落接种于MHB培养基中,于37 ℃恒温摇床中培养18 h左右,测定OD600值为1.0时停止培养。使用无菌PBS(pH 7.4)对上述金黄色葡萄球菌培养物进行倍比稀释后,取各稀释后的菌悬液涂于TSA培养基平板上,进行菌落计数。金黄色葡萄球菌培养物保存于4 ℃冰箱中,用于后续试验。
1.5.3 α-倒捻子素对金黄色葡萄球菌的最低抑菌浓度(MIC)测定 按照美国临床和实验室标准协会(Clinical & Laboratory Standards Institute,CLSI)标准采用微量肉汤稀释法测定MIC,质控菌选择金黄色葡萄球菌ATCC29213标准株。在96孔板上进行操作,每孔终体积为200 μL,第1孔加入α-倒捻子素的体积为20 μL。采用倍比稀释的方法使第1~10孔中的α-倒捻子素的终浓度依次为51.2、25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2 μg/mL和0.1 μg/mL,在每排前10孔各加入稀释后的菌液100 μL(1×105CFU/mL)。第11孔加入200 μL MHB肉汤作为阴性对照,第12孔加入200 μL稀释后的菌液作为阳性对照。试验设5个重复。
1.5.4 α-倒捻子素对bMECs增殖的影响 将bMECs按1×104个/孔接种于96孔细胞培养板中,培养至细胞融合后,弃去培养液,加入含不同质量浓度的α-倒捻子素(0、0.4、0.8、1.6、3.2、6.4、12.8 μg/mL和25.6 μg/mL)的培养液培养24 h,然后每孔加入10 μL 的CCK-8溶液,37 ℃继续孵育2 h,用酶标仪在450 nm波长处检测光密度值。
1.5.5 α-倒捻子素对金黄色葡萄球菌侵入bMECs的影响 将bMECs按5×105个/孔接种于6孔细胞培养板,培养12~16 h后弃掉上清液,PBS洗涤3次后更换DMEM/F12不完全培养基(含1%FBS,不含双抗)培养2 h,2 h后按感染复数(MOI)(细菌∶细胞)=100分别加入准备好的金黄色葡萄球菌悬液和终浓度为0、0.4、0.8 μg/mL和1.6 μg/mL的α-倒捻子素,37 ℃继续孵育3 h,然后弃掉细胞培养液并用PBS洗涤3次,每孔加入1 mL 含100 μg/mL庆大霉素的DMEM/F12培养液继续孵育2 h,以杀死胞外黏附的金黄色葡萄球菌。用PBS洗涤3次,加浓度为0.25%的胰蛋白酶消化细胞,再加0.1% TritonX-100作用10~15 min裂解细胞,收集细胞裂解液,使用无菌PBS对裂解液进行倍比稀释后,取各稀释度涂布于TSA平板上,置37 ℃恒温培养箱培养18~24 h后计数,每组设3个重复,计算入侵指数。入侵指数=入侵的细菌总数/金黄色葡萄球菌组的入侵细菌数。
1.5.6 α-倒捻子素对金黄色葡萄球菌感染bMECs的TNF-α、IL-1β、IL-6 mRNA表达的影响 用金黄色葡萄球菌和α-倒捻子素按1.5.5方法处理3 h,用PBS洗涤3次,用浓度为0.25%的胰蛋白酶消化细胞,收集细胞悬液至离心管中1 200 r/min离心5 min, 吸净上清,收集细胞沉淀。按RNAprep Pure细胞总RNA提取试剂盒说明书提取细胞RNA,然后按照Quant cDNA 第1链合成试剂盒要求转录合成cDNA。qPCR反应条件:95 ℃预变性15 min,1个 循环;95 ℃变性10 s,58 ℃延伸20 s,72 ℃退火30 s,40个循环。基因的引物序列见表1,由生工生物工程(北京)股份有限公司合成。采用β-actin基因作为内参基因[5]。目的基因的相对表达量采用2-ΔΔCt表示。

表1 RT-PCR引物Table 1 Real-time PCR primers
1.5.7 α-倒捻子素对金黄色葡萄球菌感染bMECs的TNF-α、IL-1β、IL-6炎性因子的影响 按1.5.5方法用金黄色葡萄球菌和α-倒捻子素处理bMECs 3 h,收集细胞培养上清液,3 000 r/min离心10 min。取上清按ELISA试剂盒说明书测定TNF-α、IL-1β、IL-6 蛋白的表达水平。
1.5.8 α-倒捻子素对金黄色葡萄球菌感染bMECs的NF-κB蛋白p-p65表达的影响 按1.5.5方法用金黄色葡萄球菌和α-倒捻子素处理bMECs 3 h,吸弃培养液,用PBS洗涤3次,加浓度为0.25%的胰蛋白酶消化细胞,然后加入含有血清的培养基失活胰蛋白酶,收集细胞悬液至离心管中1 200 r/min离心5 min,吸净上清,收集细胞沉淀。按BCA蛋白提取试剂盒要求提取蛋白,应用Western Blot方法进行分析检测。使用 Image J软件对Western Blot检测样品条带进行灰度值分析,以磷酸化NF-κB p65/β-actin条带灰度值比值反映NF-κB信号通路的活化水平。
1.6 数据处理 试验数据用平均值±标准差表示,采用GraphPad Prism 8分析数据并作图,用方差分析进行组间比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 α-倒捻子素对金黄色葡萄球菌的MIC 将96孔板置于恒温培养箱于37 ℃孵育24 h后,读取结果,阴性孔呈清亮,阳性孔呈浑浊,抑制金黄色葡萄球菌生长的最低药物浓度为1.6 μg/mL。
2.2 α-倒捻子素对bMECs增殖的影响 用含不同终浓度的α-倒捻子素培养液培养bMECs,通过CCK-8试剂盒法检测α-倒捻子素对bMECs增殖的影响。结果如图1所示,α-倒捻子素在0.4~3.2 μg/mL 浓度范围对bMECs的增殖没有明显的影响(P>0.05),在浓度为6.4 μg/mL时细胞增殖受到抑制(P>0.05),在浓度为12.8 μg/mL和25.6 μg/mL 时细胞活力显著下降(P<0.01)。因此,选择终浓度为0.4、0.8 μg/mL和1.6 μg/mL的α-倒捻子素用于后续试验。

图1 α-倒捻子素对bMECs增殖的影响Fig.1 Effect of α-mangostin on viability of bMECs**:与0 μg/mL相比,差异极显著(P<0.01)**:Significant difference comparing with 0 μg/mL (P<0.01)
2.3 α-倒捻子素对金黄色葡萄球菌侵入bMECs的影响 结果如图2所示,低、中和高3个浓度组的α-倒捻子素均能显著抑制金黄色葡萄球菌对bMECs的侵入(P<0.01)。其中中浓度组对S.aureus入侵bMECs的抑制作用弱于另外2个浓度组,但仍然具有统计学意义(P<0.01)。
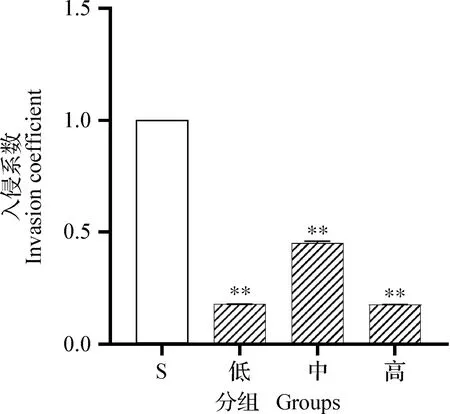
图2 α-倒捻子素对S. aureus侵入bMECs的影响Fig.2 Effect of α-mangostin on invasion of S.aureus into bMECs**:与金黄色葡萄球菌组(S)相比,差异极显著(P<0.01)**:Significant difference comparing with S.aureus group (S)(P<0.01)
2.4 α-倒捻子素对金黄色葡萄球菌感染bMECs的TNF-α、IL-1β和IL-6 mRNA表达的影响 结果如图3所示, 与对照组相比,S.aureus感染3 h后显著提升bMECs中TNF-α、IL-1β和IL-6 mRNA的转录水平(P<0.01)。同时,低、中和高3个浓度组的α-倒捻子素均能够显著抑制由金黄色葡萄球菌感染导致bMECs的3种促炎性细胞因子转录水平的上调(P<0.01), 且TNF-α、IL-1βmRNA的转录水平分别与α-倒捻子素呈浓度依赖关系。
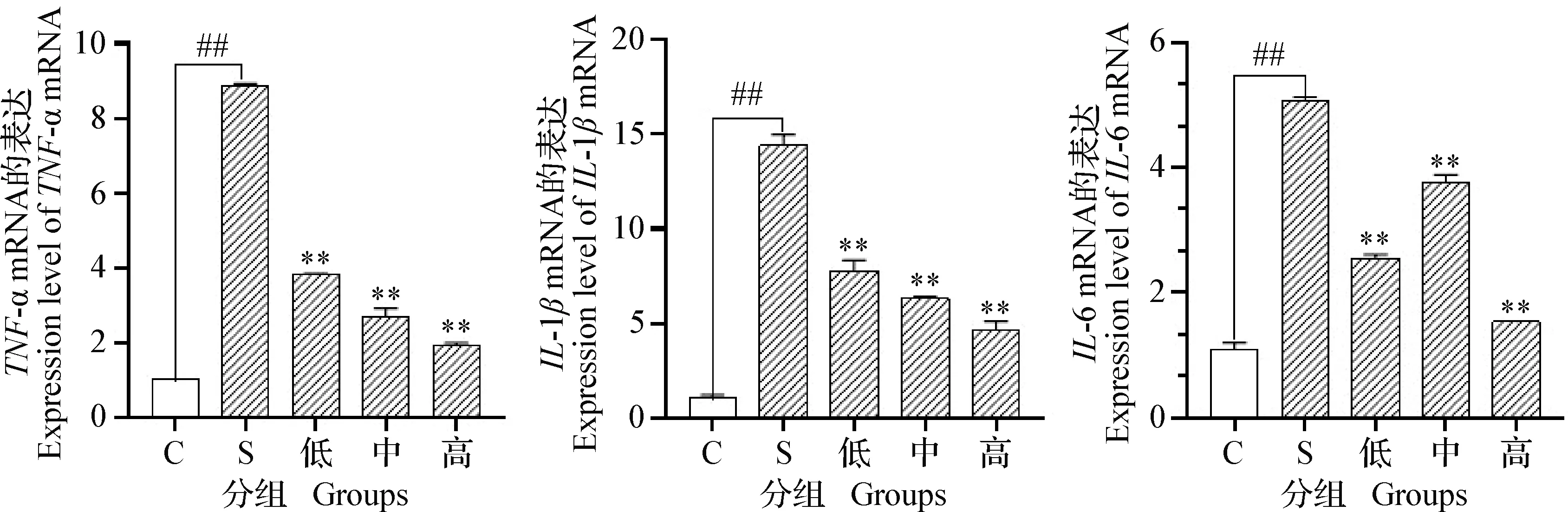
图3 α-倒捻子素对TNF-α、IL-1β、IL-6 mRNA表达的影响Fig.3 Effect of α-mangostin on expression levels of TNF-α、IL-1β、IL-6 mRNA ##:金黄色葡萄球菌组(S)与对照组(C)相比,差异极显著(P<0.01); **:与金黄色葡萄球菌组(S)比较,差异极显著(P<0.01);下图同##:Significant difference between S.aureus group (S) and control group (C) (P<0.01);**:Significant difference comparing with S.aureus group(S) (P<0.01). The same as below
2.5 α-倒捻子素对金黄色葡萄球菌感染bMECs的TNF-α、IL-1β和IL-6炎性因子水平的影响 结果如图4所示,与对照组比较,S.aureus感染bMECs 3 h后显著提升培养上清中TNF-α、IL-1β和IL-6 蛋白表达水平(P<0.01)。同时,低、中和高3个浓度组的α-倒捻子素均能够显著抑制bMECs由于金黄色葡萄球菌感染所致的3种促炎性细胞因子转录水平的上调(P<0.01),且TNF-α、IL-1β 蛋白表达水平分别与α-倒捻子素呈浓度依赖关系。

图4 α 倒捻子素对TNF-α、IL-1β、IL-6蛋白表达的影响Fig.4 Effect of α-mangostin on expression levels of TNF-α, IL-1β, IL-6 protein
2.6 α-倒捻子素对金黄色葡萄球菌感染bMECs的NF-κB p-p65蛋白表达的影响 结果如图5所示,在金黄色葡萄球菌感染bMECs 3 h后,金黄色葡萄球菌组的bMECs中NF-κB p65蛋白的磷酸化水平显著高于对照组细胞(P<0.01)。同时,低浓度组和高浓度组的α-倒捻子素能够显著抑制NF-κB p65蛋白的磷酸化水平(P<0.01)。但是,中浓度组的bMECs的NF-κB p65蛋白的磷酸化水平平均值略低于金黄色葡萄球菌组,二者差异不显著(P>0.05)。
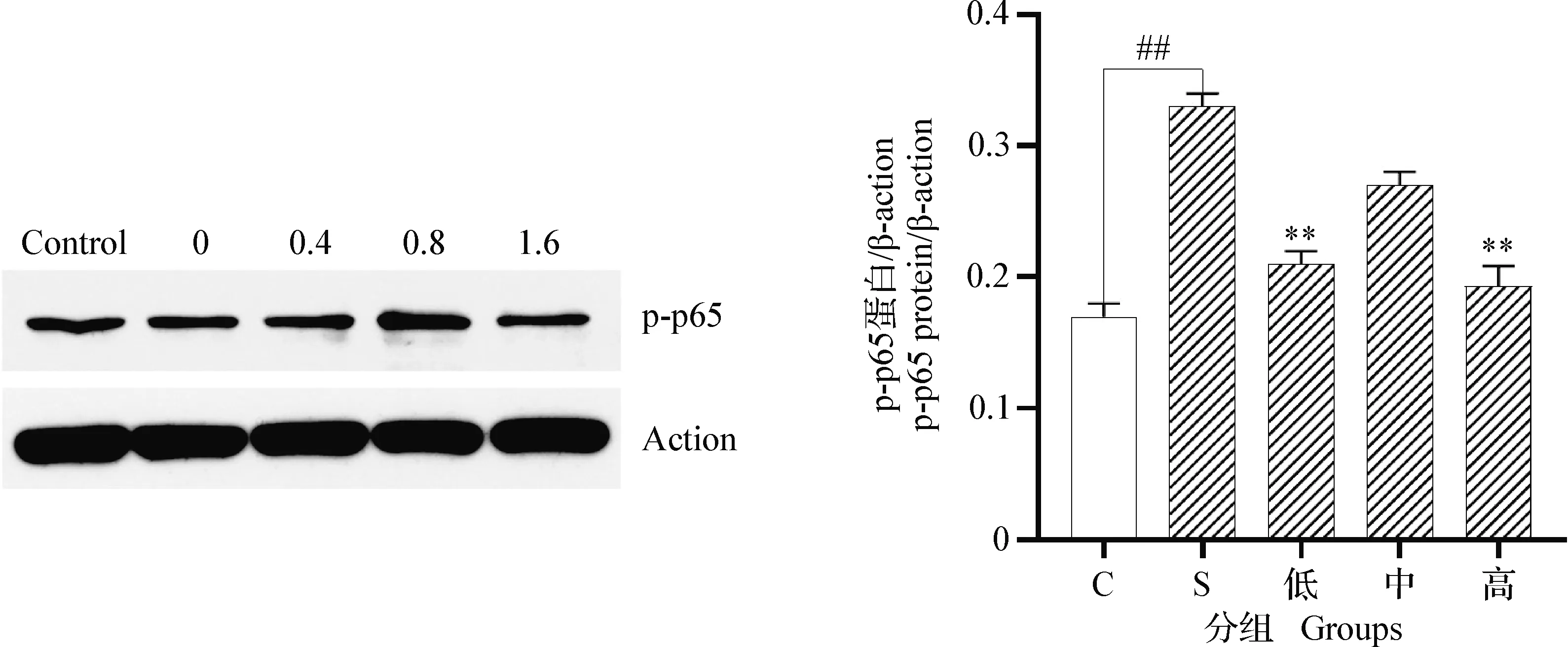
图5 α-倒捻子素对NF-κB p-p65蛋白表达量的影响Fig.5 Effect of α-mangostin on expression levels of NF-κB p-p65 protein
3 讨论
3.1 α-倒捻子素对金黄色葡萄球菌的MIC 本试验通过微量肉汤稀释法测得α-倒捻子素对金黄色葡萄球菌的MIC为1.6 μg/mL,这一结果与Koh等和李干龙的研究结果接近(0.78~1.56 μg/mL)[6-7],说明α-倒 捻子素对奶牛乳房炎源性金黄色葡萄球菌有较强的抗菌作用。
3.2 α-倒捻子素对bMECs增殖的影响 本试验中,α-倒捻子素终浓度为0~3.2 μg/mL时,对bMECs的增殖未见明显的抑制作用。但浓度在6.4 μg/mL 时抑制了bMECs的增殖,当浓度达到12.8 μg/mL时呈现出较强的细胞毒性作用(P<0.01),这与周孝君的研究结果相一致[8],说明α-倒捻子素对bMECs的毒性较强,在试验和应用时需谨慎,所以后续试验选择了0~1.6 μg/mL作为研究剂量,以减少细胞毒性对结果的影响。若能降低其细胞毒性,其应用前景将十分广阔。如邹汉勋以α-倒 捻子素为母核,在α-倒捻子素两端加入阳离子,模拟抗菌多肽的结构和功能,极大地减弱了其细胞毒性,显著提高其对细菌的抗菌活性,具有很好的生物选择性[9]。
3.3 α-倒捻子素对金黄色葡萄球菌侵入bMECs的影响 金黄色葡萄球菌是引起奶牛乳房炎的重要传染性病原菌,对宿主细胞的侵袭是其持续感染的关键所在[10]。本试验中低浓度组和高浓度组的α-倒 捻子素均显著抑制金黄色葡萄球菌的入侵,说明α-倒捻子素具有预防金黄色葡萄球菌感染的作用,但中浓度组的α-倒捻子素抑制入侵效果减弱,其具体的原因需深入探讨。
3.4 α-倒捻子素对金黄色葡萄球菌感染bMECs炎性反应的影响 bMECs作为抵御病原微生物入侵的第一道屏障,除具有泌乳功能外,还参与先天性和获得性免疫反应,在保护乳腺组织方面发挥作用[11]。当金黄色葡萄球菌侵入奶牛乳腺组织并引发乳房炎时,bMECs能够合成和分泌多种免疫活性物质,如IL-6、IL-1β、IL-8以及TNF-α等[11]。在本试验中,金黄色葡萄球菌侵染bMECs 3 h,3种炎性因子TNF-α、IL-1β和IL-6 mRNA表达和分泌升高,表明金黄色葡萄球菌引起bMECs炎性反应。低、中和高3个浓度组的α-倒捻子素能够明显降低炎性基因的表达和炎性因子的分泌,TNF-α和IL-1β的转录和蛋白表达分别与α-倒捻子素呈浓度依赖关系。α-倒捻子素在本试验中表现出抗炎作用,NF-κB信号通路p-p65蛋白的检测结果也支持这一观点,但NF-κB信号通路的活化是否是α-倒捻子素的直接作用有待进一步研究。Supinya等[12]研究显示,α-倒捻子素对LPS诱导RAW264.7细胞释放NO、PGE2、TNF-α和IL-4具有抑制作用。Bumrungpert等[13]发现,α-倒捻子素和γ-倒捻子素能够降低炎性基因TNF-α、IL-6以及MCP-1的表达来抑制LPS引起的脂肪细胞炎性反应。Shen等[14]发现,α-倒捻子素能够抑制炎症反应和氧化损伤来保护脂肪细胞,其机制可能是通过激活Nrf2信号通路实现的。Liu等[15]研究α-倒捻子素对LPS介导的人骨髓白血病细胞系U937细胞的抗炎效果发现,α-倒捻子素通过下调EIK-1、MMK3/MMK6和MAP-KAPK-2的磷酸化水平,抑制MAPK信号传导通路,从而发挥抗炎作用;同时也抑制TNF-α和IL-4的产生并且存在剂量依赖关系,说明α-倒捻子素通过MAPK和NF-кB 信号通路发挥抗炎效果。在本试验中,中浓度组的α-倒捻子素在抵御金黄色葡萄球菌入侵、IL-6 mRNA表达和蛋白分泌等方面均与其他剂量组有差异,推测该浓度的α-倒捻子素启动了炎性通路的某一环节。α-倒捻子素抗菌的作用机理之一是其作用于细胞膜,引起细胞膜的流动性、膜两侧电荷和离子通道改变,诱发Ca2+浓度的变化,导致细胞功能的改变[7,16-17]。陈建军等[18]研究发现,低、中、高浓度钙离子对炎症因子IL-6的影响差异较大,低浓度组降低血清IL-6的水平,中浓度组对血清IL-6的水平几乎无影响,而高浓度组提高血清IL-6的水平。但是低高浓度组出现了异常血钙并发症,而中浓度组未出现,说明钙离子与炎症通路之间存在某种联系。唐亚等[19]、王清华等[20]和周仁鹏[21]均证实炎症因子与离子通道之间存在一定的关联性。因此推测本试验中中浓度组的α-倒捻子素表现出了与其他剂量不同的趋势,可能有如下原因:(1)该浓度的α-倒捻子素很可能激活细胞膜相关的离子通道,使离子浓度发生改变,进而影响炎症通路介导炎症反应,影响IL-6的水平;(2)该浓度的α-倒捻子素作用于细胞膜,引起细胞流动性改变,暴露膜受体并与之结合,进而影响IL-6的水平。
综上所述,α-倒捻子素对奶牛乳房炎源性金黄色葡萄球菌有较强的抗菌作用,能显著抑制奶牛乳房炎源性金黄色葡萄球菌对bMECs的侵袭,进而引起bMECs 中TNF-α、IL-1β和IL-6 mRNA转录和蛋白表达水平改变,抑制炎性反应,其抗炎的分子机理可能与NF-κB信号通路相关。

