人参修复表皮损伤功效组分的筛选及作用研究
李贞卓,姜锐,刘建增,徐晓浩,赵大庆※
(1.长春中医药大学,吉林长春130021;2.长春中医药大学附属医院,吉林长春130021)
皮肤是人体自身的天然屏障系统,皮肤的最外层表皮层可保护机体内部免受紫外线辐射、化学物质威胁和微生物病原体感染等侵害,防止水分从体内流失,维持体内代谢平衡。当皮肤受到外界紫外线辐射等刺激时,其表皮屏障保护功能会下降,从而导致严重的亚健康状态或皮肤疾病,如干性皮肤、特应性皮炎和鱼鳞病等[1,2],因此,寻找安全、高效的天然表皮损伤修复剂对于修复表皮结构功能障碍具有重要的临床意义,是治疗皮肤疾病及亚健康皮肤的重中之重。
紫外线是导致皮肤损伤的主要外在因素。紫外线照射后,参与表皮角化包膜形成的主要蛋白丝聚蛋白(Filaggrin,FLG)的表达显著降低导致表皮结构受损,进一步破坏负责表皮水分及溶质运输的水通道蛋白3(Aquaporin-3,AQP3)的表达,加剧了表皮损伤引起的皮肤干燥脱水、红肿及过敏等症状[3]。已有研究表明,中药可用于保护皮肤的表皮结构功能,并且会提高补水锁水因子的表达[4,5]。本研究选用传统名贵中药人参(Panax ginseng C.A.Meyer),其为五加科植物,常用入药部位为其干燥的植物根和根茎。众所周知,人参被认为是一种潜在的治疗剂,可促进伤口愈合,减少皮肤炎症,抑制黑色素生成[6,7]。但对人参中具有表皮损伤修复作用的功效成分的研究鲜有报道。本研究以FLG和AQP3蛋白表达为检测指标,建立了UVB诱导的HaCaT细胞损伤模型,利用此模型筛选出了具有表皮损伤修复功效的人参组分,并采用UVB诱导的无毛小鼠动物皮肤损伤模型进一步明确其改善UVB诱导表皮损伤作用。
1 材料和方法
1.1 实验试剂与仪器
人表皮角质形成细胞(HaCaT)购自上海富衡生物科技有限公司;用于蛋白免疫印迹实验的FLG抗体和增强型化学发光试剂购自美国Santa Cruz Biotechnology公司;用于组织免疫荧光实验的FLG抗体购自上海爱必信生物科技有限公司;AQP3抗体购自美国Abcam公司;BCA蛋白检测试剂盒购自江苏碧云天生物技术公司;FITC标记的山羊抗兔抗体购自武汉博士德生物工程有限公司;DAPI购自美国Sigma公司;酶标仪购自美国Thermo公司;FluorChem HD2化学发光成像系统购自美国Protein Simple公司;UV交联系统购自美国Hoefer Scientific Instruments公司;Cutometer®dual MPA 580测试仪购自德国Courage&Khazaka公司;Cytation 5细胞成像多模式检测仪购自美国BioTek公司。
1.2 人参不同极性组分的制备
人参提取分离流程如图1所示,将人参根洗净切片粉碎,加入蒸馏水浸没药材,浸泡2~3h后,在100℃加热条件下回流提取3次,每次1 h,过滤去除残渣后,合并滤液干燥得到人参水提物。采用石油醚、氯仿、乙酸乙酯和正丁醇依次对人参水提物进行萃取,得到组分1(0.55% W/W)、组分2(0.98% W/W)、组分3(0.30% W/W)和组分4(2.65% W/W),最后所得水层萃取液为组分5(15.28%W/W)。

图1 人参不同极性组分制备流程图Fig.1 Flow chart of preparation of different polar components from ginseng
1.3 建立UVB诱导的HaCaT细胞损伤模型
将HaCaT细胞接种到6孔板中,置于含有5%CO2的37℃培养箱中孵育,待细胞生长密度达到80%进行不同剂量的UVB照射(20 mJ/cm2、40 mJ/cm2和80 mJ/cm2),照射后收取不同作用时间的细胞(12 h、24 h和48h),通过蛋白免疫印迹法检测其表皮结构相关蛋白表达情况,以确立造模条件。
1.4 蛋白质印迹法检测
用PBS洗涤细胞3次,加入含蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液置于冰上裂解30 min后,使用BCA蛋白检测试剂盒测定蛋白浓度。蛋白质样品(50g)用12%的SDS-PAGE凝胶分离,并转移到PVDF膜,转膜后,用5%的脱脂奶粉封闭1 h,并用TBST冲洗膜,将膜在4℃条件下与FLG和AQP3的一抗(1:500,1:1 000)孵育过夜,然后用TBST洗涤3次,并与相应的二抗(1:5 000)在室温下孵育1 h,用化学发光成像系统成像并分析转移的蛋白质条带。
1.5 动物分组造模及给药
SPF级雌性BALB/c无毛小鼠(6周龄),体重18~20g,购买于长春亿斯动物饲养中心,动物许可证号:SCXK(辽)2015-0001。在实验开始前,所有小鼠在温度(22±1)℃、相对湿度55%±5%的环境中适应培养1周。随时供应充足的水和食物。所有动物实验程序和方案均经长春中医药大学动物伦理委员会审核通过。小鼠适应培养1周后,随机分为空白组、UVB模型组、UVB+组分4组和UVB+组分5组,共4组(每组5只)。除空白组外,其余各组均连续2周每天接受发射波长为312 nm的UV交联仪照射小鼠背部皮肤每天1次,并用UVB测量计监测UVB(280~320 nm)的输出能量。小鼠在第1天和第2天以100 mJ/cm2的UVB剂量进行照射,第3天和第4天以150 mJ/cm2的剂量进行照射,随后将剂量增加到200 mJ/cm2进行照射直到实验结束。根据化妆品功效评价指南测试样品常规涂抹剂量(2.0±0.1)mg/cm2,在每天UVB的照射后,分别将组分4和组分5以2 mg/cm2的剂量涂抹于UVB+组分4和UVB+组分5组小鼠背部受试皮肤区域,每天涂抹1次。
1.6 小鼠皮肤表面生理指标检测
实验过程中,采用Cutometer®dual MPA 580测试仪Tewameter®TM 300、Corneometer®CM 825和Mexameter®MX18测试探头分别测试分析皮肤经表皮水分流失(transepidermal water loss,TEWL)、角质层含水量、皮肤红斑和黑色素沉着。这些测量均在21~22℃和50%~55%湿度的特定条件下进行,并分别在人参功效组分4和组分5治疗0d和14 d后对各组进行测量。
1.7 免疫荧光检测
小鼠皮肤组织在4%多聚甲醛中固定24 h后,包埋并切成3m厚的切片,脱蜡,水化,与一抗(1:200)在4℃孵育过夜,然后与FITC标记的山羊抗兔抗体(1:100)在室温下孵育1 h。细胞核用DAPI染色。利用细胞成像多功能检测系统Cytation 5对皮肤组织中的靶蛋白表达进行检测。
1.8 统计学方法
统计分析数据表示为平均值±标准偏差。使用GraphPad Prism 7.0进行单因素方差分析(ANOVA)和Tukey检验的多重比较,在所有实验中,P<0.05被认为具有统计学意义。
2 结果
2.1 UVB诱导的HaCaT细胞损伤模型的建立
我们使用不同UVB剂量(20 mJ/cm2、40 mJ/cm2和80 mJ/cm2)照射HaCaT角质形成细胞,分别照射12 h、24 h和48 h,通过免疫印迹法时间-剂量检测结果显示,UVB照射剂量为40 mJ/cm2和80 mJ/cm2,照射24 h后HaCaT细胞中FLG和AQP3蛋白表达水平显著降低,具有统计学意义(P<0.05);而照射12 h和48 h后HaCaT细胞中FLG和AQP3蛋白表达水平均无显著性变化。因此,本实验采用UVB照射剂量为40 mJ/cm2,照射24 h后建立细胞损伤模型(图2)。
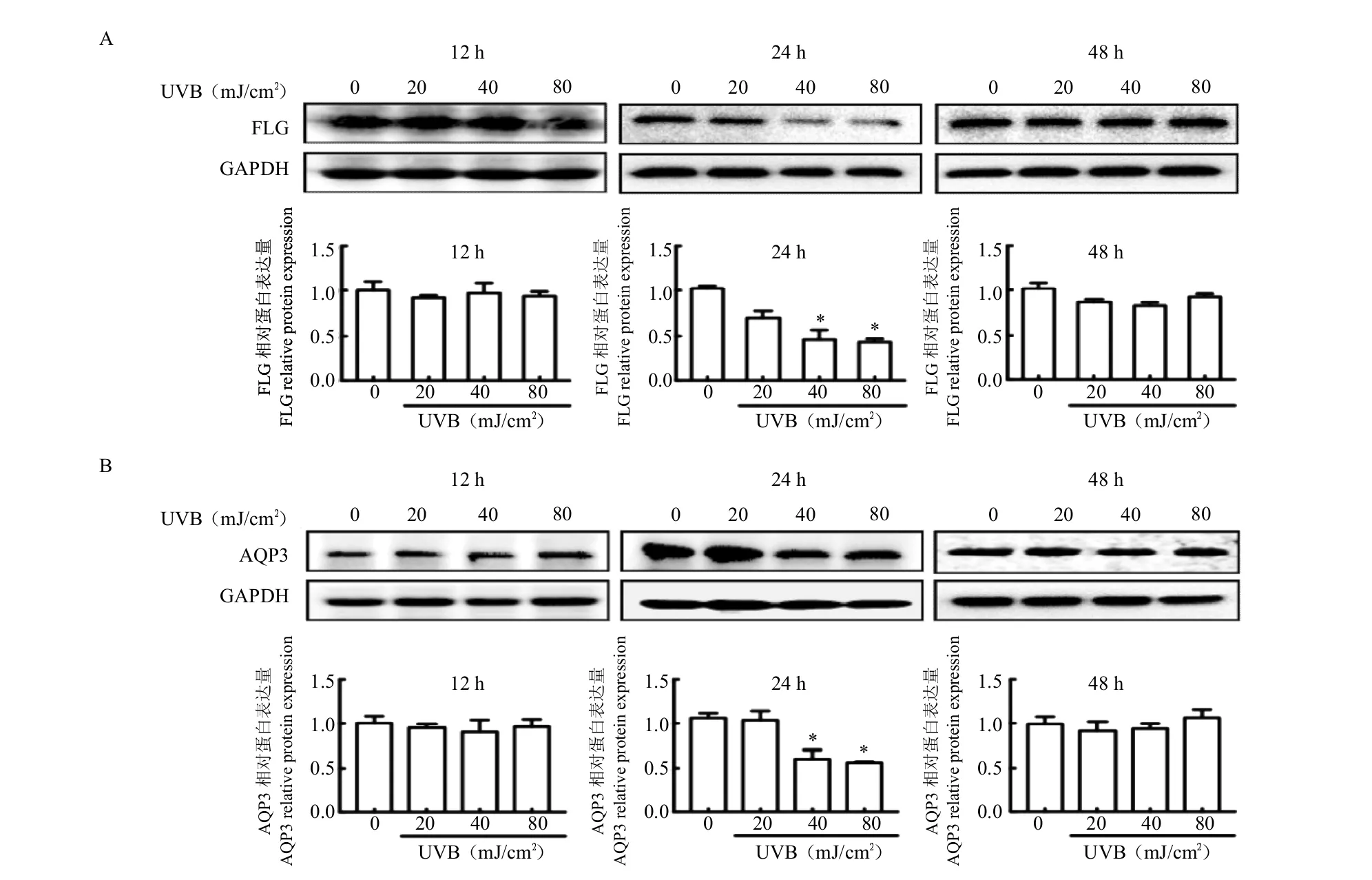
图2 UVB诱导的HaCaT细胞损伤模型条件筛选Fig.2 Screening of UVB induced HaCaT cell damage model
2.2 人参功效组分的筛选
利用建立的细胞模型检测人参不同极性组分对FLG和AQP3蛋白表达影响。免疫印迹实验结果显示,UVB模型组的表皮结构相关蛋白FLG和AQP3的表达水平明显降低(P<0.01,P<0.05),而用人参组分4和组分5(10g/mL)分别处理后均可使这两种蛋白表达水平显著升高(P<0.05)(图3)。因此,本研究利用已建立的细胞损伤模型筛选得到人参正丁醇层和水层组分具有表皮损伤修复作用。

图3 人参功效组分4和组分5对UVB作用的HaCaT细胞中FLG和AQP3蛋白表达影响Fig.3 Effects of ginseng active component 4 and component 5 on FLG and AQP3 protein expression in UVB treated HaCaT cells
2.3 人参功效组分4和组分5对UVB诱导的BALB/c无毛小鼠皮肤表面生理指标的影响
皮肤测试结果显示,与空白组比较,UVB模型组小鼠皮肤的TEWL、红斑值和黑色素值有所升高(P<0.05),而角质层含水量下降;而人参功效组分4和组分5治疗组小鼠皮肤的TEWL、红斑值和黑色素值显著降低(P<0.05),皮肤的角质层含水量显著升高,接近空白组(P<0.05)(图4)。动物水平实验结果进一步表明人参正丁醇层和水层组分可有效恢复小鼠皮肤表面的生理状态,增强对UVB诱导的小鼠皮肤损伤的保护作用。

图4 人参功效组分4和组分5对UVB作用的BALB/c无毛小鼠皮肤TEWL、角质层含水量、红斑值和黑色素值的影响Fig.4 Effects of ginseng active component 4 and component 5 on TEWL,stratum corneum water content,erythema value,and melanin value in UVB treated BALB/c hairless mice
2.4 人参功效组分4和组分5对UVB诱导的BALB/c无毛小鼠皮肤中FLG蛋白表达的影响
小鼠皮肤组织免疫荧光结果显示,UVB模型组小鼠皮肤组织中FLG蛋白表达的绿色荧光强度明显降低,经人参组分4和组分5治疗后,表皮中FLG蛋白的荧光染色强度明显高于UVB模型组(图5)。结果表明,人参正丁醇层和水层组分能显著恢复小鼠皮肤中表皮结构相关蛋白FLG的表达,有效改善UVB诱导的表皮结构损伤。

图5 人参功效组分4和组分5对UVB作用的BALB/c无毛小鼠皮肤中FLG蛋白表达的影响(20)。Fig.5 Effects of ginseng active component 4 and component 5 on FLG protein expression in UVB treated BALB/c hairless mice skin(20).
3 讨论
当机体受到紫外线辐射后,角质层屏障结构受损,导致FLG蛋白表达下降造成表皮损伤[8,9]。FLG是角质层屏障功能的关键调节因子[10,11],通过转谷氨酰胺酶-1的交叉连接作用参与角化包膜的形成并调节表皮的水分平衡[12-14]。由于紫外线辐射后,角质层屏障结构受损,皮肤的补水、锁水能力下降,导致控制皮肤水分运输的通道受阻,研究发现AQP3是皮肤中含量最丰富的水通道蛋白[15]。有研究表明,紫外线辐射可显著下调人皮肤角质形成细胞中AQP3蛋白的表达,造成皮肤缺水,从而进一步破坏表皮结构的完整性[16,17]。由此可见,AQP3是修复表皮损伤和维持表皮水化功能中的重要因子[18,19]。因此,本实验以FLG和AQP3蛋白表达水平为检测指标,通过对UVB造模剂量和时间的筛选和优化,建立了细胞损伤模型。
人参是最有价值的草本植物之一,自古以来就被中国、日本及韩国等亚洲国家用作治疗药物和保健品。根据以往的研究报道,人参中含有人参皂苷、多糖、寡糖、多肽、脂肪酸和氨基酸等多种活性成分。本研究采用不同极性的有机溶剂对人参水提液进行分步萃取,利用UVB诱导的细胞损伤模型进行活性筛选,结果发现正丁醇层萃取液(组分4)和水层萃取液(组分5)具有显著的表皮损伤修复功效。根据其萃取液极性大小,我们推测组分4可能主要含有人参皂苷成分,组分5可能主要含有极性较大的糖类成分。已有研究表明,人参皂苷Rb2可以通过降低活性氧(ROS)的产生和基质金属蛋白酶的活性延缓皮肤衰老[20];人参皂苷Rb1可以通过降低皮肤黑色素含量提亮肤色[21];人参寡糖能通过抑制ROS介导的MAPK和NF-B信号通路发挥抗光老化功效[22]。但人参活性成分对表皮损伤修复的研究鲜有报道。从本研究结果看,人参中可能存在两种不同极性的具有表皮损伤修复作用的组分,即正丁醇层和水层组分。
本研究通过BALB/c无毛小鼠动物模型做了进一步验证,明确了人参正丁醇层和水层组分具有表皮损伤修复功效,能有效恢复紫外线UVB对表皮结构造成的损伤,并且可能改善因表皮损伤后引起的干燥失水、粗糙、脱屑、红肿发炎和色素沉着等症状。基于本文实验数据,发现这两种人参功效组分可显著性地恢复皮肤的TEWL、角质层含水量、红斑值和黑色素沉着。为了更直观地表达其对表皮损伤的修复作用,文中采用免疫荧光实验,实验结果表明,外用涂抹人参正丁醇层和水层组分可有效抑制小鼠因UVB照射后下调的表皮结构相关蛋白FLG的表达,这与细胞水平结果相符。
综上所述,本实验从人参中筛选出的正丁醇层和水层组分具有显著的表皮损伤修复功效,其可通过增强表皮结构相关蛋白及补水、锁水因子的表达,恢复受损的表皮结构,这将为其作为皮肤损伤修复成分的研制提供有效的实验数据和参考价值,为中医药更为广泛的应用提供了强有力的科学依据。

