eGFR 和NT-proBNP 对慢性心力衰竭合并房颤患者预后的预测价值
方 中,徐晓东,王丽华,张 颖,马 超
(池州市人民医院心内科,安徽 池州 247000)
慢性心力衰竭(chronicheart failure,CHF)和房颤(atrial fibrillation,Af)是两种常见的心血管疾病,两者存在共同的危险因素,两者同时存在时会导致患者的死亡风险大大增加[1]。Af 也是最常见的心律失常,会大大增加患者的死亡风险[2]。氮末端脑钠肽前体(N-terminal probrain natriuretic peptide,NT-proBNP)是临床上CHF 最常用的预后评估指标[3−5]。肾功能损害也会影响CHF 患者的预后;肾功能损害是CHF 全因死亡的一个预测因子[6]。血清肌酐对于肾功能的评估有时不太准确,经常会低估一些患者的实际肾功能[7]。因此,临床上也常根据肾脏病膳食改良预测方程得到的估测肾小球滤过率(evaluate glomerular filtration rate,eGFR)来反映患者的肾功能情况[8]。对于eGFR和NT-proBNP 在CHF 预后预测方面已有较多的循证医学研究证据[9−11]。但对于使用eGFR 和NTproBNP 来评估CHF 合并Af 患者预后方面的国内外研究并不多。本研究通过对CHF 合并Af 患者的随访,分析eGFR 和NT-proBNP 在评估CHF合并Af 患者的近期预后是否有预测价值。
1 资料与方法
1.1 研究对象
连续选择2018 年1 月至2019 年12 月在池州市人民医院心内科住院的CHF 合并Af 患者139 例,其中男性57 例,女性82 例,年龄43~90 岁,平均(73.68±9.21)岁。心功能根据纽约心脏病学会(New York Heart Association,NYHA)分级标准[12]进行划分。患者是否合并Af 主要依据其病史、临床体征、心电图及动态心电图的结果。纳入标准:(1)CHF 诊断符合《中国心力衰竭诊断和治疗指南2014》诊断标准[13];(2)心功能分级为NYHA II 级-IV 级的患者;(3)Af 诊断符合2016 年欧洲《房颤管理指南》诊断标准[14];(4)持续性或永久性Af。排除标准:(1)患者住院期间死亡的;(2)患者失访、临床资料不全的;(3)患者中途退出研究的。入选患者的知情同意书均已签署,本研究获得该院伦理委员会批准。
1.2 血清肌酐、NT-proBNP 的测定及估测肾小球滤过率(eGFR)的计算
分别采用全自动生化仪和电发光法检测血清肌酐和血清NT-proBNP 水平。根据肾脏病膳食改良预测方程算出eGFR[8]:eGFR(mL/(min·1.73 m2))=血清肌酐(mg/dL)-1.234×年龄-0.179×175×(若为男性×1.0,若为女性×0.79)。血清肌酐单位换算为 1 mg/dL=88.4 µmol/L。
1.3 资料的收集
收集患者的基线资料,如性别、年龄、心功能分级及基础心脏病情况。同时记录患者的血清肌酐、血清NT-proBNP 及左室射血分数值,并计算eGFR 值。
1.4 患者分组
根据ROC 曲线确定的eGFR 切点值,将CHF 合并Af 患者分为eGFR 高水平组(eGFR≥85 mL/(min·1.73 m2))和eGFR 低水平组(eGFR <85 mL/(min·1.73 m2))。再根据ROC 曲线确定的NT-proBNP 切点值,将CHF 合并Af 患者分为NTproBNP 高水平组(NT-proBNP≥3 500 pg/mL)和NTproBNP 低水平组(NT-proBNP <3 500 pg/mL)。
1.5 预后随访
对住院期间及出院后的患者均实施规范化治疗。随访患者出院后是否发生全因死亡。本研究随访时间至少12 个月,随访期间全因死亡的则停止随访。随访方式采用住院、门急诊资料查阅和电话随访相结合。
1.6 统计学处理
统计学分析使用SPSS 20.0 软件。计量资料以均数±标准差()表示,计数资料以率或构成比表示。采用Logistic 回归分析患者随访期间发生全因死亡的危险因素。应用ROC 曲线评估eGFR、血清NT-proBNP 在CHF 合并Af 患者预后中的价值。生存分析使用Kaplan-Meier 法,检验用Log-rank 法。以P<0.05 为差异具有统计学意义。
2 结果
2.1 CHF 合并Af 患者的基本临床特点
入选的CHF 合并Af 患者139 例,患者的年龄、性别、心功能状况、基础心脏病情况及血清肌酐、Lg(NT-proBNP)、eGFR、左室射血分数结果,见表1。
表1 入选患者的基本特征[/n(%)]Tab.1 Basic characteristics of the selected patients[/n(%)]

表1 入选患者的基本特征[/n(%)]Tab.1 Basic characteristics of the selected patients[/n(%)]
注:Lg(NT-proBNP)为NT-proBNP的对数值。
2.2 CHF 合并Af 患者随访期间发生全因死亡情况
患者共随访370~1 086 d,中位随访时间549 d。随访期间发现全因死亡的患者65 例,发生率为46.76%。
2.3 Logistic 回归分析CHF 合并Af 患者随访期间发生全因死亡的危险因素
以年龄、性别、心功能分级、血清肌酐、NTproBNP、eGFR 和左室射血分数作为自变量,将CHF 合并Af 患者随访期间发生全因死亡作为因变量,多因素分析结果显示,NT-proBNP 和eGFR 是CHF 合并Af 患者随访期间发生全因死亡的危险因素(P<0.05),见表2。

表2 Logistic 回归分析入选患者随访期间发生全因死亡的危险因素Tab.2 Logistic regression analysis risk factors for all-cause death in selected patients during follow-up
2.4 eGFR 在预测CHF 合并Af 患者不发生全因死亡的价值
作eGFR 预测CHF 合并Af 患者不发生全因死亡的ROC 曲线。eGFR 预测CHF 合并Af 患者不发生全因死亡的曲线下面积为0.651(95% CI:0.562~0.740),最佳界值为84.81 mL/(min·1.73 m2),敏感度为57.70%,特异度为69.20%,见图1。

图1 eGFR 预测CHF 合并Af 患者不发生全因死亡的ROC 曲线Fig.1 ROC curve of eGFR in predicting the absence of allcause death in patients with CHF complicated with Af
2.5 血清NT-proBNP 在预测CHF 合并Af 患者发生全因死亡的价值
绘制ROC 曲线反映血清NT-proBNP 预测CHF 合并Af 患者发生全因死亡。结果显示曲线下面积为0.720(95%CI:0.638~0.803),最佳界值为3 460 pg/mL,敏感度为69.20%,特异度为67.30%,见图2。
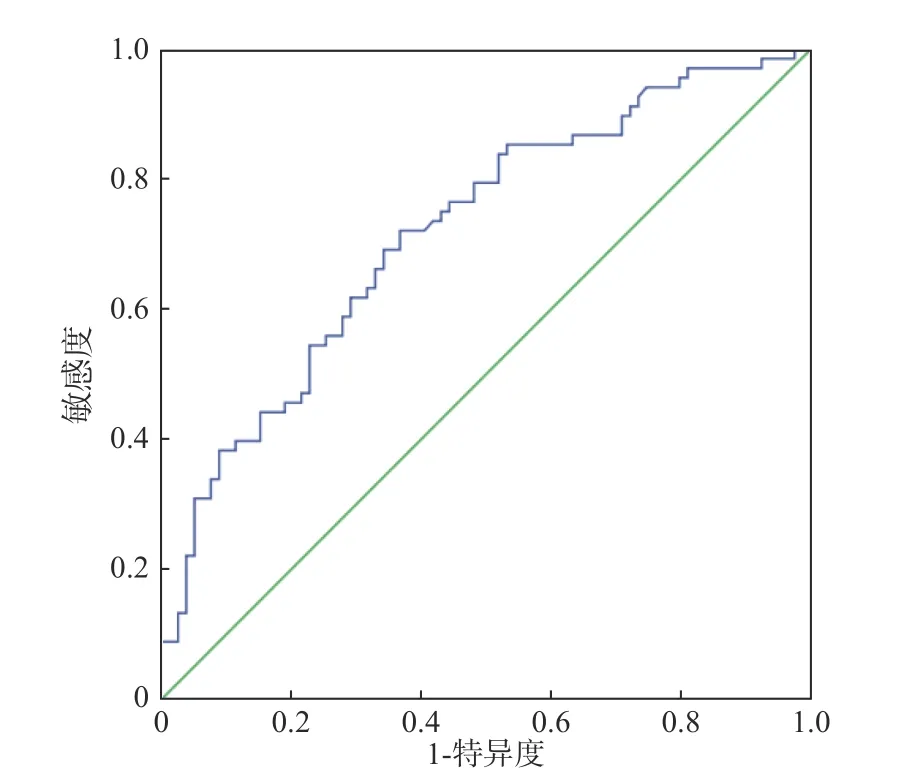
图2 血清NT-proBNP 预测CHF 合并Af 患者发生全因死亡的ROC 曲线Fig.2 Serum NT-proBNP predicted the ROC curve of allcause death in patients with CHF complicated with Af
2.6 不同eGFR 分组的CHF 合并Af 患者随访期间累积生存率情况的比较
Kaplan-Meier 生存曲线显示,eGFR 低水平组患者随访期间累积生存率明显低于eGFR 高水平组,Log-rank 的检验统计值为9.21,P=0.002,见图3。
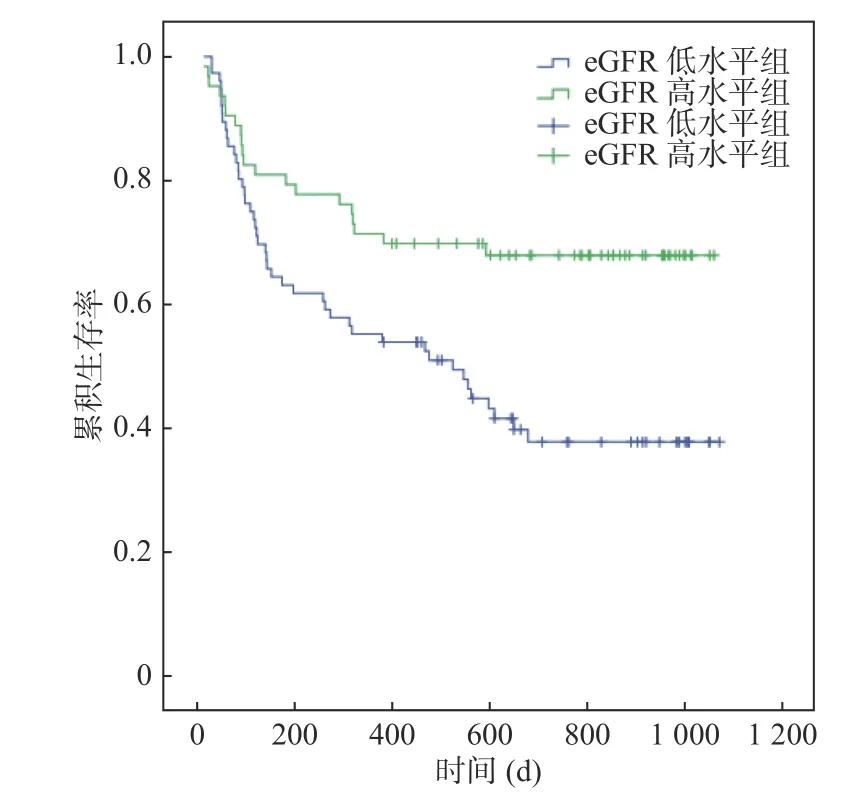
图3 不同eGFR 分组的CHF 合并Af 患者随访期间累积生存率情况的比较Fig.3 Comparison of follow-up cumulative survival rate in patients with CHF combined with Af in different eGFR groups
2.7 不同NT-proBNP 分组的CHF 合并Af 患者随访期间累积生存率情况的比较
Kaplan-Meier 生存曲线显示,NT-proBNP 高水平组患者随访期间累积生存率明显低于NTproBNP 低水平组,Log-rank 的检验统计值为16.91,P<0.001,见图4。
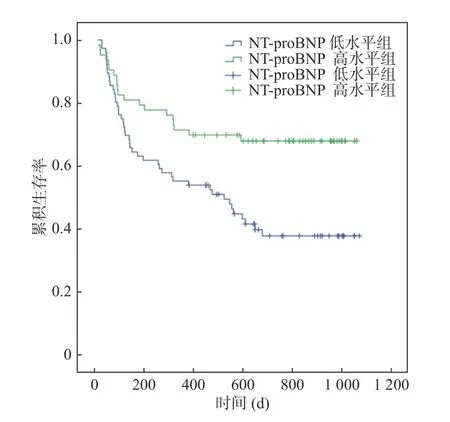
图4 不同NT-proBNP 分组的CHF 合并Af 患者随访期间累积生存率情况的比较Fig.4 Comparison of follow-up cumulative survival rate in patients with CHF combined with Af in different NT-proBNP groups
3 讨论
CHF 和Af 往往并存,二者相互影响,可彼此诱发,从而导致恶性循环的发生。Af 是CHF患者常出现的心律失常,合并Af 使CHF 患者死亡的风险大大增加[15−17]。本研究纳入了139 例CHF 合并Af 患者,随访期间共有65 例患者死亡,发生率为46.76%。入选患者的随访死亡率高,除了与心功能Ⅲ及Ⅳ级患者多有关;特别是心功能Ⅳ级的患者比例达到77.7%。更重要的是考虑与CHF 患者同时合并Af 有关,Af 进一步恶化了CHF 患者心功能。CHF 和Af 常常同时存在,两者有许多共同的危险因素,既互相促进,也互为因果,导致恶性循环。当CHF 和Af 并存时,患者出现死亡风险的概率较单个疾病明显增加[18]。
临床上普遍应用NT-proBNP 来预测CHF 患者的预后[19]。NT-proBNP 这项指标也存在不足之处,因而需寻找发现新指标与其联合应用,弥补其存在的局限性。Yilmaz 等[20]的研究表明,eGFR 可用于预测心力衰竭患者的死亡率,这可能是心力衰竭的预后与肾功能损害程度相关。eGFR 作为一项新指标,可以联合NT-proBNP 来一起评估心力衰竭预后[21]。本研究中ROC 曲线显示:eGFR 预测 CHF 合并Af 患者不发生全因死亡的曲线下面积为0.651(95% CI:0.562~0.740),最佳切点值是84.81 mL/(min·1.73m2)。这表明eGFR 值高于此水平患者发生全因死亡风险较低。本研究发现,eGFR 低水平组患者随访期间累积生存率明显低于eGFR 高水平组,提示低水平的eGFR 预示着较高死亡率的发生。表明eGFR 与CHF 合并Af 的预后密切相关,可以作为判断CHF 合并Af 预后的指标。eGFR 联合使用NTproBNP 可明显提高CHF 合并Af 患者预后预测的准确性。
NT-proBNP 在CHF 预后评估的意义和价值是毫无疑问的,而此标志物与Af 的关系也很密切[22−23]。Hijazi 等[24]的研究显示NT-proBNP 水平通常在Af 中升高,并与卒中和死亡率的增加独立相关。本研究中,使用血清NT-proBNP 预测CHF 合并Af 患者发生全因死亡的曲线下面积为0.720。本研究根据ROC 曲线确定的NT-proBNP切点值,将患者分为NT-proBNP 高水平组和NTproBNP 低水平组。患者分组时将NT-proBNP≥3500 pg/mL 认定为NT-proBNP 高水平组。NTproBNP 高水平组患者随访期间累积生存率明显低于NT-proBNP 低水平组,Log-rank 的检验统计值为16.91,P<0.001。以往一直使用NT-proBNP评估CHF 患者的预后,是其他指标难以代替的。对于CHF 合并Af 患者的预后评估,NT-proBNP同样有很高的应用价值。通过本研究发现,CHF合并Af 患者血清NT-proBNP 达到3500 pg/mL 以后全因死亡风险高。
综上所述,eGFR 和血清NT-proBNP 对CHF合并Af 患者发生全因死亡的预测有重要价值。eGFR 和血清NT-proBNP 可用于预测CHF 合并Af 患者的近期预后,有一定的临床应用价值。本研究只是一个近期的预后随访,至于eGFR 和血清NT-proBNP 对慢性心力衰竭合并房颤患者远期预后的评估作用尚未可知,仍需进一步深入研究。

