宁杞1号枸杞健康株与根腐病患病株的土壤微生物群落和功能差异
贾晨波,郭洋,马成莲,苏建宇,徐春燕
宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021
枸杞(Lycium barbarumL.)隶属于茄科枸杞属,其根系较为发达,抗旱能力强,是宁夏重要的经济作物。近年来,随着宁夏枸杞种植规模的不断扩大,枸杞病害的发生也越来越多,例如白粉病(Wang et al.,2015)、炭疽病(贾倩等,2014)及根腐病(Cariddi et al.,2018)等,这些病害常常会造成枸杞的减收减产,严重影响着枸杞产业的发展。其中,根腐病是极为常见的一种土传病害,多发生在植物根部或茎部,其病原物的生活史的一部分或大部分存在于土壤中。在条件适宜时,病原物萌发并侵染植物根部或茎部导致植物发生病害。已报道枸杞根腐病病原菌种类有腐皮镰刀菌、同色镰刀菌、串珠镰刀菌、尖孢镰刀菌、疫霉菌和立枯丝核菌(刘振荣,1980;王国珍等,1994;李晖等,1998)等。根腐病的发生一般从植株根茎附近开始,局部皮层逐渐腐烂并向周围扩散,输导组织被破坏,营养物质不能从地下及时足量地运输到植株地上部分,后期外皮脱落只剩木质部,最终致使全株枯萎死亡,危害严重时可毁坏整个果园。
目前国内外对于根腐病的研究较多,涉及大豆、人参和大白菜(Nyandoroet al.,2019;Li et al.,2020;郭梅等,2019)等多种作物上病原菌的分离、鉴定、致病性检测(伍晓丽等,2020)和根腐病的防治(崔云龙等,1995;陈伶俐,2015)等方面。目前对于枸杞根腐病的研究较少,且主要集中于枸杞根腐病的发生现状与防治办法等方面,部分研究报道了枸杞根腐病的致病菌分离、毒力测定及其生物学特性(李捷等,2017),但对枸杞健康株和根腐病患病株的土壤及植物相关部位微生物群落结构的差异研究甚少。土壤微生物是土壤的重要部分(Naet al.,2019),植物土传病害的发生、发病程度一般与病原菌、益生菌及植物所在土壤生态环境有密切的关系。例如,卢圣鄂等(2021)研究发现,黄精根际土壤真菌群落结构丰富度的降低和具有致病性的真菌相对丰度的增加有可能导致了黄精根际土壤微生物群落结构的改变和根腐病的发生。宋旭红等(2017)基于高通量测序技术发现细菌种群丰富度和多样性的显著降低有可能是造成黄连根腐病的重要原因之一。余金阳等(2020)认为大蒜根腐病发生的主要原因是微生物群落结构失衡。可见,许多工作已经在多种植物上证实了根腐病的发生与土壤微生物多样性及物种组成变化有密切的关系。因此,感染根腐病的枸杞植株与健康枸杞植株之间的土壤微生物群落组成及多样性有怎样的差异也值得深入研究。
2019年6月,宁夏中宁县花豹湾村枸杞园的宁杞1号枸杞遭遇大面积死亡,植株大量干枯,挖出死株可见根部腐烂,经鉴定为根腐病所致。本研究采集了该地患病株和健康株的根表、根际和根围土壤样品,提取土壤中的宏基因组DNA,利用Illumina Miseq高通量测序技术对16S rDNA和ITS片段进行测序,对比患病株和健康株根表、根际和根围土壤中微生物群落结构和功能的差异,该研究有助于我们了解枸杞根腐病发生与微生物群落之间的关系,丰富我们对枸杞根腐病的认识。
1 材料与方法
1.1 采集地概况
2019年 8月于宁夏回族自治区中宁县花豹湾(37°17′N,105°39′E)采集样品。中宁县属温带大陆性季风气候,境内光照充足,日照时间长,年均日照时数 2855.0—3219.7 h,年均气温 8.3—11.0 ℃,地势南高北低,平均海拔1140—1600 m,年均降水量78.5—335.0 mm(雷蕾等,2020)。该县地势平坦,土层深厚,得益于黄河与清水河的交汇灌溉,土壤富含各种矿物质和微量元素,为枸杞种植提供了得天独厚的土壤条件。
1.2 样品采集
所选样地的枸杞栽培种为宁杞1号,根据枸杞植株茎叶的形态选出待采样的植株,挖出整个植株的根。根据根的形态判断植株是否患病,共选择 3株患根腐病的病株和3株健康植株分别采集样品,健康株随机选择,一般距离患病株10 m以内,所有患病株与健康株均选自同一块种植地。以植株主干为中心,围绕植株每120°为一份,按距离枸杞根部由远及近的方法,依次采集根围、根际土壤和根组织样品。3份土壤样品等比例混匀,分别获得根围样品BZGW1和根际样品BZGJ1。3个方向采集到的根组织进行混合,用于制备根表样品BZGB1。同样的方法获得第2株和第3株患病株根组织及根围样品 BZGW2和 BZGW3、根际样品 BZGJ2和BZGJ3,根组织用于制备根表样品 BZGB2和BZGB3。使用同样的方法采集健康株的根表组织、根际土壤、根围土壤样品各3个。将根上的土壤抖落,然后用毛刷小心刷下的土壤用 20目标准筛除去根等杂物后即为根际土壤样品,大约20 g左右;距根须1 cm以外一圈采集的土壤用20目标准筛除去根等杂物后即为根围土壤样品,大约100 g左右;根组织带回实验室处理得到根表样品。所有样品采集后均迅速低温保藏并及时带回实验室,于−20 ℃暂存。
1.3 根表样品的制备
取根组织浸没于无菌PBS溶液,于4 ℃下180 r·min−1。低温孵育 20 min,保留洗涤液;取出植物组织在同样的条件下再次孵育20 min,合并两次洗涤液并于 10000 r·min−1低温离心 10 min,收集的沉淀物即为根表样品。
1.4 DNA抽提和PCR扩增
根据 DNeasy PowerSoil Pro Kit(QIAGEN’s Second-generation Inhibitor Removal Technology®)分别抽提患病株的九个样品和健康株的九个样品土壤微生物总DNA,检测合格后送至上海美吉生物医药科技有限公司进行16s rDNA和ITS片段的高通量测序。使用 338F(5′-ACTCCTACGGGAGGCAG CAG-3′)和 806R(5′-GGACTACHVGGGTWTCT AAT-3′)对16S rRNA基因“V3+V4”区进行PCR扩增,使用 ITS1F(5′-CTTGGTCATTTAGAGGAAG TAA-3′)和 ITS2R(5′-GCTGCGTTCTTCATCGA TGC-3′)对ITS1区进行PCR扩增,检测合格后利用Illumina公司的Miseq PE300平台进行测序。
1.5 数据处理
使用 Trimmomatic软件对原始测序序列进行质控,使用FLASH软件进行拼接,过滤reads尾部质量值20以下的碱基,过滤质控后50 bp以下的reads,根据PE reads之间的overlap关系,将成对reads拼接成一条序列,最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.2。使用的UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,比对 Silva数据库和(https://www.arb-silva.de/)和 Unite数据库(https://unite.ut.ee/),设置比对阈值为70%。所有的分析都基于抽平后的数据,采用Excel 2016和SPSS 17.0进行数据统计和分析,根据单因素方差分析检验显著性,所有数据均用“平均值±标准差”表示,展示数据时分别将相应样品名合并为BZGB、BZGJ、BZGW和JKGB、JKGJ、JKGW。
2 结果与分析
2.1 α多样性比较
所有样品测序共产生 1131102条真菌有效序列,聚类为1603个OTUs;产生479376条细菌有效序列,聚类为6704个OTUs。根表、根际和根围土壤的真菌和细菌群落测序覆盖度(Coverage)分别高于0.99和0.96(表1),表明样品测序深度基本能够反映微生物的真实情况。健康株根表真菌群落的Sobs指数、Shannon指数、Shannoneven指数均显著大于患病株(P<0.05),即健康株根表真菌群落的丰富度、多样性和均匀度均显著大于患病株(P<0.05)。健康株根围土壤真菌的多样性和均匀度也显著大于患病株(P<0.05)。健康株根表、根际和根围土壤真菌之间的群落丰富度差异显著(P<0.05),健康株根表和根际土壤真菌均匀度差异也很显著(P<0.05);患病株根表、根际土壤真菌与根围土壤真菌的群落丰富度差异显著(P<0.05)。综上,宁杞1号枸杞健康株根表真菌群落的α多样性显著高于患病株,而健康株的3个样品中,根际土壤真菌群落的丰富度和多样性最高。健康株和患病株之间,根表、根际和根围土壤的细菌群落Sobs指数、Shannon指数和Shannoneven指数均无显著差异(P<0.05),即健康株和患病株之间各部位样品中细菌丰富度、多样性和均匀度指数均无显著差异。此外,健康株的根表与根际、根围土壤的细菌群落丰富度、多样性和均匀度指数均有显著差异(P<0.05),患病株的根表与根际、根围土壤的细菌群落丰富度、多样性和均匀度指数也均有显著差异(P<0.05)。
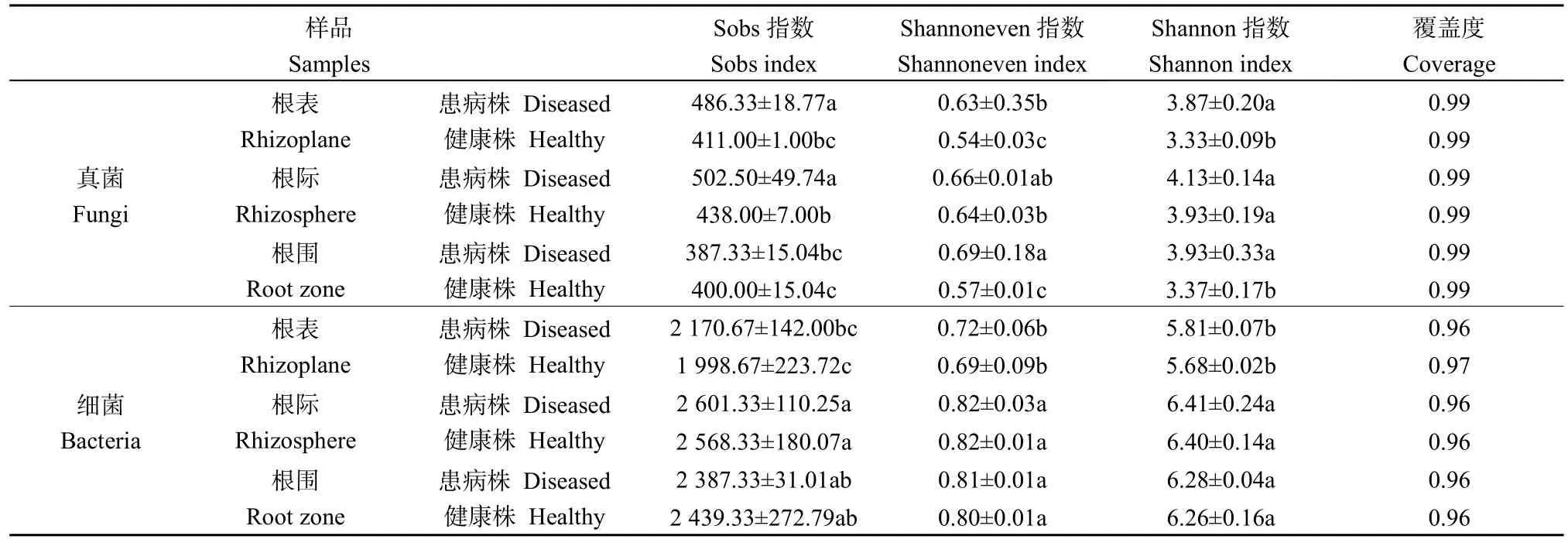
表1 微生物群落的Alpha多样性指数Table 1 Alpha diversity index of the microbial communities
2.2 OTU水平的Venn图比较
健康株和患病株各样品中16S rDNA“V3+V4”区和ITS1片段的OTU分析结果显示(图1):健康株的根表和根际土壤中特有的真菌 OTU数目多于患病株,根围土壤中特有的真菌 OTU数目少于患病株;健康株根表特有的细菌 OTU数目多于患病株,根际和根围土壤中特有的细菌 OTU数目少于患病株。综上,患病株根表特有的真菌和细菌OTU数目均少于健康株,该结果表明患病株根表微生物类群少于健康株根表,患病株根表的微生物多样性减少。

图1 基于OTU水平的Venn图Fig. 1 Venn diagram based on OTU levels
2.3 基于OTU水平的主成分分析
基于 bray_curtis计算距离的 PCoA分析(图2A)检测到宁杞1号各样品真菌群落之间的总差异为 37.69%,健康株根表、根际和根围土壤的真菌群落距离较近,表明健康株根表、根际和根围部位的物种组成趋于相似,而患病株根表的真菌群落距根际和根围真菌群落较远,即物种组成有一定的差异性。此外,健康株和患病株各相同部位的群落组成也有一定的差异性。由此可见,健康株的各部位土壤真菌群落组成较为相似,根腐病患病株不同部位群落的组成具有一定的差异性。细菌群落之间的总差异为 51.32%(图2B),健康株与患病株根表的细菌群落结构差异较大,根际和根围的细菌群落间坐标距离较近,表明其健康株与患病株根际和根围部位的细菌群落组成基本一致或相似。由此可见,根腐病患病株和健康株各部位的真菌群落结构差异更大,而患病株和健康株各部位的细菌群落结构总体差异较小,二者细菌群落的差异主要在根表部位。
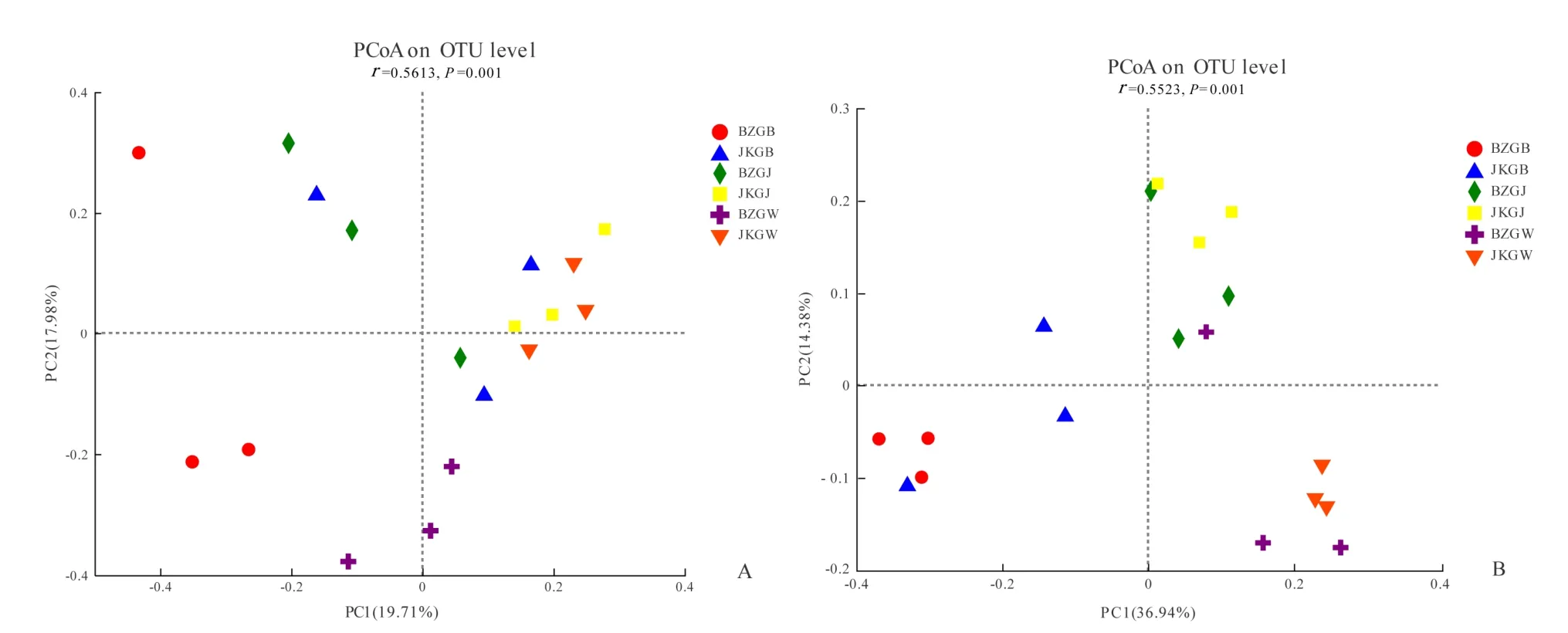
图2 真菌和细菌OTU水平的PCoA分析Fig. 2 PCoA analysis of OTU levels in fungi and bacteria
2.4 微生物群落组成分析
2.4.1 真菌群落组成分析
门水平上,真菌群落中子囊菌门(Ascomycota)在所有样品中均是优势门,平均占比达75.7%,且患病株不同部位样品中的丰度均大于健康株的相应样品,其中在患病株根表上丰度最大(94.4%);被孢霉门(Mortierellomycota)丰度占第二,平均占比14.4%,健康株不同部位样品中的丰度大于患病株(图3A),且在根表上的差异最大,健康株根表为24.8%,患病株根表仅为3.6%。属水平上(图3B),将每个样品中低于1%的物种归为others,与unclassified和norank一并剔除掉,丰度高于1%的明确物种占47.3%—66.5%。健康株根表的优势真菌依次为Mortierella(24.8%)、Fusarium(11.3%)、Alternaria(7.4%)和Plectosphaerella(2.5%),患病株根表的优势真菌依次为Fusarium(31.5%)、Plectosphaerella(10.1%)、Alternaria(7.2%)和Mortierella(3.6%)。可见健康株和患病株根表的优势属组成无较大差异,但优势属丰度差异较大。患病株根表Mortierella的丰度比健康株根表低85.48%,Fusarium的丰度高1.79倍,Plectosphaerella高3.04倍,Alternaria的丰度无较大差异。健康株根际土壤中的主要真菌依次为Mortierella(17.8%)、Fusarium(6.2%)、Metarhizium(6.8%)和Lophiotrema(4.9%),患病株的根际土壤中主要真菌为Fusarium(27.3%)、Mortierella(14.2%)、Clonostachys(6.9%)和Plectosphaerella(3.2%),说明健康株和患病株根际土壤中的优势属组成和丰度差异均较大,患病株根际土壤中Fusarium的丰度比健康株高3.4倍,Mortierella的丰度低20.22%。健康株根围土壤中的主要真菌为Mortierella(20.9%)、Fusarium(15.7%)、Acaulium(4.9%)和Alternaria(4.5%),患病株根围土壤的主要真菌为Alternaria(14.1%)、Fusarium(8.6%)、Metarhizium(5.4%)和Mortierella(5.2%),可见健康株和患病株根围土壤中的优势属组成无较大变化,但优势属丰度差异较大。患病株根围土壤中Mortierella和Fusarium的丰度分别比健康株低75.12%和45.22%,而Alternaria的丰度高2.13倍。健康株和患病株根表的优势真菌占比不同,但其种类未发生改变;而根际和根围土壤中的优势真菌占比和种类均有差异。作为优势属的Fusarium在患病株根表和根际的丰度均高于健康株;Mortierella在健康株根表、根际和根围的丰度均高于患病株;Alternaria在健康株和患病株根表的丰度几乎无差别,而在患病株根际和根围中的丰度均大于健康株;Plectosphaerella在患病株根表和根际土壤中的丰度显著大于健康株。综上,门水平上宁杞1号枸杞根表部位Ascomycota和Mortierellomycota丰度的变化及属水平上根表部位Fusarium、Mortierella和Plectosphaerella三类重要真菌丰度的变化可能与其根腐病的发生有重要的关联。
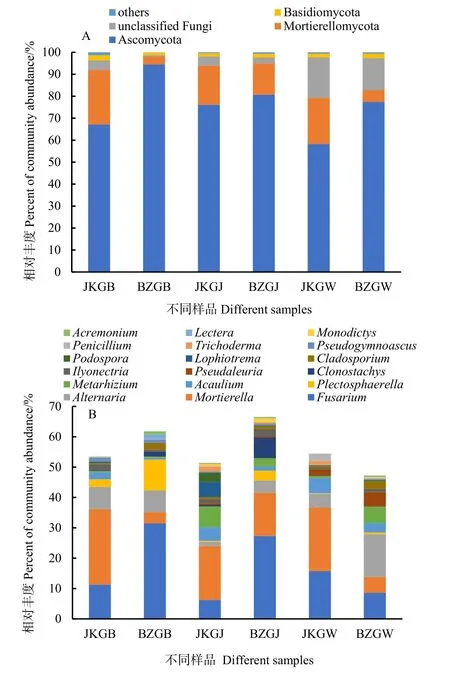
图3 门水平和属水平上真菌群落的相对丰度Fig. 3 Relative abundance of fungal communities at the phylum and genus level
2.4.2 细菌群落组成分析
变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)是细菌群落中的优势门(图4A),平均占比达86.5%,变形菌门和放线菌门在根表的丰度大于根际和根围,而绿弯菌门、酸杆菌门和芽单胞菌门在根表的丰度小于根际和根围。属水平上,将细菌群落每个样品中丰度均低于1%的物种归为others,与unclassified和norank一并剔除掉,丰度高于1%的明确物种占15.6%—43.4%(图4B),其中健康株根表的主要细菌为Arthrobacter(12.5%)、Mycobacterium(4.9%)、Lelliottia(4.3%)和Stenotrophomonas(2.1%),患病株根表的主要细菌为Arthrobacter(20.9%)、Lelliottia(4.2%)、Allorhizobium(2.7%)和Mycobacterium(1.9%)。可见,健康株和患病株的根表优势细菌组成和丰度差异较大。患病株根表Arthrobacter的丰度比健康株根表高67.20%,Mycobacterium的丰度低61.22%,Lelliottia的丰度无较大差异。健康株的主要根际细菌有Arthrobacter(8.7%)、RB41(3.8%)、Blastococcus(1.8%)和Nitrospira(1.4%),患病株的主要根际细菌有Arthrobacter(8.2%)、RB41(2.2%)、Nitrospira(1.7%)和Blastococcus(1.3%)。可见健康株和患病株根际的主要优势属组成一致,但各丰度稍有差异,患病株根际土壤中RB41的丰度比健康株根际低42.11%,Blastococcus的丰度低27.78%,Nitrospira的丰度高21.43%,Arthrobacter的丰度差异较小。健康株根围土壤的主要细菌有Arthrobacter(4.7%)、RB41(1.9%)、Sphingomonas(1.3%)和Nitrospira(1.2%),患病株根围土壤的主要细菌有Arthrobacter(6.8%)、Sphingomonas(1.9%)、Nitrospira(4.8%)和MND1(1.4%)。可见,健康株和患病株的根围优势细菌组成无较大差异,优势属丰度差异较大。患病株根围土壤中Arthrobacter的丰度比健康株根围高 30.9%,Nitrospira的丰度高3倍,Sphingomonas的丰度高46.15%。健康株和患病株的根际优势细菌占比稍有不同,组成基本一致;健康株和患病株根表与根围的优势细菌组成和占比均不一致。细菌群落中,健康株和患病株根表优势属Arthrobacter和Lelliottia的丰度远大于根际和根围,且Arthrobacter在患病株根表的丰度显著大于健康株,提示根表Arthrobacter丰度的变化可能与宁杞 1号枸杞根腐病的发生也有一定的关系。

图4 门水平和属水平上细菌群落的相对丰度Fig. 4 Relative abundance of bacterial communities at the phylum and genus Level
2.5 属水平上LEfSe物种差异分析
LEfSe使用 non-parametric factorial Kruskal-Wallis sum-rank test(非参数因子克鲁斯卡尔—沃利斯秩和验检)检测具有显著丰度差异特征,然后进行线性判别分析(LDA)来明确具有显著丰度差异特征的物种。真菌群落(图5A)的LDA分析(LDA>3,P<0.05) 表 明 unclassified_f_Didymellaceae、Ilyonectria、Mortierella、Lophiotrema和unclassified_k_Fungi的丰度分别对患病株根表、根际和健康株根表、根际、根围差异效果影响最大。细菌群落(图5B)的LDA分析(LDA>3.5,P<0.05)表明Allorhizobium、g_unclassified_f_Enterobacteriaceae、MND1、RB41、norank_f_Gemmatimonadaceae、norank_c_Gitt_GS_136的丰度分别对患病株根表、健康株根表、患病株根际、健康株根际、健康株根围差异效果影响最大。属水平上,患病株和健康株的各样品中存在显著丰度差异的物种各不相同,其中,优势属Mortierella是健康株根表具有显著丰度差异特征的物种。
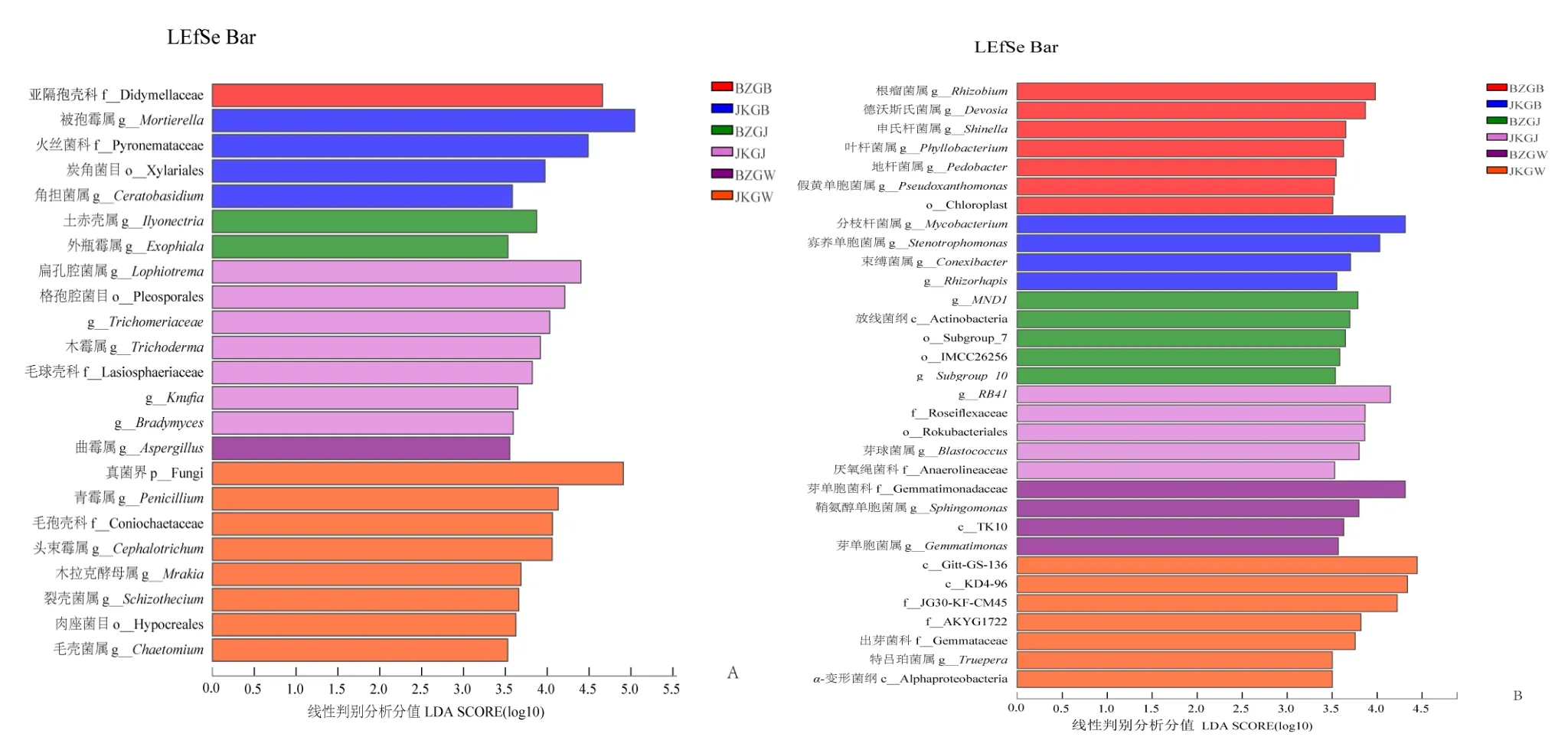
图5 属水平的LDA判别结果图Fig. 5 LDA discriminant result chart of genus level
2.6 微生物功能预测
为探究患病株和健康株的微生物群落在功能分布上的差异,利用PICRUSt2对细菌群落进行功能预测(图6),将预测结果与 KEGG数据库对比发现,所有的细菌群落功能预测共有新陈代谢、环境信息处理、遗传信息处理、细胞过程、有机系统和与人类疾病有关的六大类。其中,属于新陈代谢的功能丰度占比最大,主要以碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢、核苷酸代谢、脂类代谢为主。其次为属于环境信息处理的膜运输和信号传导,以及属于遗传信息处理的翻译、复制和修复机制等。患病株和健康株根表的功能丰度大于根际和根围,且患病株根表的功能丰度大于健康株,这可能与根表微生物靠近植株、微生物与植株之间的相互作用较多有关。
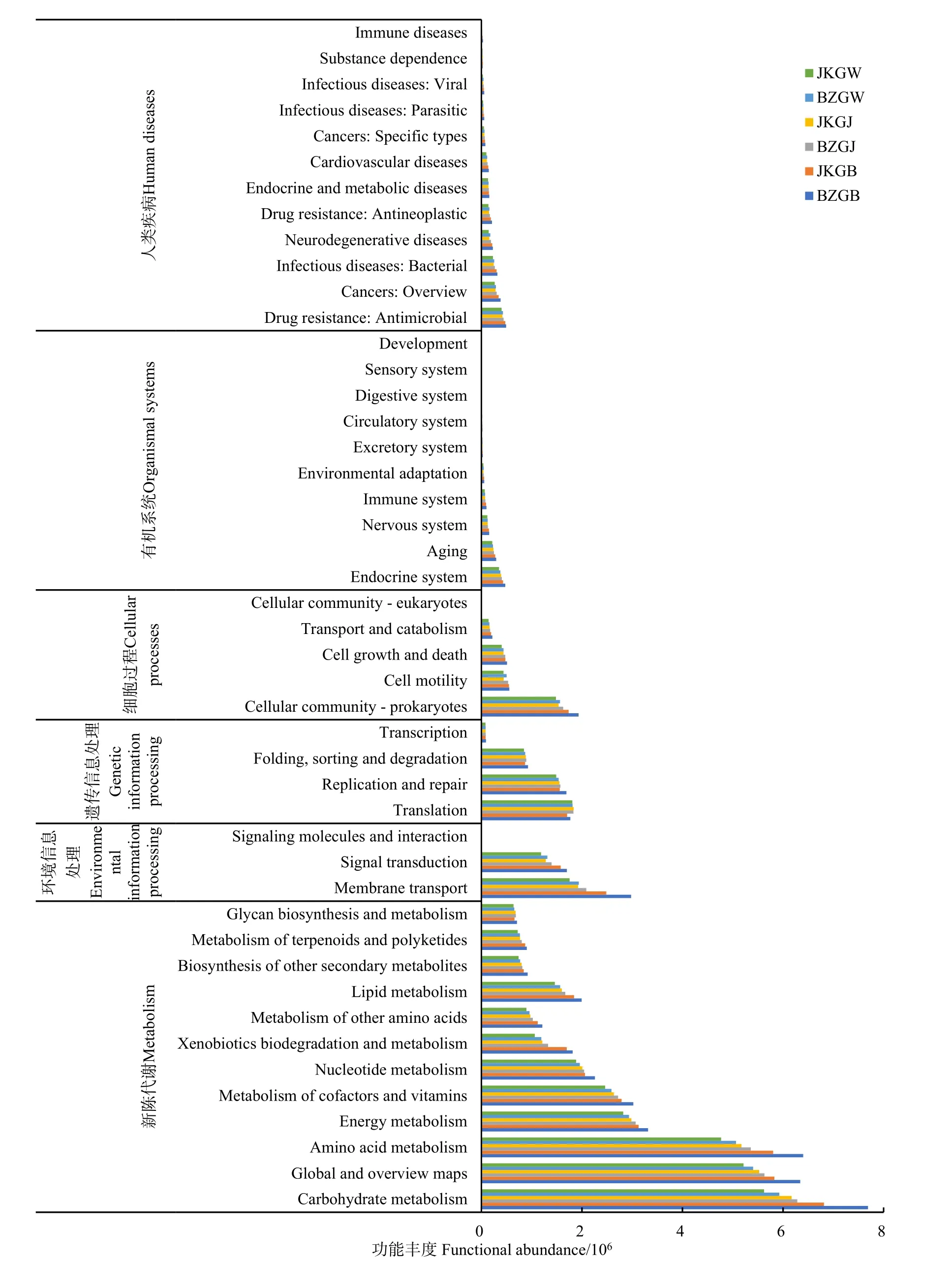
图6 细菌群落的功能预测Fig. 6 Function prediction of bacterial community
根据 FUNGuild功能预测可获得样品中真菌的功能分类及各功能分类在不同样品中的丰度信息(图7)。根据营养获取方式将真菌分为三大类:病理营养型、共生营养型和腐生营养型,基于这 3种营养方式,将对环境资源的吸收利用采取相似方式的划分为同一个guilds。属于Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Soil Saprotroph-Wood Saprotroph和Plant Pathogen这两个类群的功能丰度较高,这两个类群分别属于腐生营养型和病理营养型,其中Animal Pathogen- Endophyte-Lichen Parasite-Plant Pathogen-Soil Saprotroph-Wood Saprotroph对应的真菌只有Fusarium,Plant Pathogen对应的真菌有Plectosphaerella、Clonostachys、Lectera等。两个类群在患病株根表的功能丰度(26223)和根际的功能丰度(21779)远远大于健康株根表的功能丰度(8330)和根际的功能丰度(4547),在患病株根围部位的功能丰度(5174)的丰度小于健康株的根围功能丰度(9445)。
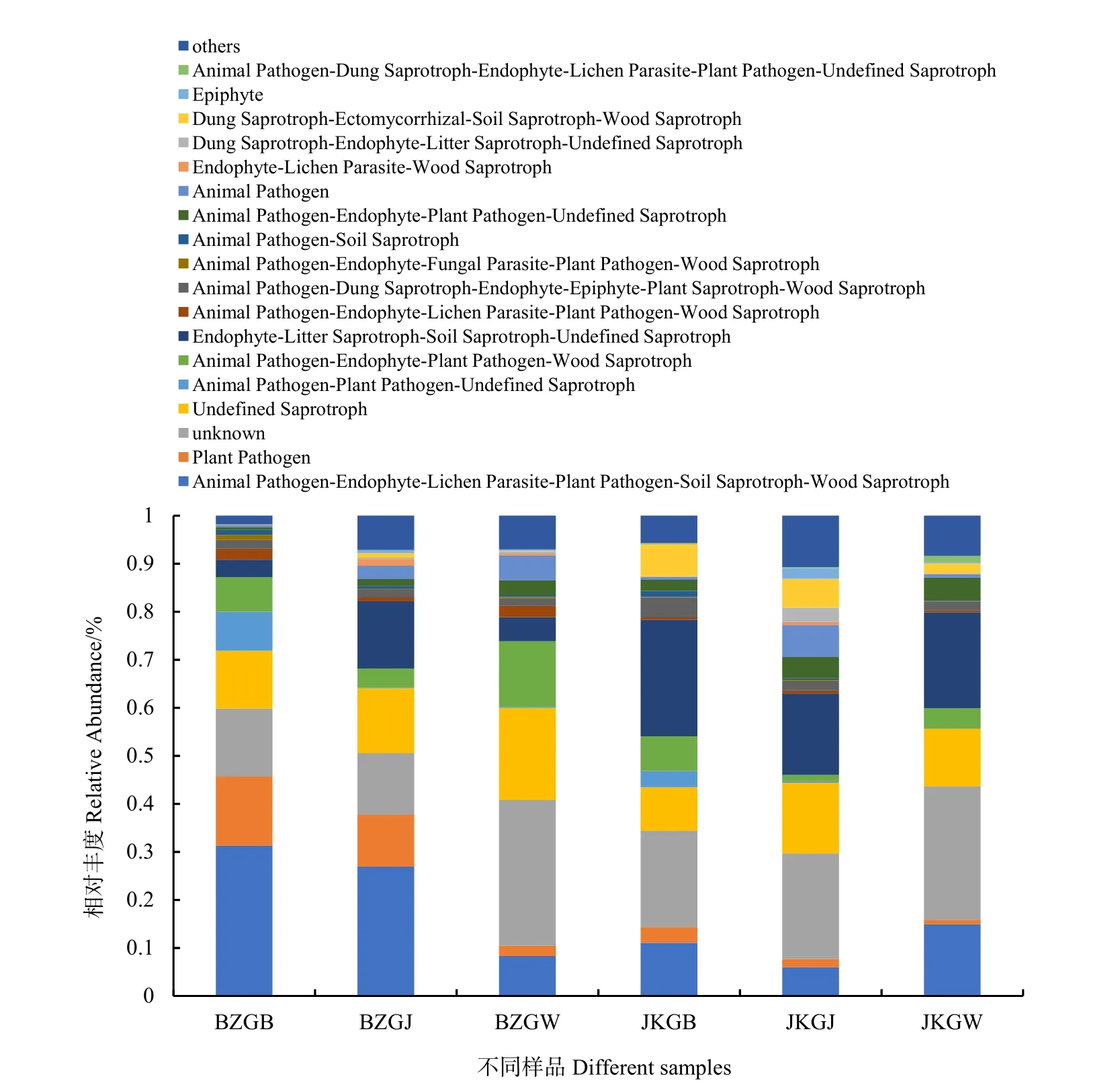
图7 真菌群落的功能预测Fig. 7 Function prediction of fungal community
3 讨论
土壤中的微生物与植物的土传病害关系密切(Bakker et al.,2010;郭瑞英等,2005),微生物群落失衡会导致植物感病,植株在感染病原菌后,微生物群落结构也会发生变化(Jeannotte et al.,2005)。本研究发现,患病株根表的真菌群落多样性低于健康株,这与根腐病引起的三七根际土壤真菌多样性变化一致(Wuet al.,2015);健康株和患病株根表、根际和根围细菌群落的丰富度、多样性和均匀度均无显著差异,而针对黄芪根腐病的研究发现,发病程度与根围土壤细菌群落的多样性呈正相关(闫欢等,2020),由此可见,根腐病发生与土壤微生物群落之间的关联不仅和植物类型有关,也可能与发病程度有关。一些研究表明病原真菌的积累是黄连根腐病发生的重要原因之一(陈姗姗等,2018),此外,建立在土壤和植物根系上的真菌群落似乎更容易受到随机因素的影响(Ylvaet al.,2011;Wanget al.,2013;Peayet al.,2010)。根系分泌物是植物与土壤微生物群落相互作用的关键介质(Vives-Periset al.,2020),健康株和患病株根表的真菌群落多样性差异大可能是根系分泌物所引起的。根系分泌物为植株和植物根系共生微生物形成了独特的生存微环境,这些微生物相当于植物与土壤的联系纽带,当靠近植株的微生物群落发生变化的时候,植株首先会感知到并释放分泌物,不同微生物会对植物根系释放的化合物有不同的反应(Bertrandet al.,2001)。
分析门水平和属水平上真菌和细菌群落结构组成发现,真菌群落中子囊菌门是绝对的优势门,Fusarium、Mortierella和Alternaria是主要的优势属,其中Mortierella在患病株 3个部位的平均丰度(7.67%)小于健康株(21.19%)。Mortierella是土壤中常见的有益微生物,与土壤肥力密切相关,能够产生多种生物活性物质,改善土壤健康状况,并有效促进植株的生长(Liet al.,2018),可能具有生防功能。这可能是Mortierella在健康株中的丰度较高的原因之一。Fusarium是子囊菌门的一类,是苜蓿(杨剑锋等,2020)、豌豆(Chittem et al.,2015)、大豆(Arias et al.,2013)和马铃薯(杨波等,2019)等多种作物根腐病的致病菌,李捷(2017)在甘肃枸杞根际土壤中也分离到了Fusarium且确定为致病菌。枸杞是多年生作物,产业化种植过程中,土壤一般都是单作土壤,极其容易造成土壤的同质性,这样就更容易导致更多潜在病原菌的累积,例如隶属于子囊菌门的Fusarium,本研究结果提示镰刀菌可能也是宁夏枸杞根腐病的主要致病菌之一。Alternaria同样被认为是造成作物病害的一种病原菌(高芬等,2008),多在植株叶斑或果实(Song et al.,2020;王彩霞等,2019;周园园等,2019)上分离得到,在枸杞上主要会引起枸杞干果霉变(岳苑等,2019),但还未有研究证实其为枸杞根腐病的致病菌。Arthrobacter是土壤中较为常见的细菌,其作为优势属在根表丰度最大且患病株根表的丰度大于健康株,在西洋参根腐病(蒋景龙等,2018)相关的群落变化研究中同样发现Arthrobacter节杆菌为优势属,与本研究有结果一致,推测其与宁杞1号根腐病的发生有一定的相关性。健康株和患病株的各样品有显著丰度差异的物种均不相同,产生这种差异的原因以及该差异与植株的关系值得研究。本研究中真菌群落结构的变化比细菌群落更为显著,而造成根腐病的主要病原菌多为真菌,因此,尽量限制真菌的传播,构建稳定的真菌群落非常重要,有利于从源头上控制根腐病的发生,益生微生物之间还可以相互“配合”,通过协同作用最大限度地获取土壤以及宿主体内的养分,促进植物的生长。
PICRUSt2分析得到新陈代谢、环境信息处理、遗传信息处理等六大类功能以及 46个二级功能,其中新陈代谢类的功能丰度较大,这与杨盼等(2020)对苜蓿根际土壤细菌群落功能预测分析的研究结果一致,这可能与植株的分泌物有关(Shiet al.,2011)。利用FUNGuild预测真菌群落的功能,结果表明属于腐生营养型的 Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Soil Saprotroph-Wood Saprotroph和Plant Pathogen这两个类群的功能丰度较高,其中Fusarium较高的功能丰度与其在群落组成中较高的丰度相对应,且患病株根表和根际的丰度大于健康株,功能分析进一步说明Fusarium可能是枸杞的关键致病菌。Plectosphaerella在三七(Hanet al.,2020)中首次被证明为致病菌,其会不会引起枸杞根腐病的发生有待进一步验证;而有益菌属Mortierella在健康株根表、根际和根围土壤的丰度均高于患病株,且并未在腐生营养型这个分类中,说明真菌群落组成和结构差异可能引起了其功能上的差异,进一步引起群落结构的失衡,最终可能导致宁杞1号根腐病的发生。
4 结论
患病株根表的真菌多样性显著低于健康株,而健康株和患病株根际、根围土壤的真菌多样性及根表、根际和根围土壤的细菌多样性差异不显著。Fusarium、Alternaria与Mortierella为宁杞1号枸杞根表、根际和根围土壤中的主要真菌群落,其中患病株根表和根际的Fusarium丰度最大,患病株根围的Mortierella丰度最大,健康株各部位的Mortierella丰度较大。细菌群落中变形菌门、放线菌门、绿弯菌门丰度较高,优势属Arthrobacter在患病株根表的丰度显著高于健康株。真菌群落中Fusarium的功能丰度最高,且Fusarium在患病株根表和根际的功能丰度大于健康株,与相应的物种组成丰度相一致,说明Fusarium可能是枸杞根腐病的关键致病菌。细菌群落中参与新陈代谢的功能丰度最大,患病株根表细菌的功能丰度大于健康株根表。基于群落组成与功能预测的分析共同说明了宁杞1号根腐病患病株根表的真菌多样性显著低于健康株,子囊菌门的Fusarium是患病株根表和根际的优势类群且功能丰度最大。

