饲料添加L-精氨酸或N-氨甲酰谷氨酸对黄颡鱼生长、肠道功能、血清生化指标和抗氨氮应激能力的影响
赵红霞 乔国贤,2 李培佳 陈晓瑛,3 陈 冰 黄 文* 曹俊明*
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.华中农业大学水产学院,武汉 430070;3.广州飞禧特生物科技有限公司,广州 510640)
高密度养殖、饲料过量投喂、水体更换少和饲料营养不平衡等是集约化养殖环境中的氨氮浓度升高的主要因素[1-2]。养殖水体中氨浓度的上升易导致水生动物的低存活率、代谢变化、氧化应激、免疫抑制和疾病[3-5]。因此,如何通过营养措施调控鱼虾免疫和抗病力受到广泛关注。精氨酸(Arg)作为底物参与一氧化氮、蛋白质和多胺的合成,并发挥重要的生物和生理功能,有助于增强动物机体的健康和促进发育。有研究表明,Arg能够提高养殖动物生产性能、调控蛋白质合成和信号转导、通过一氧化氮途径修复创伤、抑制炎症细胞因子表达、缓解氧化应激反应[6-9]。N-氨甲酰谷氨酸(NCG)是N-乙酰谷氨酸(NAG)的类似物,在动物体内能够作为前体物质合成Arg[10]。NCG是一种安全、代谢稳定的营养物质,在临床中对治疗一些与健康有关的疾病具有有益作用[11]。补充NCG可以刺激内源性Arg和瓜氨酸产生、促进肌肉蛋白质合成、提高生产性能和生长速度、调控信号通路和改变血浆Arg含量[12-14]。目前,NCG在水生动物方面的研究报道[15-19]较少。Arg和NCG对鱼类生长、肠道功能和免疫抗氧化方面的不同影响及作用差异尚未有见报道。
黄颡鱼(Pelteobagrusfulvidraco),鲶形目、鲿科、黄颡鱼属,杂食性温水鱼类。黄颡鱼分布范围广,除西部高原外,全国各水域均有分布。近年来,随着我国黄颡鱼规模化养殖不断增加,有关其健康状况和病害防治方面的研究也在不断加强。本实验室前期研究显示,黄颡鱼饲料中Arg的适宜添加水平为2.64%~3.01%,NCG的适宜添加水平为0.025%[19-20],在此基础上,本试验通过在饲料中添加Arg和NCG,研究Arg和NCG对黄颡鱼幼鱼生长、肠道健康、血清生化指标和抗氨氮应激能力的影响,比较Arg和NCG对黄颡鱼的作用效果,为Arg及NCG在黄颡鱼配合饲料中的应用提供相关的理论依据。
1 材料与方法
1.1 试验饲料
基础饲料中分别添加0(对照)、0.48%L-Arg(纯度≥99%,购自宁波某氨基酸工业有限公司)、0.025% NCG(纯度≥98%,购自某科技有限公司),配制3种等氮等脂(42%蛋白质和7%脂肪)试验饲料[20]。试验饲料组成及营养水平见表1。饲料原料粉碎后过60目筛,按照饲料配方要求准确称量,并逐级混匀后,加入鱼油、豆油和30%的水,再次混合均匀后,用双螺杆制粒机(SLX-80,华南理工大学科技实业总厂)挤压成粒径1.5 mm的颗粒饲料,55 ℃烘干,冷却后置于-20 ℃保存备用。
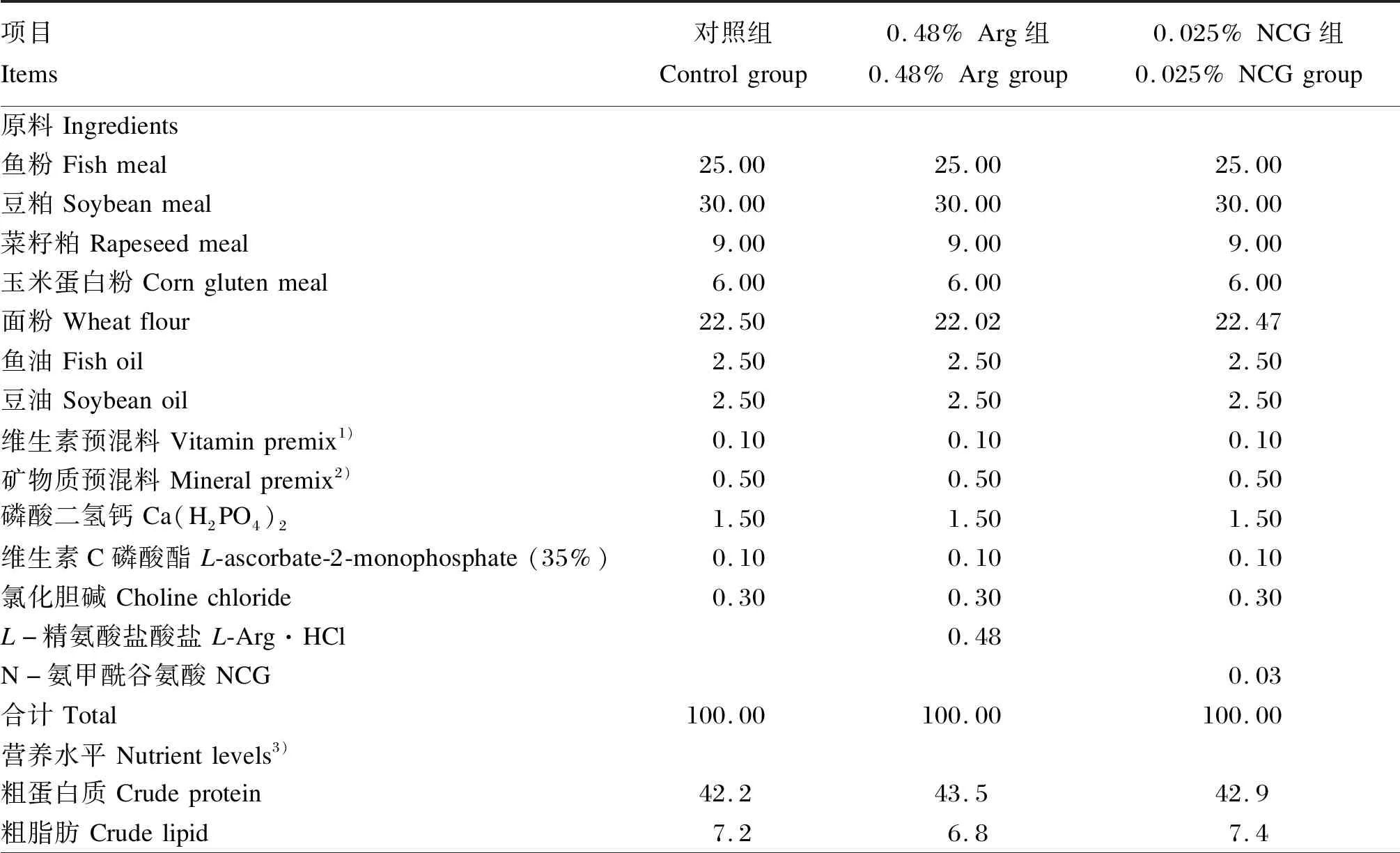
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
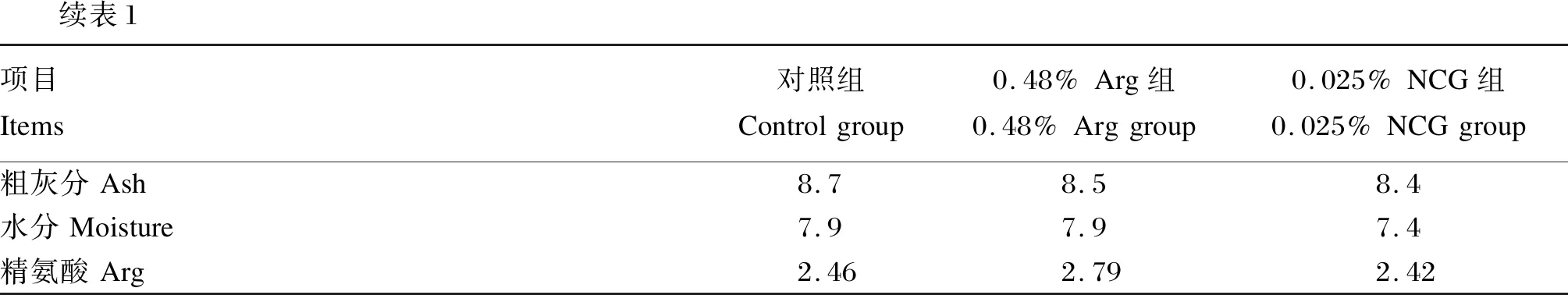
续表1项目Items对照组Controlgroup0.48%Arg组0.48%Arggroup0.025%NCG组0.025%NCGgroup粗灰分Ash8.78.58.4水分Moisture7.97.97.4精氨酸Arg2.462.792.42
1.2 试验设计及养殖管理
试验用黄颡鱼购自广州市锦龙渔业有限公司,试验养殖系统采取室内循环水养殖系统。黄颡鱼在室外水泥池中暂养2周,摄食40%蛋白质和7%脂肪的试验饲料,每天投喂2次。试验开始时,随机选取黄颡鱼幼鱼[(0.98±0.03)g] 480尾,按照试验设计分为对照组、0.48% Arg组和0.025% NCG组,每个组设置4个桶,每桶放鱼为40尾。按照黄颡鱼初始体重的4%~6%投喂试验饲料,每天投喂2次(08:30和18:30),观察黄颡鱼摄食情况,养殖期间不断调整投喂饲料量,养殖试验周期设置为56 d。黄颡鱼养殖试验桶采取玻璃纤维桶,桶的半径为80 cm,桶的高度为70 cm。试验期间根据养殖周期平均每周换水1次,并测定水体理化指标,养殖期间溶氧含量>6.0 mg/L,氨氮含量<0.20 mg/L,亚硝酸盐含量<0.01 mg/L,水温27~32 ℃,pH 7.4~7.9,试验采取自然光照。
1.3 样品收集
饲养试验结束后,黄颡鱼停止摄食24 h。每个养殖桶随机取8尾黄颡鱼,采用MS-222溶液(120 mg/L)麻醉处理,通过尾静脉采集血液,在4 000 r/min离心10 min,收集血液上清液部分作为血清样品,样品保存在-80 ℃的冰箱中。另外选取5尾黄颡鱼进行解剖,采集肝脏、肠道样品,并测定体长、体重和肝脏重。
1.4 指标测定
1.4.1 生长性能测定

式中:W0表示鱼体初始体质量(g);Wt表示鱼体终末体质量(g);N0表示初始鱼尾数;Nt表示终末鱼尾数;Wf表示饲料摄入量(g);Lt表示试验鱼终末体长(cm);t表示试验天数(d);Wg表示肝脏重(g);Wq表示全鱼重(g)。
1.4.2 饲料成分测定
饲料原料样品分析参照AOAC(1984)[21]的方法。105 ℃烘干法测定饲料水分含量,凯氏定氮法测定饲料粗蛋白质含量,索氏抽提法测定饲料粗脂肪含量,马弗炉灰化法测定饲料粗灰分含量。
1.4.3 血清、肠道生化指标测定
采用南京建成生物工程研究所试剂盒测定血清和肠道生化指标,测定指标包括:一氧化氮(NO)、补体3(C3)、补体4(C4)、免疫球蛋白M(IgM)、丙二醛(MDA)含量,总抗氧化能力(T-AOC),溶菌酶(LZM)含量,Na+K+-ATP酶(Na+K+-ATPase)、过氧化氢酶(CAT)、蛋白酶(trypsin)、脂肪酶(lipase)、淀粉酶(amylase)、超氧化物歧化酶(SOD)、精氨酸酶(ARG)、鸟氨酸脱羧酶(ODC)、二胺氧化酶(DAO)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮合酶(NOS)、诱导型一氧化氮合酶(iNOS)活性。
1.5 氨氮应激试验
56 d养殖试验结束后,从对照组、0.48% Arg组、0.025% NCG组的每个重复(n=4)中随机选取20尾健康黄颡鱼,采用氯化铵进行应激试验,总氨氮浓度达到100 mg/L。观察并记录黄颡鱼0、24、48、72 h内各组死亡情况,计算72 h内的累积死亡率(cumulative mortality rate,CMR)。
累积死亡率(%)=(应激后试验鱼死亡尾数/应激前试验鱼尾数)×100。
1.6 数据统计
试验数据用平均值±标准误(mean±SD;n=4)表示,采用SPSS 20.0软件进行统计分析。先对试验数据进行方差齐性检验,满足方差齐性条件则进行单因素方差分析(one-way ANOVA),差异显著再用Tukey’s检验方法进行多重比较;方差齐性条件不满足,则用Dunnett’s T3检验法进行多重比较。差异显著性水平为P<0.05。
2 结果与分析
2.1 生长性能
由表2可知,与对照组和0.48% Arg组相比,饲料中添加0.025% NCG显著提高了黄颡鱼增重率(P<0.05)。对照组和0.48% Arg组黄颡鱼的增重率没有显著差异(P>0.05)。各试验组黄颡鱼的饲料系数、存活率、肥满度和肝体比没有显著差异(P>0.05)。

表2 饲料中添加Arg或NCG对黄颡鱼生长性能的影响Table 2 Effects of dietary Arg or NCG on growth performance of yellow catfish (Pelteobagrus fulvidraco)
2.2 肠道消化酶活性
由表3可知,饲料中添加Arg或NCG显著影响黄颡鱼肠道蛋白酶和脂肪酶活性。与对照组和0.025% NCG组比,饲料中添加0.48% Arg显著增加了黄颡鱼肠道蛋白酶活性(P<0.05)。与对照组和0.48% Arg组相比,饲料中添加0.025% NCG显著提高了黄颡鱼肠道脂肪酶活性(P<0.05)。饲料中添加Arg或NCG对黄颡鱼肠道淀粉酶活性无显著影响(P>0.05)。

表3 饲料中添加Arg或NCG对黄颡鱼肠道消化酶活性的影响Table 3 Effects of dietary Arg or NCG on digestive enzyme activities of yellow catfish (Pelteobagrus fulvidraco)
2.3 肠道功能指标
由表4可知,饲料中添加Arg或NCG显著影响黄颡鱼肠道精氨酸酶、总一氧化氮合酶、诱导型一氧化氮合酶、二胺氧化酶和Na+/K+ATP酶活性(P<0.05)。与对照组和0.48% Arg组相比,饲料添加0.025% NCG显著提高了黄颡鱼肠道诱导型一氧化氮合酶活性(P<0.05)。0.025% NCG组黄颡鱼肠道精氨酸酶、总一氧化氮合酶和二胺氧化酶活性显著高于0.48% Arg组(P<0.05)。0.48% Arg组黄颡鱼肠道Na+/K+ATP酶活性显著高于0.025% NCG组(P<0.05)。饲料中添加Arg或NCG对黄颡鱼肠道鸟氨酸脱羧酶活性没有显著影响(P>0.05)。
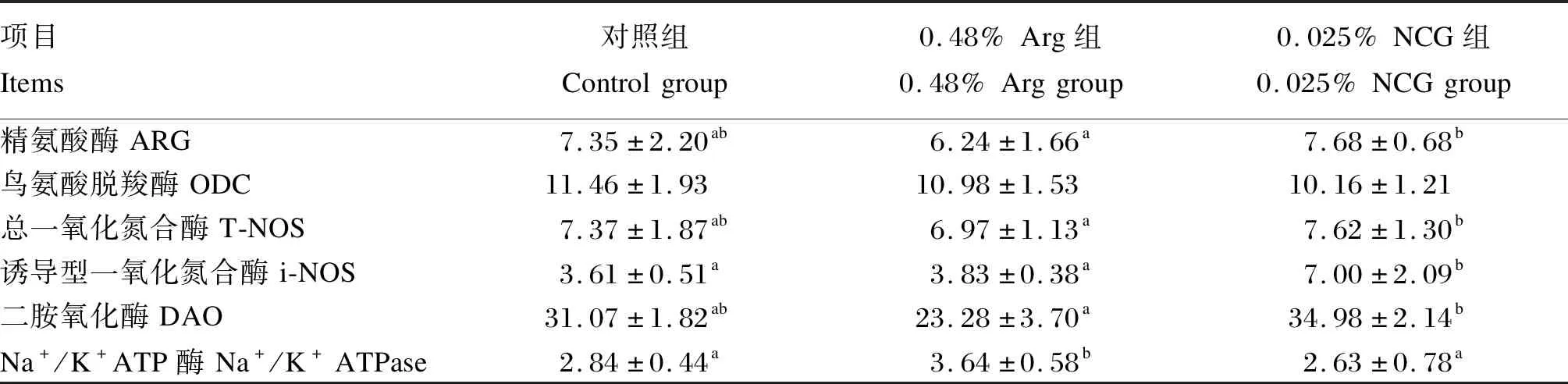
表4 饲料中添加Arg或NCG对黄颡鱼肠道功能指标的影响Table 4 Effects of dietary Arg or NCG on intestinal function indices of yellow catfish (Pelteobagrus fulvidraco) U/mg prot
2.4 血清免疫指标
由表5可知,与对照组相比,饲料中添加0.48% Arg或0.025% NCG显著增强了黄颡鱼血清溶菌酶含量(P<0.05)。0.025% NCG组黄颡鱼血清溶菌酶含量显著高于0.48% Arg组(P<0.05)。饲料中添加Arg或NCG对黄颡鱼血清一氧化氮、免疫球蛋白M、补体3、补体4含量无显著影响(P>0.05)。
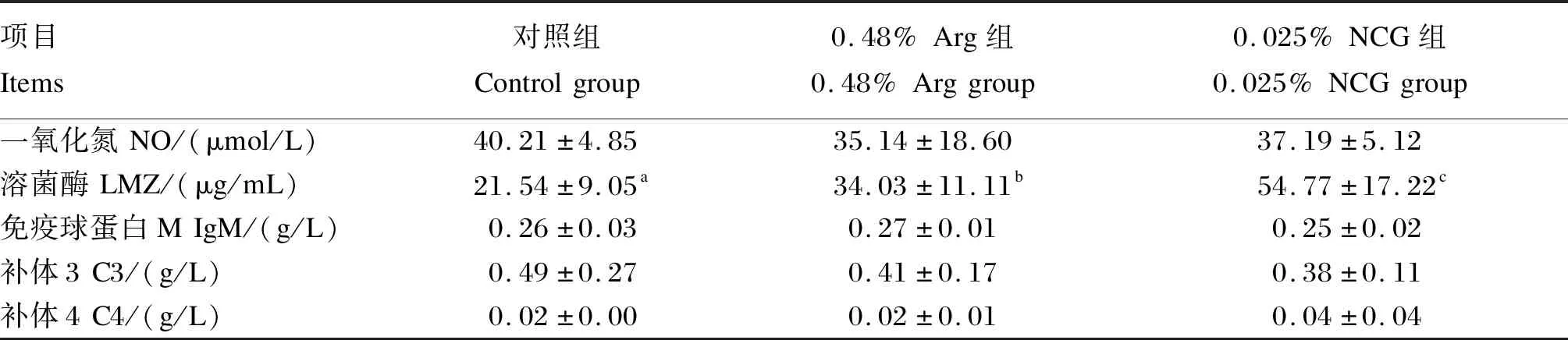
表5 饲料中添加Arg或NCG对黄颡鱼血清免疫指标的影响Table 5 Effects of dietary Arg or NCG on serum immune indices of yellow catfish (Pelteobagrus fulvidraco)
2.5 血清抗氧化指标
由表6可知,与对照组相比,饲料中添加0.025% NCG显著增强了黄颡鱼血清谷胱甘肽过氧化物酶活性(P<0.05)。0.48% Arg组黄颡鱼血清谷胱甘肽过氧化物酶活性与对照组、0.025% NCG组之间没有显著差异(P>0.05)。与对照组和0.48% Arg组相比,饲料中添加0.025% NCG显著增强了黄颡鱼血清总抗氧化能力(P<0.05)。饲料中添加Arg或NCG对黄颡鱼血清一氧化氮、免疫球蛋白M、补体3、补体4含量无显著影响(P>0.05)。

表6 饲料中添加Arg或NCG对黄颡鱼血清抗氧化指标的影响Table 6 Effects of dietary Arg or NCG on serum antioxidant indices of yellow catfish (Pelteobagrus fulvidraco)
2.6 抗氨氮应激能力
由表7可知,应激48 h时,与对照组相比,饲料中添加0.48% Arg或0.025% NCG显著了降低了黄颡鱼累计死亡率(P<0.05)。应激72 h时,与对照组相比,饲料中添加0.48% Arg或0.025% NCG显著降低了黄颡鱼累计死亡率(P<0.05);0.025% NCG组黄颡鱼累计死亡率显著低于0.48% Arg组(P<0.05)。
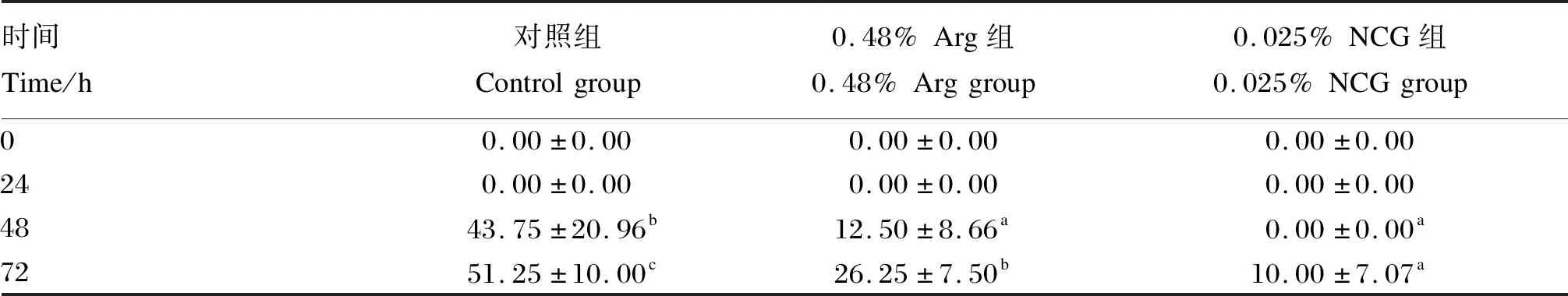
表7 饲料中添加Arg或NCG对黄颡鱼累计死亡率的影响Table 7 Effects of dietary Arg or NCG on cumulative motality rate of yellow catfish (Pelteobagrus fulvidraco) %
3 讨 论
Arg在调控动物生长和生理代谢中发挥着重要作用[22]。饲料Arg缺乏导致养殖动物生长迟缓、肠道和生殖功能障碍、免疫和神经发育受损和高血氨症,甚至死亡[23-24]。饲料补充0.2%和0.4% Arg能够提高仔猪血浆Arg含量和增重[25]。饲料Arg水平为2.74%时黄颡鱼的增重和饲料效率显著增加[26]。本试验中,补充0.48% Arg使饲料Arg含量达到2.79%,对黄颡鱼的增重率和饲料系数没有显著影响。但是本试验得到了另一个有趣而重要的结果,相同条件下在黄颡鱼饲料中添加0.025% NCG却能够显著提高黄颡鱼的增重率。饲料中添加NCG显著提高黄颡鱼增重率,可能黄颡鱼对NCG合成的内源Arg利用效率高于饲料添加的Arg。大鼠的饲料中添加1% Arg或0.1% NCG能够减少肝脏和血浆的氧化应激,0.1% NCG的作用效果优于1% Arg[27]。断奶仔猪饲料中添加0.6% Arg或0.08% NCG显著提高生长性能,促进肠道生长和完整性,并上调肠道热休克蛋白70(HSP70)的表达[28]。目前关于Arg或NCG在水产动物中作用效果的比较研究尚未见报道,关于Arg和NCG作用机制的差异还有待于进一步深入研究。
鱼类的生长与肠道消化、吸收能力休戚相关,肠道的消化酶和刷缘膜酶在营养物质的消化和吸收过程中发挥重要作用[29]。Arg及其代谢物通过促进组织完整性和细胞增殖对肠道产生有益影响[30]。本试验中,饲料中添加0.48% Arg显著增加了黄颡鱼肠道蛋白酶活性,0.025% NCG显著提高了黄颡鱼肠道脂肪酶活性,但Arg或NCG对黄颡鱼肠道淀粉酶活性没有显著影响。与本试验结果一致,仿刺参饲料中添加Arg显著增加肠道蛋白酶活性,但并不影响脂肪酶和淀粉酶活性[31]。建鲤饲料中补充Arg能够和改善肠道蛋白酶和脂肪酶活性,但并不影响淀粉酶活性[32]。杂交鲟饲料补充Arg增加肠道蛋白酶和淀粉酶活性[33]。Arg对不同鱼类消化酶的影响不尽相同,但关于NCG影响鱼类消化酶方面的研究较少。研究显示,罗非鱼饲料补充NCG促进了肌肉中的脂肪沉积[15]。Huang等[34]研究发现,NCG能够调控海鲈脂类代谢,通过促进脂类分解缓解脂肪肝症状。因此,饲料中添加Arg和NCG对黄颡鱼肠道消化酶的作用方式不同,Arg可能主要作用于肠道蛋白酶,促进蛋白质的消化吸收;NCG则通过提高肠道脂肪酶活性促进黄颡鱼对脂类的消化吸引和代谢,从而提高黄颡鱼生长性能。
Arg的代谢主要有2个途径,分别是精氨酸酶途径和一氧化氮合成酶途径。精氨酸酶途径是主要的代谢途径,Arg在精氨酸酶的催化下生成鸟氨酸和尿素,鸟氨酸在鸟氨酸脱羧酶的作用下生成多胺类物质。多胺在小肠黏膜的生长、发育、成熟以及适应性和损伤后的修复中具有重要作用[35]。本试验在饲料中添加0.025% NCG显著提高了黄颡鱼肠道精氨酸酶活性,表明NCG能够增强Arg在黄颡鱼体内的代谢,促进黄颡鱼肠道黏膜生长和发育,NCG的作用效果优于饲料中直接添加Arg。Arg另一条代谢途径是通过一氧化氮合酶产生一氧化氮,一氧化氮具有维持肠道功能的作用,如调节肠道免疫功能、促进肠道细胞的转移、改善肠道发育等[35]。本试验发现饲料添加0.025% NCG显著提高了黄颡鱼肠道总一氧化氮合酶和诱导型一氧化氮合酶活性。饲料中补充NCG显著增加了湖羊和大菱鲆NOS活性[16,36]。二胺氧化酶是小肠黏膜上层绒毛中具有高度活性的细胞膜内酶,其活性反映了黏膜细胞蛋白与核酸的合成和代谢[37]。本试验中饲料添加0.025% NCG显著提高黄颡鱼肠道二胺氧化酶活性,说明NCG在促进肠道黏膜生长方面有较好的作用效果。Na+K+-ATP酶具有产生维持膜电位、调控细胞内外离子成分和消化产物的跨上皮吸收等功能,在肠道营养物质转运方面具有重要的作用[38]。本试验条件下,饲料中添加NCG对黄颡鱼肠道Na+K+-ATP酶活性没有显著影响,但添加0.48% Arg显著提高了Na+/K+ATP酶活性。综上可知,饲料中添加NCG可以促进肠道黏膜生长发育和改善肠道功能,添加Arg可能有助于增强营养物质的转运和吸收。
溶菌酶是非常重要的抗菌物质,可以溶解细菌的细胞壁,激活补体旁路和吞噬细胞活性,参与非特异性免疫防御[39]。本试验中,饲料补充0.48% Arg或0.025% NCG显著提升黄颡鱼血清溶菌酶含量,NCG的作用效果优于Arg。鱼类细胞的氧化应激是由于超氧阴离子、羟自由基等活性氧过量产生引起,提高谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶和氧化物酶等的活性和产生还原型谷胱甘肽等抗氧化物质有助于减少活性氧的产量[40-41]。研究发现,Arg和NCG均可通过促进抗氧化酶活性及一氧化氮通路的激活来保护羔羊免受宫内生长受限诱导的肝脏氧化损伤[42]。本试验中,饲料添加0.025% NCG显著提高了黄颡鱼血清谷胱甘肽过氧化物酶活性和总抗氧化能力,NCG可能通过促进体内Arg合成,进而增强了黄颡鱼抗氧化能力。但是,饲料中添加0.48% Arg对黄颡鱼抗氧化能力却没有显著影响。本试验条件下,氨氮应激72 h时,饲料中添加0.48% Arg或0.025% NCG显著降低了黄颡鱼累计死亡率,0.025% NCG组黄颡鱼累计死亡率显著低于0.48% Arg组。NCG提高黄颡鱼抗氨氮应激能力的作用效果优于Arg,这与其在提高黄颡鱼免疫和抗氧化能力方面的研究结果一致。
4 结 论
综上所述,饲料中添加0.025% NCG显著提高了黄颡鱼体增重,肠道脂肪酶、总一氧化氮合酶、诱导型一氧化氮合酶、精氨酸酶、二胺氧化酶活性及血清谷胱甘肽过氧化物酶活性和总抗氧化能力,而饲料中添加0.48% Arg显著增加了黄颡鱼肠道蛋白酶、Na+/K+ATP酶活性。饲料中添加0.48% Arg或0.025% NCG显著增强了黄颡鱼血清溶菌酶含量,降低氨氮应激48和72 h累计死亡率。本试验条件下,结合生长性能、肠道健康、免疫、抗氧化功能指标综合评价,饲料中添加NCG的作用效果优于直接补充Arg。

