体外产气法比较不同活力屎肠球菌对绵羊瘤胃体外发酵的影响
白天天 崔浩然 蒋辰宇 周小玲,2 郭雪峰,2*
(1.塔里木大学动物科学学院,阿拉尔 843300;2.塔里木大学,新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔 843300)
屎肠球菌(Enterococcusfaecium)为自然界常见的乳酸菌,具有耐高温、黏附力强、耐胃酸和耐胆盐等特点[1-2],由于其在生产加工上的独特优势,广泛应用于畜牧业[3]。当前,屎肠球菌包含在《饲料添加剂品种目录(2013)》中,被允许在饲料中使用,其特有的安全无毒、无药残的特点,使其在饲料应用方面发展迅速。屎肠球菌在单胃动物上有大量研究,添加菌株后发现其具有促进断奶仔猪肠道发育、增强肠道[4]和提高肉仔鸡血清免疫球蛋白G(IgG)含量的作用[5];促进肉鸡脂类和蛋白质的合成代谢[6];提高感染致病菌的家禽免疫力,调整患病肉鸡肠道菌群,减缓鼠伤寒沙门菌对肉鸡的损伤[7]。屎肠球菌在反刍动物上的研究包括:减少牦牛肠道内毒素含量与尿素酶活性[8];提高犊牛平均日增重和料重比,提高泌乳中、后期奶牛瘤胃氨态氮(NH3-N)浓度[9],降低腹泻率与死亡率,维持肠道微生物平衡[10]。乳酸菌具有产生乳酸的能力[11],反刍动物酸中毒与乳酸的产生积累有关[12],而添加不同活力的屎肠球菌是否对瘤胃产生影响的研究还未见报道。因此,本试验研究不同活力的屎肠球菌对绵羊瘤胃体外发酵参数的影响,为屎肠球菌在绵羊上的应用提供参考。
1 材料与方法
1.1 试验菌株
屎肠球菌F11.1G为塔里木大学畜牧科技重点实验室筛选菌株,于中国典型培养物保藏中心保藏(保藏号:M 2020793)。乳酸菌培养使用MRS培养基,pH为6.8[13]。
1.2 试验动物及饲粮
瘤胃液采集的试验动物是3只体重为(35±3)kg、安装瘘管的卡拉库尔羊。每日09:00和20:00分2次定量饲喂,自由饮水。依据《肉羊饲养标准》配制基础饲粮,基础饲粮以玉米和苜蓿颗粒为主要原料,其组成及营养水平见表1,精粗比为60∶40。
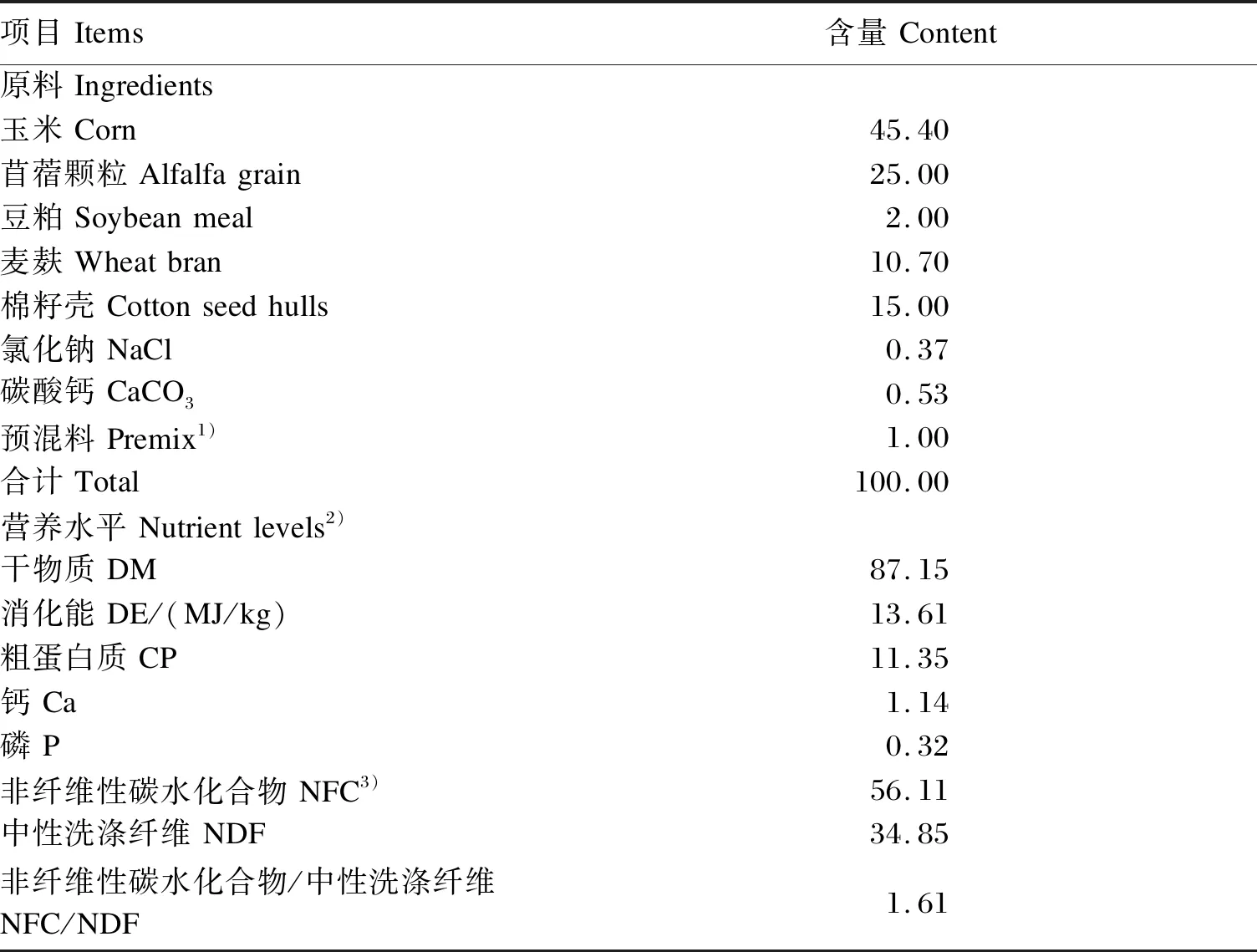
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.3 试验设计
本试验共有4个组,分别为对照组、试验1组、试验2组和试验3组,各组分别添加0、1×1012、1×1011和1×1010CFU/mL的屎肠球菌,基础饲粮粉碎过40目作为发酵底物,每个组6个重复,共24个注射器,在3、6、12、24、36和48 h读取产气量,在24和48 h时进行干物质降解率、pH和NH3-N、挥发性脂肪酸(VFA)浓度的测定。
1.4 人工瘤胃培养液配制
缓冲液采用Menke等[14]方法制备并通入二氧化碳至无色,然后置水浴锅中保温备用,晨饲前2 h采集瘤胃液,经4层纱布过滤后与缓冲液以1∶2比例均匀混合制成培养液。
1.5 体外发酵培养及样品的处理
准确称取0.2 g发酵底物和屎肠球菌发酵液,置于玻璃注射器(规格为100 mL,可读刻度为1 mL)顶端,并设置3个重复。在39 ℃恒温数显水浴摇床中振荡培养,吸取30 mL培养液并密封的注射器。在3、6、12、24、36和48 h读取产气量,测定24和48 h培养液的pH,离心后取上清液用于NH3-N和VFA浓度测定。
1.6 指标测定
屎肠球菌活力:参照郭雪峰等[15]方法进行检测;总产气量:读取注射器上的刻度进行测定;pH:通过希玛牌便携式pH测试笔测定;VFA浓度:参照丁学智等[16]方法,采用GC-2014气相色谱仪测定;干物质降解率:采用赵超等[17]方法进行测定;NH3-N浓度:采用冯宗慈等[18]方法进行测定。
1.7 数据处理
试验数据采用SPSS 26.0软件的one-way ANOVA进行方差分析,差异显著采用Duncan氏法进行多重比较,用平均值±标准差表示。P<0.05表示差异显著。
2 结果与分析
2.1 添加不同活力屎肠球菌对体外产气量的影响
由表2可知,各组产气量在发酵初期增长迅速,呈上升趋势,各组产气量显著高于对照组(P<0.05),试验2组和试验3组差异不显著(P>0.05),在发酵3~12 h时,试验3组的产气量显著高于试验1组(P<0.05),在发酵24 h时,各试验组产气量差异不显著(P>0.05)。
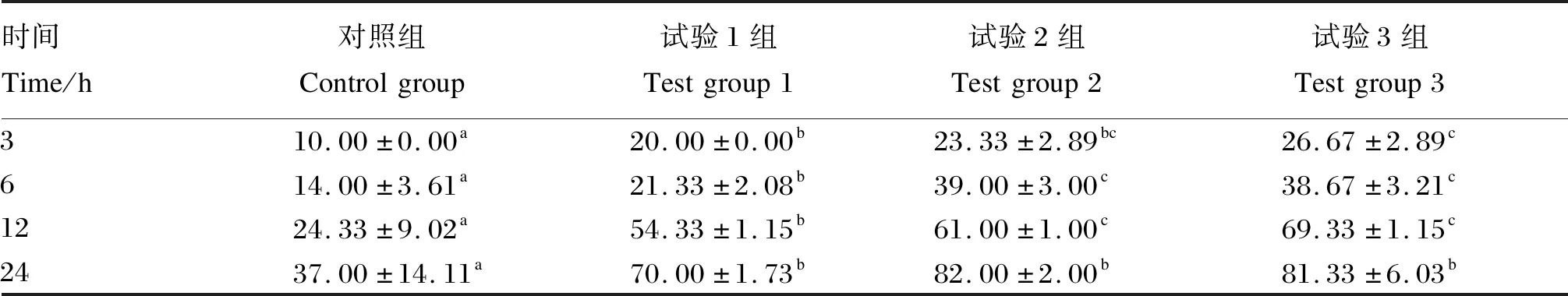
表2 不同活力屎肠球菌对体外产气量的影响Table 2 Effects of different activities of Enterococcus faecium on gas production in vitro
2.2 添加不同活力屎肠球菌对培养液pH的影响
由表3可知,各组pH在整个发酵过程中均呈逐渐下降的趋势。在发酵24和48 h时,各组pH显著低于对照组(P<0.05),试验3组的pH为最低,各组之间差异不显著(P>0.05)。试验3组在发酵48 h时pH最低,为6.35。

表3 不同活力屎肠球菌对培养液pH的影响Table 3 Effects of different activities of Enterococcus faecium on pH of rumen fluid
2.3 添加不同活力屎肠球菌对干物质降解率的影响
由表4可知,各试验组随着发酵时间的增长,各组干物质降解率均显著高于对照组(P<0.05),各组之间差异显著(P<0.05)。在发酵24 h时,试验3组的干物质降解率显著高于对照组、试验1组和试验2组(P<0.05)。在发酵48 h时,试验3组的干物质降解率显著高于对照组、试验1组和试验2组(P<0.05)。

表4 不同活力屎肠球菌对干物质降解率的影响Table 4 Effects of different activities of Enterococcus faecium on degradation rate of dry matter %
2.4 添加不同活力屎肠球菌对培养液NH3-N浓度的影响
由表5可知,在试验开始初期,各组NH3-N浓度呈上升趋势,在发酵24 h时,试验3组的NH3-N浓度显著高于对照组(P<0.05),但与试验1组和试验2组差异不显著(P>0.05),此时对照组NH3-N浓度是11.67 mg/dL,为最低;在发酵48 h时,各组的NH3-N浓度与对照组相比,差异不显著(P>0.05),试验3组的NH3-N浓度最高,为27.18 mg/dL。

表5 不同活力屎肠球菌对培养液NH3-N浓度的影响Table 5 Effects of different activities of Enterococcus faecium on concentration of NH3-N in rumen fluid mg/dL
2.5 添加不同活力屎肠球菌对培养液VFA浓度的影响
由表6可知,在发酵24 h时,试验2组的乙酸浓度显著高于其他各组(P<0.05),但与对照组差异不显著(P>0.05),在发酵48 h时,试验2组和试验3组的乙酸浓度显著高于其他组(P<0.05);在发酵24 h时,试验组1的丙酸含量显著高于对照组和其他各组(P<0.05),在发酵48 h时,试验2组丙酸浓度最高,试验1组和试验2组显著高于对照组(P<0.05);在发酵24 h时,对照组的丁酸浓度最低,试验2组的丁酸浓度显著高于对照组和试验组3(P<0.05),在发酵48 h时,试验1组的丁酸浓度显著高于其他各组(P<0.05),但与对照组差异不显著(P>0.05);在发酵24 h时,试验1组和试验2组的总VFA浓度显著高于对照组(P<0.05),在发酵48 h时,试验2组和试验3组的总VFA浓度显著高于对照组(P<0.05);发酵24 h时的试验2组和发酵48 h时的试验3组的乙酸/丙酸均高于对照组,但差异不显著(P>0.05)。

表6 不同活力屎肠球菌对培养液VFA浓度的影响Table 6 Effects of different activities of Enterococcus faecium on concentration of VFA in rumen fluid
3 讨 论
3.1 不同活力屎肠球菌对培养液产气量的影响
瘤胃微生物消耗可溶性碳水化合物等营养物质产生气体,主要是代谢产物,如氢气、二氧化碳、甲烷、低级脂肪酸等[19],一定程度上反映瘤胃微生物对发酵底物利用的程度。由本试验结果可见,添加屎肠球菌于瘤胃液体外发酵能显著促进底物发酵,添加屎肠球菌的各组产气量显著高于对照组,0~24 h的产气量增加迅速,24~48 h时的产气量呈缓慢上升状态,其中添加了1×1010CFU/mL屎肠球菌对于体外发酵产气量的影响最为明显。推测可能是屎肠球菌进入瘤胃环境中迅速增殖,成为优势菌种,促进营养物质的消化[20],促进产气,而添加活力的大小会影响产气的多少,但活力过高的屎肠球菌的进入影响了瘤胃微生物的平衡,反而不利于瘤胃内容物的消化。
3.2 不同活力屎肠球菌对培养液pH的影响
瘤胃pH正常范围维持在6.0~7.5,与瘤胃内营养物质的消化利用息息相关,pH的变化与反刍动物唾液分泌、瘤胃食糜外流速度、瘤胃发酵产酸以及瘤胃上皮对VFA的吸收有关[21-22]。本试验各组pH在整个发酵过程中呈下降趋势,添加屎肠球菌可以显著降低培养液pH,pH的降低可能与屎肠球菌发酵积累乳酸、乙酸等有关[23],人们发现,瘤胃在pH降至5.0~5.5时,反刍动物常常出现亚临床酸中毒,而当pH低于5.0时,急性酸中毒则会发生[24],在本试验中通过测定确定培养液pH为6.35~7.37,处于瘤胃发酵pH的正常范围内,此结果说明,添加1×1012、1×1011和1×1010CFU/mL的屎肠球菌,并不会影响瘤胃酸碱内环境守恒。
3.3 不同活力屎肠球菌对培养液干物质降解率的影响
干物质降解率的高低,反映了饲料综合营养素的可消化特性,是评价不同饲料饲用价值高低的重要指标,越高越有利于动物的生长和生产[25]。在本试验中,添加屎肠球菌组的干物质降解率均显著高于对照组,而运用体外产气法研究屎肠球菌对瘤胃发酵指标的报道较少。根据本试验结果可以推断屎肠球菌由于其对肠道菌群的有益作用,而提高了瘤胃对饲料的消化。
3.4 不同活力屎肠球菌对培养液NH3-N浓度的影响
瘤胃消化发酵饲料会产生NH3-N,因此,瘤胃NH3-N反映蛋白质和碳水化合物降解情况,而瘤胃微生物可以利用NH3-N合成菌体蛋白,反映瘤胃微生物与菌体蛋白的合成情况[26]。由本试验结果显示,添加屎肠球菌可以促进NH3-N产生,其原因可能是屎肠球菌进入瘤胃后降低pH使得以氨为唯一氮源维持生长的瘤胃细菌受到抑制,致使NH3-N浓度上升[27]。在发酵24 h时,添加1×1010CFU/mL屎肠球菌后培养液的NH3-N浓度显著提高,这与聂炼等[9]的结果一致。添加1×1010CFU/mL的屎肠球菌更利于瘤胃微生物生长。
3.5 不同活力屎肠球菌对培养液VFA浓度的影响
VFA是动物生长、繁殖与泌乳等基本活动的主要能量来源之一,其浓度变化直接影响反刍动物对营养物质的吸收、利用和生产能力等[28]。乙酸是反刍动物体内脂肪合成的主要前体物,丙酸是唯一能净生成葡萄糖的VFA,足够的丙酸能满足动物对葡萄糖的需要[29]。在本试验中添加屎肠球菌后发现乙酸浓度有所增加,姜艳美等[30]将屎肠球菌液添加至奶牛饲粮中发现,其瘤胃内乙酸浓度有所提高。刘星[31]接种乳酸菌和酵母菌进行奶牛体外发酵试验发现乙酸、丙酸和丁酸浓度高于对照组,与本试验结果一致。添加屎肠球菌组的总VFA浓度高于对照组,可能是因为丙酸浓度高于对照组,此结果证实接种乳酸菌于培养液中进行体外发酵能够影响VFA的产生量,对VFA的组成产生一定影响。在本试验中,添加不同活力屎肠球菌后,各组总VFA浓度均升高,说明屎肠球菌可以增强瘤胃发酵功能,促进底物发酵,产生更多的VFA。添加1×1012CFU/mL屎肠球菌组的丙酸浓度高于乙酸浓度,可能与高活力屎肠球菌产酸较多,抑制纤维降解菌和纤维素酶活性[32],使乙酸产量降低,瘤胃液发酵趋于丙酸发酵型有关[29],说明添加微生物发酵饲料能改变瘤胃的发酵类型,从而提高了瘤胃发酵的能量利用率。
3.6 添加低活力屎肠球菌对瘤胃体外发酵效果评价
添加高活力的屎肠球菌较低活力屎肠球菌对瘤胃体外发酵效果差的原因可能是在瘤胃发酵液中添加高活力的屎肠球菌,使屎肠球菌在短时间内成为优势菌,与瘤胃内其他微生物争夺营养物质并产生乳酸,乳酸迅速产生堆积在发酵液中使内环境pH短时间内快速降低[29,31-33],卢德勋[34]认为促进纤维素消化的适宜瘤胃液pH范围为6.0~6.8,pH过低时,纤维分解菌生长就会受到抑制。前人研究发现,瘤胃内微生物的活力与pH的变化具有很大的关系。可能是因为养分的耗尽和瘤胃内环境pH的变化使得瘤胃内屎肠球菌和其他微生物活力降低,反过来又影响瘤胃内NH3-N的利用和干物质降解率。很多研究表明,瘤胃内的pH过高,可能会降低胃蛋白酶活性,以及影响蛋白质的消化率,益生菌会影响瘤胃内pH,从而提高瘤胃蛋白酶、淀粉酶和纤维素酶的活性[35]。这与试验3组发酵24 h时的干物质降解率显著高于对照组一致。乳酸菌还对维持瘤胃的环境产生积极的效应,如产生多种抑菌物质如细菌素,抑制瘤胃内有害的厌氧微生物生长,蛋白质分解减慢,并竞争性抑制有害菌黏附,与肠道黏膜形成稳定的生物屏障[4],高活力的屎肠球菌进入瘤胃后成为优势菌群,可能会产生大量细菌素抑制瘤胃微生物的正常生长,导致瘤胃内原有稳态结构被破坏。因此,屎肠球菌在瘤胃液中的添加量要适度。
4 结 论
本试验结果表明添加屎肠球菌至发酵液中可以提高产气量、干物质降解率及NH3-N和VFA浓度,降低发酵液pH。通过各项指标分析比较,建议屎肠球菌在绵羊体内的添加活力为1×1010CFU/mL。

