细绒型和粗绒型陕北白绒山羊瘤胃细菌结构及组成
李陇平 刘锦旺 李 托,3 朱海鲸 屈 雷*
(1.榆林学院陕西省陕北绒山羊工程技术研究中心,榆林 719000;2.榆林市三农养殖服务有限公司,榆林 719000;3.榆林学院生命科学学院,榆林 719000)
陕北白绒山羊是以辽宁绒山羊为父本,当地陕北黑山羊为母本,经过20多年培育而成,2002年通过品种审定,2003年被农业部正式命名的以产绒为主、绒肉兼用的绒山羊新品种,具有绒毛品质上乘(羊绒细度13 μm左右)、单位体积产容量高、繁殖力较高、适应性强和羊肉品质好等优点,深受陕北当地农户及养殖户的推崇。据榆林市统计局数据,2019年榆林市陕北白绒山羊饲养规模近800万只,其中存栏455.7万只、出栏339.1万只,产绒2 915.6 t,占全省90%以上、全国10%左右[1-2]。陕北白绒山羊已经是陕北地区畜牧业发展的重要产业,对于农民增收、农村发展、农业增效、区域经济发展和农民脱贫致富具有不可替代的重要作用。近些年,随着陕北白绒山羊在陕北地区以及周边地区养殖数量和养殖规模的不断扩大,绒产量得到了很大的提高,据报道,成年母羊的产绒量从2001年的(430.37±76.80)g增加到了2007年的(703.16±36.08)g,产绒量增加了63.04%[3-4]。这种绒产量在短期内迅速增加主要是通过人们广泛利用绒产量较高绒山羊进行杂交改良的结果。然而,在养殖户通过引进一些粗绒高产的绒山羊追求绒产量不断提高的同时,羊绒细度也从2001年的(14.30±0.13)μm增加到了2007年的(15.27±1.18)μm[3-4]。除了陕北白绒山羊的绒纤维直径有不断变粗的趋势外,内蒙古白绒山羊也存在绒纤维直径变粗的类似问题[5]。绒纤维直径的变粗是山羊绒细度向着不利于其加工和生产方向的变异,造成生产加工成本上升,导致绒品质以及纺织价值的降低,最终降低羊绒的市场竞争力。因此,如何在不显著影响绒产量的前提下,通过科学育种手段以及饲料营养调控技术,降低陕北白绒山羊群体的绒纤维直径、提高羊绒品质,最终实现优质优价,成为新时代背景下做大做强陕北白绒山羊品牌的重大难题。细度是判断山羊绒纤维最重要的指标之一,是衡量山羊绒品质的最重要因素[6]。根据之前的研究报道,影响羊绒细度的主要因素包括遗传[7]、营养[4,8]、性别和年龄[9]、繁殖和环境等[10-12]。其中,遗传方面的研究表明,辽宁绒山羊绒细度性状具有较高的群体遗传力(0.43~0.73),个体遗传力为0.225,尽管个体遗传力较低,但是通过遗传育种手段提高群体遗传力的选择方法是有效的,缺点就是培育新品种的时间较长,且性状退化的问题也需要重视[8]。另外,关于羊绒细度相关的非编码RNA[13-15]和羊绒细度性状全基因组关联分析[16]近几年也有较多的研究报道。关于羊绒细度影响因素中营养和饲料方面的研究较少,目前普遍认可的观点为,羊绒生长期加强营养对于产绒量的提高是有积极作用的,但是对于绒细度是不利的[4,8,11,17]。有研究表明,不同能量与蛋白质水平的饲粮对陕北白绒山羊瘤胃微生物区系和代谢组学均产生影响[18]。但是,关于细绒型和粗绒型陕北白绒山羊瘤胃微生物组成结构及差异的研究未见到相关报道,缺乏细绒型和粗绒型陕北白绒山羊对饲料营养物质吸收利用的深入机制研究。针对以上问题,本研究拟采用高通量测序技术,揭示同样饲料和饲养条件下细绒型和粗绒型陕北白绒山羊瘤胃细菌结构与组成,该研究结果能增强人们对细绒型绒山羊瘤胃微生物的一些适应性变化规律的认识和理解,为今后通过饲粮调控细绒型绒山羊瘤胃微生态提供参考。
1 材料与方法
1.1 试验设计及样品采集
在陕西省子洲县老君殿镇陕西应马安养殖有限公司细绒型陕北白绒山羊育种基地选择处于相同饲养、管理及环境条件下的陕北白绒山羊母羊13头,所有试验羊年龄均在2岁左右,体重相近,根据绒细度分为细绒组[A01~A06,(13.69±0.18)μm,n=6]和粗绒组[B01~B07,(19.75±0.58)μm,n=7]。其中,6只细绒型陕北白绒山羊平均体重为(40.65±1.84)kg,7只粗绒型陕北白绒山羊的平均体重为(40.63±1.63)kg。所有试验羊饲喂相同的试验饲粮,饲粮精粗比为40∶60,试验饲粮组成及营养水平见表1。晨饲后2 h,用胃管式瘤胃液采样管采集所有试验动物的瘤胃液[19],采集的瘤胃液用4层纱布过滤后,迅速放入液氮中,立即带回实验室转移至-80 ℃超低温冰箱保存备用。
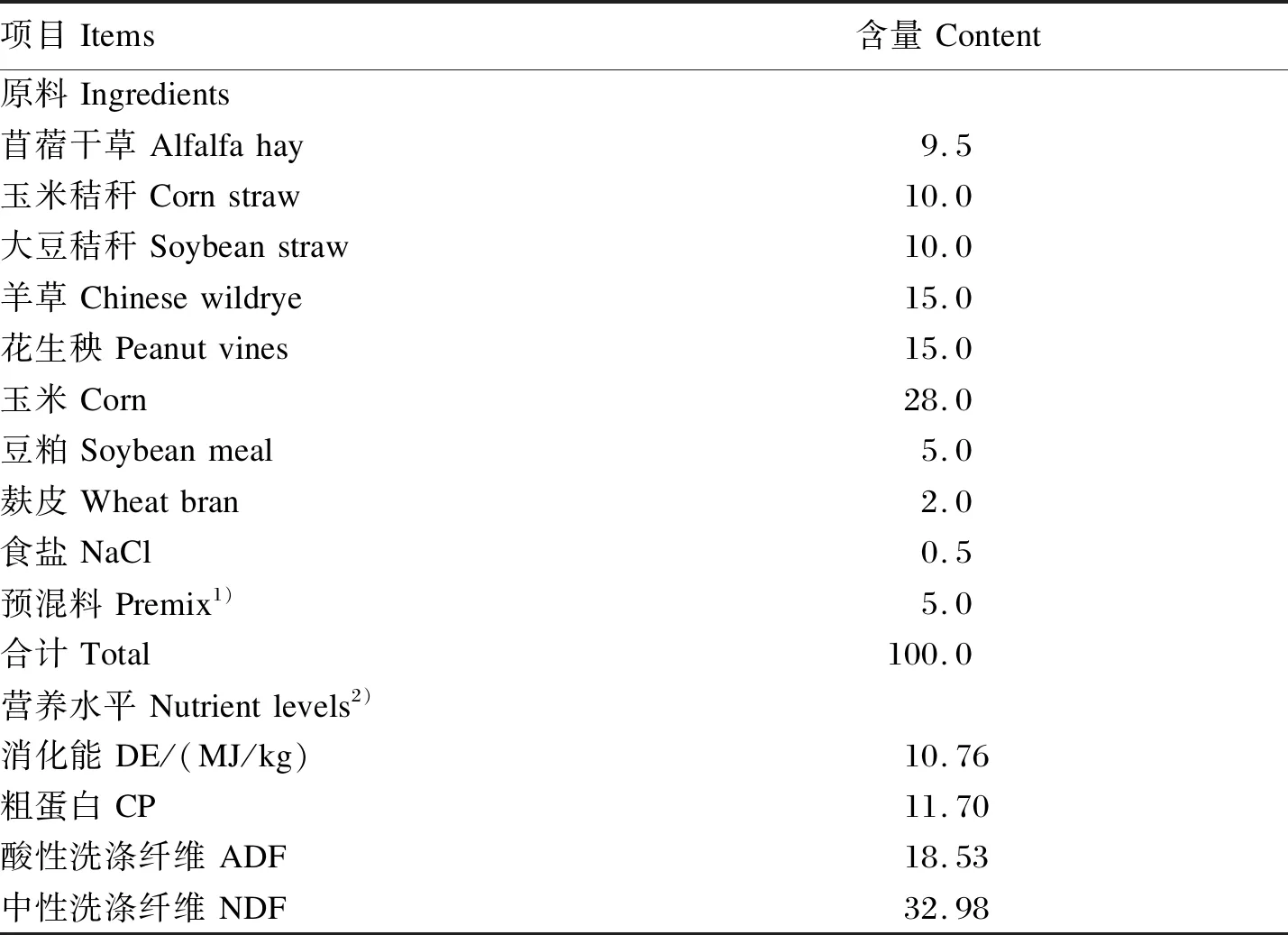
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the experimental diet (DM basis) %
1.2 样品DNA提取和PCR扩增
1.3 Illumina MiSeq测序

1.4 数据统计分析
用qiime tools import插件,将原始序列fastq文件导入为可进行QIIME2后续处理的文件格式。然后运用QIIME2 dada2插件进行质控、修剪、去噪、拼接以及去除嵌合体后,得到最终的特征序列表格[20]。接着,运用QIIME2 feature-classifier插件将ASV的代表序列比对到预先训练好的13_8版本99%相似度的GREENGENES数据库(根据338F/806R引物对将数据库修剪到V3~V4的区域),设置比对阈值为70%,得到物种分类信息表[21]。之后用QIIME2 feature-table插件剔除所有污染性的线粒体和叶绿体序列。运用DEseq2方法来鉴定分组和样本间丰度有差异的细菌[22],利用R语言工具制作Rank-Abundance曲线图解释物种丰度和物种均匀度;运用Mothur(Version v.1.30.1)软件进行指数分析,反映菌群的相对丰度和多样性;QIIME2 core-diversity插件计算多样性矩阵,进行Alpha多样性分析。基于样本中主要微生物物种相对丰度,使用共现网络分析(co-occurrence analysis)计算斯皮尔曼等级相关系数用于了解物种之间的关联。
2 结果与分析
2.1 样品测序深度和操作分类单元(OTU)数量分析
使用QIIME2软件中的dada2插件对所有样品的全部原始序列进行质量控制,去噪纠正测序错误的序列、拼接,并且去嵌合体,形成OTU,表2显示了该过程各个步骤之后剩余序列数目。本试验一共得到491 343条有效序列(clean data),平均每个样品含(37 795±5 219)条。将有效序列进行聚类,共得到4 862个OTU 。2组间共享OTU数为1 297个,细绒组独有的OTU数为1 686个,粗绒组独有的OTU数为1 879个(图1)。

图1 OTU维恩图Fig.1 Venn diagram of OTU
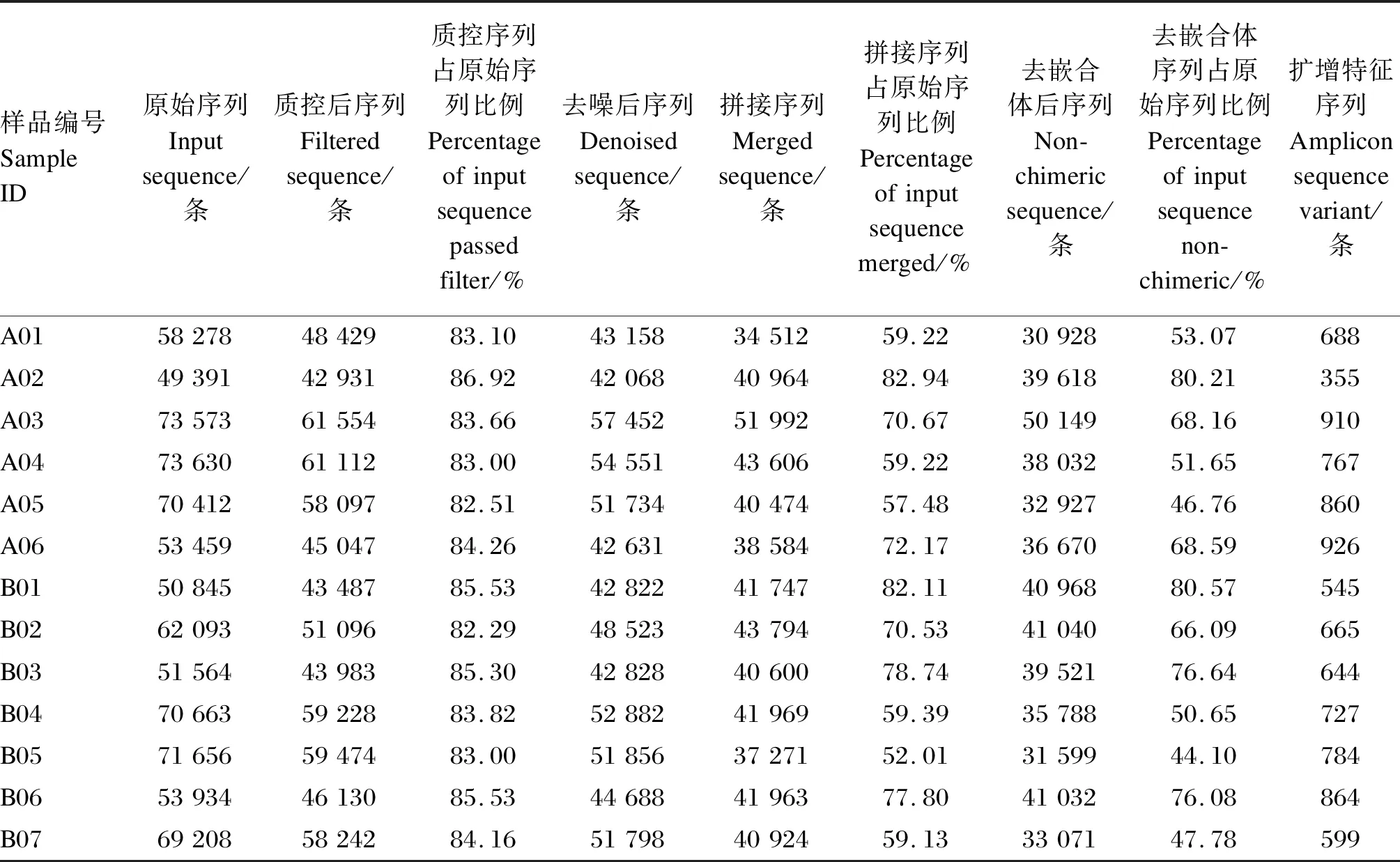
表2 样本数据量统计Table 2 Statistics of sample data
2.2 样品稀释曲线和Alpha多样性分析
通过16S rRNA基因测序质控筛选后进行测序深度检测,图2显示各样品的稀释曲线最终均趋于平缓,说明本试验的测序数据量足够大,测序深度覆盖了各个样品的绝大多数微生物。对粗绒型和细绒型陕北白绒山羊瘤胃细菌的Alpha多样性指数进行组间差异分析,结果见表3。Chao1指数、Observed_OTU指数、Shannon指数、Faith’s PD和Simpson指数均表现为细绒组低于粗绒组,但2组之间差异均不显著(P>0.05)。

表3 绒山羊瘤胃菌群的Alpha多样性和丰富度分析Table 3 Analysis of Alpha diversity and richness of ruminal microbial communities of cashmere goats
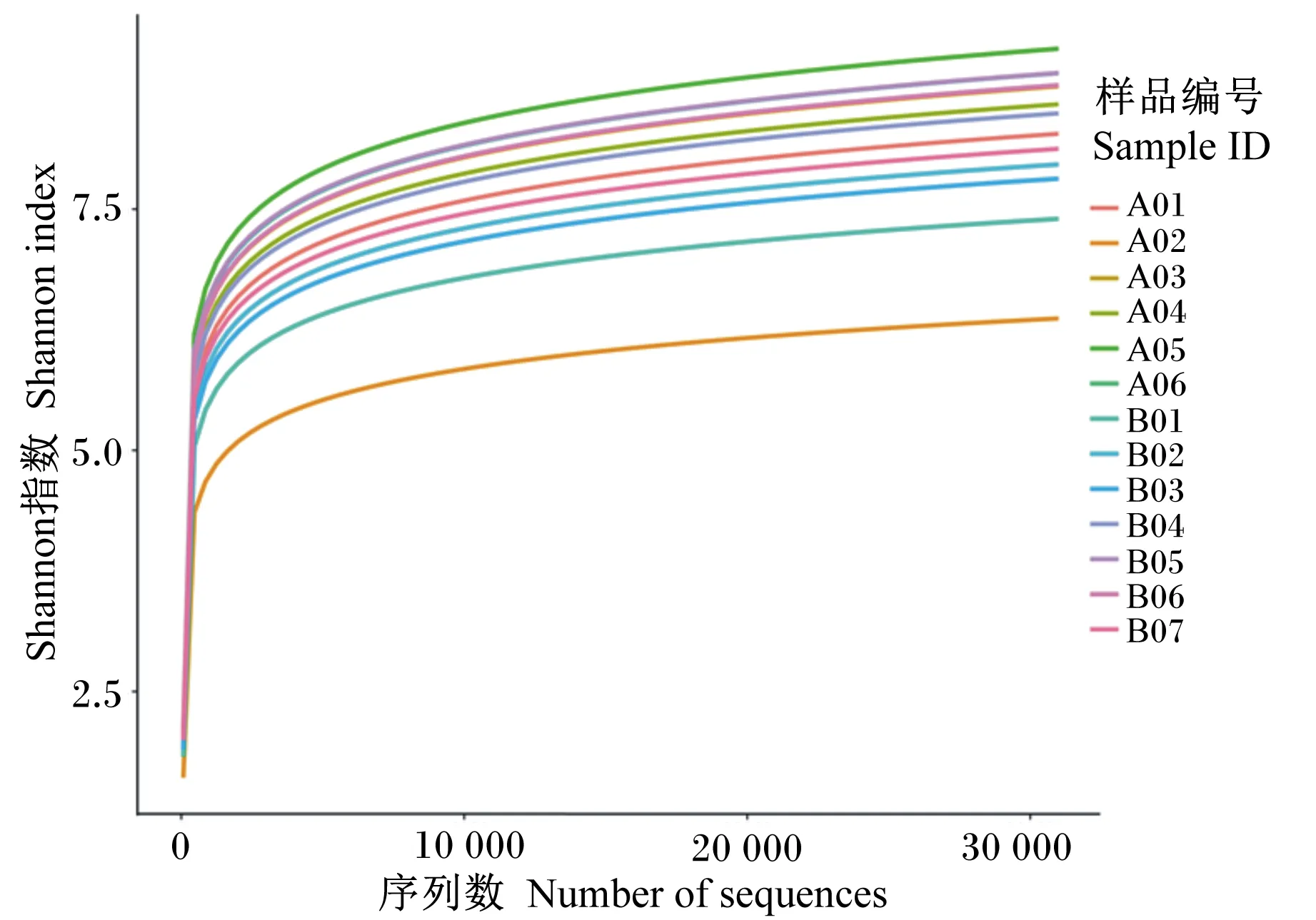
图2 样品的稀释曲线Fig.2 Rarefaction curves of samples
2.3 同水平物种组成
将有效序列在不同分类水平上进行物种注释,结果共得到23个门,39个纲,59个目,76个科,95个属。图3和图4展示了不同组中OTU在门分类水平和属分类水平上的注释情况。

图3 瘤胃细菌在门水平上的组成(相对丰度前20)Fig.3 Composition of rumen bacteria at phylum level (top 20 of relative abundance)
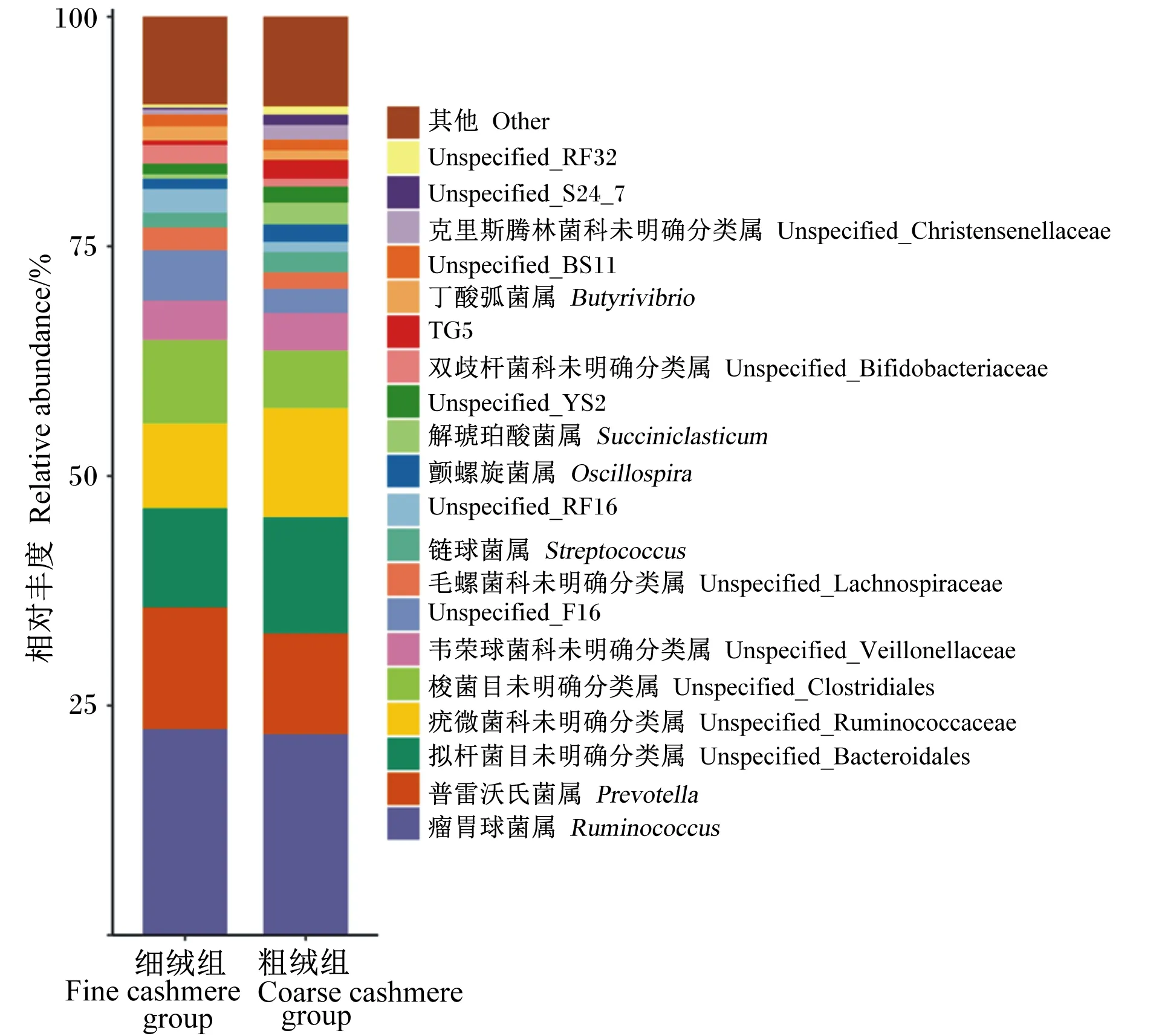
图4 瘤胃细菌在属水平上的组成(相对丰度前20)Fig.4 Composition of rumen bacteria at genus level (top 20 of relative abundance)
2.3.1 门水平
无论细绒组还是粗绒组,优势菌门均主要是由厚壁菌门[Firmicutes,(57.43±2.11)%]和拟杆菌门[Bacteroidetes,(29.68±1.46)%]组成,两者占整个菌群的87%以上;次级优势菌门为TM7[(4.06±2.01)%]、放线菌门[Actinobacteria,(2.71±0.92)%]、蓝藻细菌门[Cyanobacteria,(1.45±0.42)%]、变形菌门[Proteobacteria,(1.38±0.75)%]、互氧菌门[Synergistetes,(1.27±0.11)%]、螺旋体门[Spirochaetes,(0.59±0.13)%]、软壁菌门[Tenericutes,(0.44±0.10)%]、未明确分类细菌[Unspecified_Bacteria,(0.42±0.14)%]和疣微菌门[Verrucomicrobia,(0.26±0.09)%];其余相对丰度低于0.10%的门类被聚到一起。
2.3.2 属水平
瘤胃球菌属[Ruminococcus,(22.19±0.39)%]、普雷沃氏菌属[Prevotella,(12.10±1.62)%]、拟杆菌目未明确分类属[Unspecified_Bacteroidales,(11.72±1.22)%]和疣微菌科未明确分类属[Unspecified_Ruminococcaceae,(10.54±1.87)%]是细绒组和粗绒组瘤胃中相对丰度较高的优势菌属;次要优势菌属均低于10%,主要包括梭菌目未明确分类属[Unspecified_Clostridiales,(7.68±1.99)%]、韦荣球菌科未明确分类属[Unspecified_Veillonellaceae,(4.19±0.16)%]、Unspecified_F16[(4.06±1.02)%]、毛螺菌科未明确分类属[Unspecified_Lachnospiraceae,(2.14±0.47)%]、链球菌属[Streptococcus,(1.90±0.41)%]、Unspecified_RF16[(1.84±1.03)%]、颤螺旋菌属[Oscillospira,(1.51±0.55)%]、双歧杆菌科未明确分类属(Unspecified_Bifidobacteriaceae)[(1.46±0.83)%]、Unspecified_YS2[(1.45±0.42)%]、解琥珀酸菌属[Succiniclasticum,(1.43±1.33)%]、丁酸弧菌属[Butyrivibrio,(1.31±0.36)%]、TG5[(1.23±0.11)%]、Unspecified_BS11[(1.21±0.09)%]和克里斯滕森菌科未明确分类属[Unspecified_Christensenellaceae,(1.09±0.76)%]等;其余相对丰度低于1%的菌属被聚集一起。
2.4 物种差异性分析
表3列出了在门水平上细绒组和粗绒组间相对丰度存在显著差异的细菌(相对丰度大于0.01%)。比较细绒组和粗绒组绒山羊瘤胃细菌差异性发现,Firmicutes、Bacteroidetes、TM7、Actinobacteria、Cyanobacteria、Proteobacteria、Synergistetes、Spirochaetes、Tenericutes和Unspecified_Bacteria等这些相对丰度排在前10位且占总数99%以上的菌门中,除了粗绒组Proteobacteria的相对丰度显著高于细绒组(P<0.05)和细绒组TM7的相对丰度显著高于粗绒组(P<0.05)外,其余菌门的相对丰度2组之间均差异不显著(P>0.05);除此之外,粗绒组迷踪菌门(Elusimicrobia)、黏胶球形菌门(Lentisphaerae)、SR1和Verrucomicrobia的相对丰度均显著高于细绒组(P<0.05),而粗绒组WPS_2的相对丰度显著低于细绒组(P<0.05)。
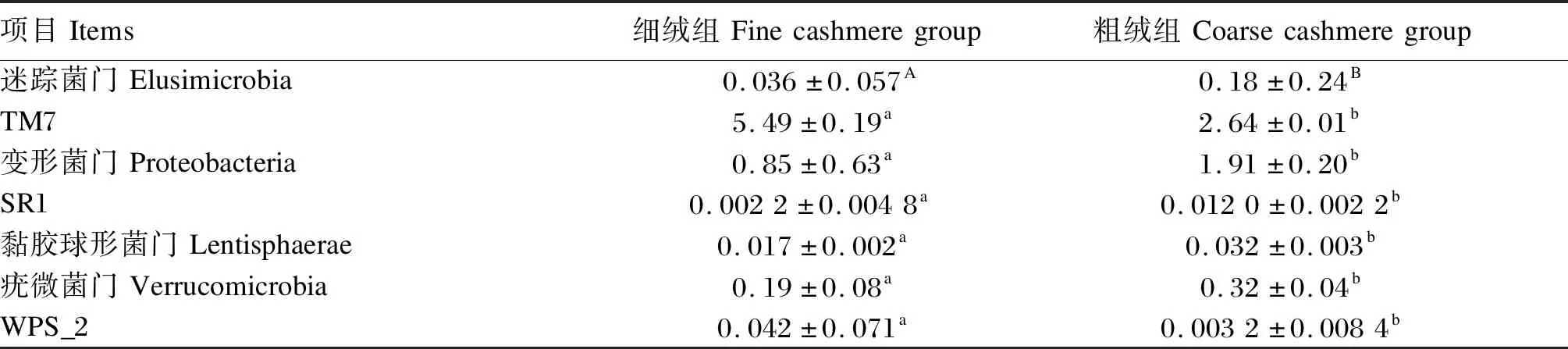
表3 在门水平上细绒组和粗绒组间相对丰度存在显著差异的细菌Table 3 Relative abundance of bacteria at phylum level with significant difference between fine cashmere group and coarse cashmere group %
表4列出了在属水平上细绒组和粗绒组间相对丰度存在显著差异的细菌(相对丰度大于0.01%)。相对丰度大于10%的优势菌属Ruminococcus、Prevotella、Unspecified_Bacteroidales和Unspecified_Ruminococcaceae中,除了细绒组Prevotella的相对丰度极显著高于粗绒组(P<0.01)以外,其他3个主要菌属的相对丰度2组间均差异不显著(P>0.05)。另外,相对丰度低于10%的次要优势菌属中,粗绒组Oscillospira和Succiniclasticum的相对丰度显著高于细绒组(P<0.05)。属水平上其他菌属,包括Dehalobacterium、Erysipelotrichaceae p_75_a5、Blautia、梭菌属(Clostridium)、欧文氏菌属(Erwinia)的相对丰度均呈现出粗绒组显著高于细绒组(P<0.05)。

表4 在属水平上细绒组和粗绒组间相对丰度存在显著差异的细菌Table 4 Relative abundance of bacteria at genus level with significant difference between fine cashmere group and coarse cashmere group %
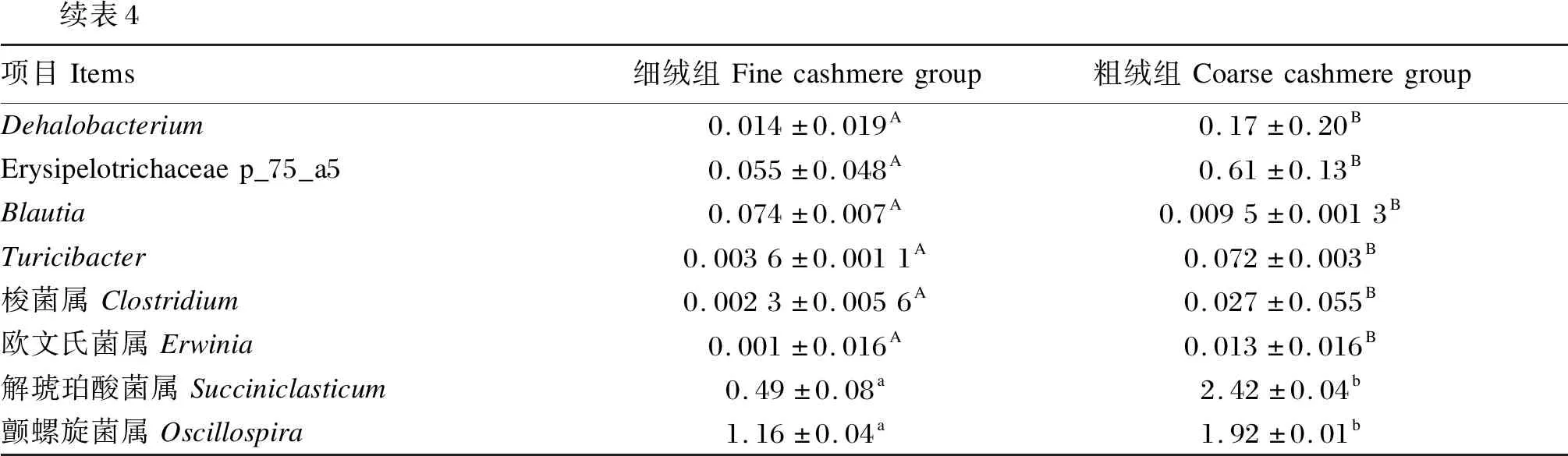
续表4项目Items细绒组Finecashmeregroup粗绒组CoarsecashmeregroupDehalobacterium0.014±0.019A0.17±0.20BErysipelotrichaceaep_75_a50.055±0.048A0.61±0.13BBlautia0.074±0.007A0.0095±0.0013BTuricibacter0.0036±0.0011A0.072±0.003B梭菌属Clostridium0.0023±0.0056A0.027±0.055B欧文氏菌属Erwinia0.001±0.016A0.013±0.016B解琥珀酸菌属Succiniclasticum0.49±0.08a2.42±0.04b颤螺旋菌属Oscillospira1.16±0.04a1.92±0.01b
2.5 物种相关性网络分析
通过计算属水平菌属之间的相关性,分析细绒组和粗绒组绒山羊瘤胃菌属(相对丰度排前30位的菌属)的相互关系发现,不同菌属之间和同菌门不同菌属之间相互作用模式中,细绒组绒山羊瘤胃中发生相互作用的微生物数目和互作关系高于粗绒组,即细绒组绒山羊瘤胃微生物的的紧密性高于粗绒组绒山羊(图5)。其中,粗绒组在属水平上有31个呈正相关和8个呈负相关关系的物种;细绒组在属水平上有38个呈正相关和44个呈负相关关系的物种。
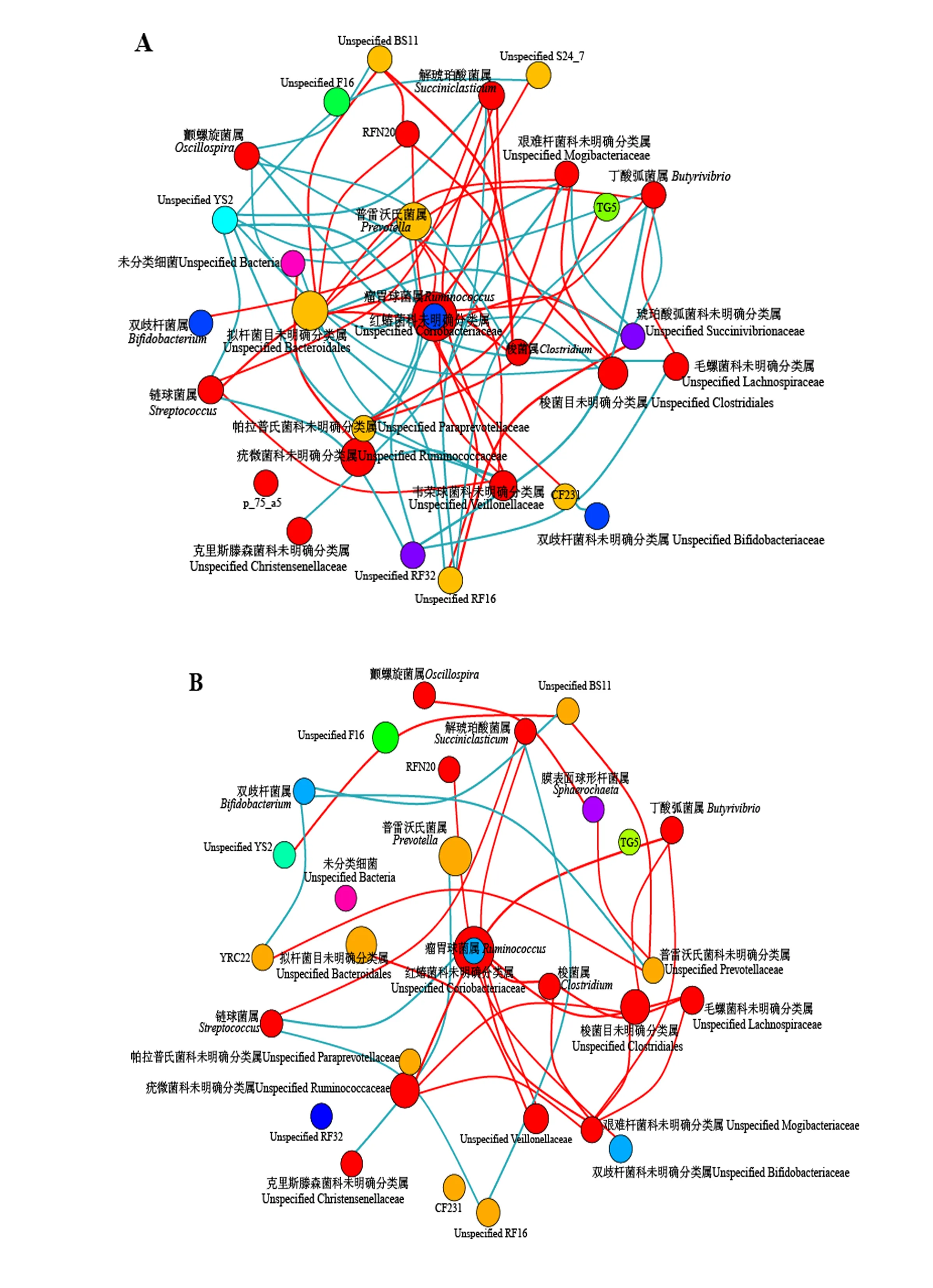
图A和B分别为细绒组和粗绒组。红线表示正相关;蓝线表示负相关。Figures A and B represented fine cashmere group and coarse cashmere group,respectively.Red and blue lines mean positive and negative correlation,respectively.图5 绒山羊瘤胃细菌属水平Co-occurrence网络图(相关系数阈值为0.5)Fig.5 Co-occurrence network of rumen bacteria at genus level of cashmere goats (correlation coefficient threshold of 0.5)
3 讨 论
山羊绒是绒山羊皮肤次级毛囊生长的无髓纤维,是高档精纺原料,绒纤维的细度是衡量绒品质好坏的重要标志[23]。遗传、营养、年龄、性别和环境是影响绒山羊绒纤维直径的主要因素[10-12]。其中,影响绒细度遗传方面的研究[7,13-16,24]近几年较多,但关于影响绒细度的营养和其他因素的研究较少。以前对于产绒量低于300 g的国外绒山羊品种的研究表明,提高饲粮蛋白质水平,增加了饲粮蛋白质和含硫氨基酸的摄入量,可以提高绵羊和安哥拉山羊绒的直径和长度,但是绒山羊绒的生长对营养调控的反应截然相反,即提高饲粮营养水平对羊绒细度和直径没有显著影响,只能增加体重和粗毛生长[25]。然而,对于产绒量500 g以上的中国高产绒山羊,饲粮营养水平对山羊绒直径及绒产量的影响却有着完全不同的效应,具体表现为在维持需要基础上改善饲粮蛋白质水平可显著促进绒毛生长,即在能量不受限制并存在遗传潜力的前提下,如果氨基酸平衡,增加饲粮可消化蛋白质的数量可以提高我国绒山羊的产绒性能[25]。孙海洲等[26]设计了不同能量和蛋白质水平梯度的饲粮,研究表明,高能量和高蛋白质水平饲粮显著提高绒山羊产绒量,山羊绒细度各组之间有差异,但是差异不显著,其中蛋白质水平对羊绒生长起主要作用。彭玉麟[27]对内蒙古白绒山羊的研究表明,饲粮蛋白质水平对山羊绒的产绒量产生了显著影响,随着饲粮蛋白质水平的提高,绒细度有变粗的趋势。宋先忱等[8]的研究也表明,在其他条件相同的情况下,高能量和高蛋白质水平饲粮组的辽宁绒山羊的绒纤维粗,低能量低蛋白质水平饲粮组的辽宁绒山羊的绒纤维细。整体上来看,有关我国绒山羊绒品质的营养研究报道甚少,世界范围内的深层次研究也不多见。目前的观点认为高能量高蛋白质水平特别是高可消化蛋白质水平饲粮会使绒山羊的绒纤维变粗,低营养水平饲粮使绒纤维变细。虽有研究显示不同饲粮能量与蛋白质水平饲粮对陕北白绒山羊瘤胃微生物区系和代谢组学均产生了影响[18],但关于细绒型和粗绒型陕北白绒山羊瘤胃微生物组成结构及差异的研究未见到相关报道,缺乏细绒型和粗绒型陕北白绒山羊对饲料中营养物质吸收消化利用的深入研究。因此,本研究采用高通量测序技术,揭示同样饲喂条件下细绒型和粗绒型陕北白绒山羊瘤胃细菌结构、组成及差异,以增强人们对细绒型和粗绒型陕北白绒山羊瘤胃微生物变化规律的认识和理解,为通过饲粮调控细绒型陕北白绒山羊瘤胃微生物提供参考。
Alpha多样性是对某个样品中物种多样性的分析,包含样品中的物种组成的丰富度和均匀度2个因素,通常用Observed_OTU指数、Shannon指数以及Faith’s PD指数来评估某个样品的物种多样性,数值越高,表明样品的多样性越复杂。Observed_OTU指数是指样本中实际测定得到的OTU数量,是衡量样品中OTU丰富度的指数。Shannon指数的计算考虑到样品中的分类总数和每个分类所占的比例。Faith’s PD指数是基于系统发生树来计算的一种多样性指数,它用各个样品中OTU的代表序列计算出构建系统发生树的距离,是将某一样品中的所有代表序列的值加和,从而得到的数值。Chao1指数通过观测到的结果推算出一个理论的丰富度,此丰富度更接近真实的丰富度,是用来反映物种丰富度(物种的种类数量)的指标。本研究中关于细绒型和粗绒型陕北白绒山羊瘤胃细菌的Alpha多样性分析结果表明,各组间Faith’s PD指数、Chao1指数、Shannon指数和Observed_OTU指数均呈现出粗绒组高于细绒组,但差异不显著,说明细绒型陕北白绒山羊瘤胃中微生物种类和多样性低于粗绒型绒山羊。本研究结果显示,细绒型和粗绒型陕北白绒山羊瘤胃细菌组成存在差异。
本研究发现,2组陕北白绒山羊瘤胃细菌中相对丰度较高的菌门均是Firmicutes和Bacteroidetes。但是唐鹏[18]和李碧波[28]在对饲粮能量与蛋白质水平对陕北白绒山羊瘤胃微生物区系影响研究中发现,门分类水平下占比最高的为Bacteroidetes、Firmicutes和Proteobacteria,此结果与本研究结果存在差异。造成这些差异的原因可能与试验饲粮和试验动物年龄的不同有关。研究表明,随着年龄的增长,反刍动物瘤胃微生物区系会发生较大变化[29]。门水平物种差异性结果表明,相对丰度排在前10位且占总数99%以上的菌门中,粗绒组Proteobacteria的相对丰度显著高于细绒组。大量研究证实,Proteobacteria里面含有一些致病菌,一定程度上反映了微生态失调或不稳定的胃肠道微生物群落结构[30-31]。结合物种关联性共现网络分析发现,粗绒组陕北白绒山羊瘤胃菌属之间发生相互作用的微生物数量较少、微生物相互之间的紧密性较差,整体上菌群稳定性较弱,可能与Proteobacteria相对丰度较高有一定的关联性。
在属水平上,Ruminococcus和Prevotella是2组陕北白绒山羊瘤胃中相对丰度较高的优势菌属,且粗绒组Prevotella的相对丰度极显著低于细绒组,次要优势菌属中,Succiniclasticum的相对丰度显著高于细绒组。Ruminococcus是典型的纤维降解菌,在瘤胃内可以产生纤维酶降解纤维二糖等纤维物质,促进反刍动物瘤胃对纤维的降解[32],此菌属在2组绒山羊瘤胃中的相对丰度没有显著差异,是粗绒组和细绒组陕北白绒山羊瘤胃中共享的菌属。Prevotella具有消化蛋白质和氨基酸的活性,与纤维降解菌协同作用促进纤维降解[33-34],细绒组Prevotella的相对丰度极显著高于粗绒组,提示细绒型陕北白绒山羊可能对蛋白质、氨基酸和纤维的消化更加活跃一些,这些结果也和共现网络分析中细绒组瘤胃菌群更稳定性一些的结果相吻合。有研究报道,Succiniclasticum也是一种典型的纤维降解菌,和纤维降解关系密切,淀粉作为Succiniclasticum的主要底物刺激其生长,能降解纤维或纤维二糖产生琥珀酸、乙酸和二氧化碳等[35-36]。本研究发现细绒组Succiniclasticum的相对丰度显著低于粗绒组,细绒组Prevotella相的对丰度显著高于粗绒组,且Prevotella和Succiniclasticum在反刍动物瘤胃中的功能及其降解纤维的方式不同,提示细绒型和粗绒型陕北白绒山羊瘤胃中发挥降解纤维的菌属及瘤胃细菌对营养物质的利用方面存在明显的差异,造成这种现象的具体原因还不清楚,有待进一步深入研究。
物种间相关性分析发现,细绒型陕北绒山羊瘤胃菌群之间相互作用的微生物数量和互作关系较粗绒型陕北白绒山羊复杂,提示细绒型陕北白绒山羊瘤胃微生物之间的互作关系和结构紧密性高于粗绒型陕北白绒山羊,其中细绒型陕北白绒山羊瘤胃中呈负相关关系的物种有44个,粗绒型陕北白绒山羊瘤胃中呈负相关关系的物种只有8个,提示呈负相关关系的物种可能发挥了细绒型绒山羊瘤胃微生物之间的某些调控作用,但是具体的机制不清楚,可通过进一步采用宏基因组测序的方法,对粗绒型和细绒型陕北白绒山羊瘤胃微生物功能进行深入研究和分析,结合本研究结果可能能从某些方面对这些问题进行更深层次的探讨。
4 结 论
① 细绒型陕北白绒山羊瘤胃菌群数量和菌属相对丰度低于粗绒型陕北白绒山羊。
② 细绒型和粗绒型陕北白绒山羊瘤胃中的优势菌门为Firmicutes和Bacteroidetes,优势菌属为Ruminococcus和Prevotella。
③ 门水平上,细绒型陕北白绒山羊瘤胃中Proteobacteria的相对丰度显著低于粗绒型陕北白绒山羊;属水平上,细绒型陕北白绒山羊瘤胃中Prevotella的相对丰度极显著高于粗绒型陕北白绒山羊。
④ 细绒型陕北白绒山羊瘤胃菌群间互作关系和结构紧密性高于粗绒型陕北白绒山羊,提示陕北白绒山羊瘤胃菌群结构和功能的稳定性可能影响产绒性能。

