LC-MS/MS法测定人血浆中吡咯替尼的浓度及其临床应用
赵振寰 荆伟丽 刘涛 吕志强 曹志红 徐文

中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2021)22-2767-05
DOI 10.6039/j.issn.1001-0408.2021.22.14
摘 要 目的:建立测定吡咯替尼血药浓度的方法,并应用于临床。方法:血浆样本经甲醇沉淀蛋白后,以伊马替尼为内标,采用液相色谱-串联质谱(LC-MS/MS)法测定。以Ultimate AQ-C18为色谱柱,以甲醇(含0.1%甲酸)-水(0.1%甲酸)为流动相进行梯度洗脱,流速为0.4 mL/min,柱温为40 ℃,进样量为5 ?L。离子源为电喷雾离子源,以多反应监测模式进行正离子扫描,用于定量分析的离子对分别为m/z 583.4→138.3(吡咯替尼)、494.5→393.4(内标)。选择2020年6-11月于青岛大学附属医院接受吡咯替尼治疗的乳腺癌患者30例,测定其用药1周后的吡咯替尼稳态谷浓度。结果:吡咯替尼检测质量浓度的线性范围为5~300 ng/mL(r=0.999 3),定量下限为5 ng/mL;日内、日间RSD均不高于9.30%,相对误差为-6.70%~5.04%;稳定性试验的相对误差为 -1.92%~5.42%;提取方法、基质效应、残留效应均不影响待测物的定量分析。30例乳腺癌患者体内吡咯替尼的稳态谷浓度为32.6~82.8 ng/mL,平均血药浓度为53.8 ng/mL,存在2.54倍的个体差异。结论:所建LC-MS/MS法操作简便、灵敏度和准确度较高,可用于乳腺癌患者体内吡咯替尼的血药浓度监测。
关键词 吡咯替尼;液相色谱-串联质谱法;伊马替尼;乳腺癌;血药浓度监测
Determination of Pyrrotinib Concentration in Human Plasma by LC-MS/MS and Its Clinical Application
ZHAO Zhenhuan,JING Weili,LIU Tao,LYU Zhiqiang,CAO Zhihong,XU Wen(Dept. of Pharmacy, the Affiliated Hospital of Qingdao University, Shandong Qingdao 266003, China)
ABSTRACT OBJECTIVE: To establish a method for the determination of pyrrotinib concentration in plasma, and apply it in clinic. METHODS: After precipitated with methanol, the plasma sample was determined by LC-MS/MS using imatinib as internal standard. The determination was performed on Ultimate AQ-C18 column with mobile phase consisted of methanol (containing 0.1% formic acid) and water (containing 0.1% formic acid) (gradient elution) at the flow rate of 0.4 mL/min. The column temperature was 40 ℃, and the sample size was 5 ?L. The ion source was electrospray ionization source, and the positive ion scanning was carried out in multiple reaction mode. The ion pairs for quantitative analysis were m/z 583.4→138.3 (pyrrotinib) and m/z 494.5→393.4 (internal standard), respectively. Thirty breast cancer patients taking pyrrotinib were collected from the Affiliated Hospital of Qingdao University during Jun.-Nov. 2020 to determine their steady-state trough concentrations of pyrrotinib after a week of treatment. RESULTS: The linear range of pyrrotinib were 5-300 ng/mL (r=0.999 3). The lower limit of quantification was 5 ng/mL. RSDs of intra-day and inter-day were not higher than 9.30%, and relative errors (REs) ranged -6.70%-5.04%. REs of stability tests were in the range of -1.92%-5.42%. The extraction method, matrix effect and residual effect did not affect the quantitative analysis of the substance to be tested. The steady-state trough concentrations of pyrrotinib were 32.6-82.8 ng/mL,with an average plasma concentration of 53.8 ng/mL; there was about 2.54 fold individual difference. CONCLUSIONS: Established LC-MS/MS method is simple, sensitive and accurate, and can be used for the plasma concentration monitoring of pyrrotinib in breast cancer patient.
KEYWORDS Pyrrotinib; LC-MS/MS; Imatinib; Breast cancer; Plasma concentration monitoring
乳腺癌是威胁女性健康的常见恶性肿瘤之一,其发病率在女性恶性肿瘤患者中排第1位,病死率排第2位[1]。有研究指出,15%~30%的乳腺癌患者的表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达呈阳性,其肿瘤侵袭性强、预后差[2-3]。HER2靶向治疗药物(如曲妥珠单抗等)的上市应用明显改善了患者的预后,显著延长了患者的生存期[4]。但是在这些靶向药物的使用过程中,有部分患者出现了无法耐受的情况,严重影响了临床治疗的效果[5]。吡咯替尼是我国自主研发的小分子不可逆酪氨酸激酶抑制剂,适用于HER2阳性患者,包括既往使用其他靶向药物反应性不强的患者[6]。该药于2018年8月获批上市,多项临床研究已证实,其用于治疗既往未接受或接受过曲妥珠单抗的复发或转移性HER2阳性乳腺癌患者具有良好的效果[7-8]。由于多数靶向药物的血药浓度个体差异大,且血药浓度与疗效、不良反应的相关性较强[9-10],因此可通过血药浓度监测对患者用药剂量进行个体化调整,以在保证疗效的同时降低胃肠道等不良反应的发生风险。此外,由于吡咯替尼为药物代谢酶细胞色素P450 3A(CYP3A)的底物,故影响该酶活性的药物也可能会影响吡咯替尼的血药浓度,因此在联合用药时可根据吡咯替尼的血药浓度对其剂量进行调整[11]。
目前,关于吡咯替尼血药浓度检测的報道较少,仅有采用放射液相色谱法和超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF-MS)法分析吡咯替尼在人体内的药动学过程[11-12]。但是放射液相色谱法不适用于临床血药浓度监测工作的常规开展,而UPLC-Q-TOF-MS法所用设备十分昂贵且普及率较低,均难以满足临床吡咯替尼血药浓度监测的需求。液相色谱-串联质谱(LC-MS/MS)法是目前检测小分子药物的最佳方法,该方法灵敏度高、专属性强,在大型三级甲等医院的普及率较高,也是国外检测小分子靶向药物血药浓度的主要手段[13-14]。基于此,本研究建立了测定人血浆中吡咯替尼血药浓度的LC-MS/MS法,同时采用该方法对接受吡咯替尼治疗的乳腺癌患者体内的药物浓度进行检测,旨在为该药的个体化应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有API 4000+型三重四极杆串联质谱系统(美国AB公司),1290Ⅱ型UPHC及配套的G7120型溶剂泵、G7167B型进样器、G7116B型柱温箱(美国Agilent公司),5418型离心机(德国Eppendorf公司),DT5-6B型低速台式自动平衡离心机(北京新时代北利医疗器械有限公司),BF-2000型氮气吹干仪(北京八方世纪科技有限公司),Milli-Q型超纯水机(美国Millipore公司)等。
1.2 主要药品与试剂
马来酸吡咯替尼对照品(批号20061501,纯度>99%,以下简称“吡咯替尼对照品”)购自青岛英纳维生物科技有限公司;甲磺酸伊马替尼对照品(内标,批号S102608,纯度≥99%,以下简称“内标对照品”)购自美国Selleck Chemicals公司;健康人空白血浆由青岛大学附属医院输血科提供;乙腈(色谱纯)、甲醇(色谱纯)均购自德国Merck公司;甲酸(色谱纯)购自美国Tedia公司;其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件 以Ultimate AQ-C18(100 mm×2.1 mm,3.0 ?m)为色谱柱,以甲醇(含0.1%甲酸,A)-水(含0.1%甲酸,B)为流动相进行梯度洗脱(0~0.5 min,32%A;0.5~2.0 min,32%A→75%A;2.0~6.0 min,75%A);流速为0.4 mL/min;柱温为40 ℃;进样量为5 ?L。
2.1.2 质谱条件 离子源为电喷雾离子源(ESI),以多反应监测(MRM)模式进行正离子扫描;碰撞气压力为6.00×104 Pa,气帘气压力为2.00×105 Pa,雾化气压力为4.48×105 Pa,辅助气压力为4.48×105 Pa;喷雾电压为 5 500 V;雾化温度为550 ℃;去簇电压分别为80 V(吡咯替尼)、92 V(内标);碰撞能量分别为39 eV(吡咯替尼)、36 eV(内标);用于定量分析的离子对分别为m/z 583.4→138.3(吡咯替尼)、494.5→393.4(内标)。吡咯替尼和内标的化学结构式及二级全扫描质谱图见图1。
2.2 溶液的制备
2.2.1 对照品溶液 取吡咯替尼对照品约10 mg,精密称定,置于50 mL量瓶中,加甲醇溶解并定容,混匀,制成质量浓度为200 μg/mL的对照品溶液。
2.2.2 标准曲线溶液和质控样品溶液 取“2.2.1”项下对照品溶液适量,用甲醇稀释,混匀,制成质量浓度分别为5、10、20、50、100、200、300 ng/mL的系列工作溶液;分别取上述系列工作溶液各50 ?L,置于试管中,于60 ℃下以氮气流吹干,残渣分别加入空白血浆50 ?L,混匀,制成质量浓度分别为5、10、20、50、100、200、300 ng/mL的系列标准曲线溶液。同法制备吡咯替尼质量浓度分别为10、50、200 ng/mL的质控样品溶液。
2.2.3 内标溶液 取内标对照品约10 mg,精密称定,置于50 mL量瓶中,加甲醇溶解并定容,混匀,制成质量浓度为200 μg/mL的内标贮备液;取上述内标贮备液适量,用甲醇稀释,混匀,制成质量浓度为150 ng/mL的内标溶液。
2.3 血浆样品的预处理
取血浆样品50 ?L,置于1.5 mL的离心管中,加入“2.2.3”项下内标溶液150 ?L,涡旋混匀2 min,以12 000 r/min离心10 min,取上清液,置于进样瓶中,待测。
2.4 方法学考察
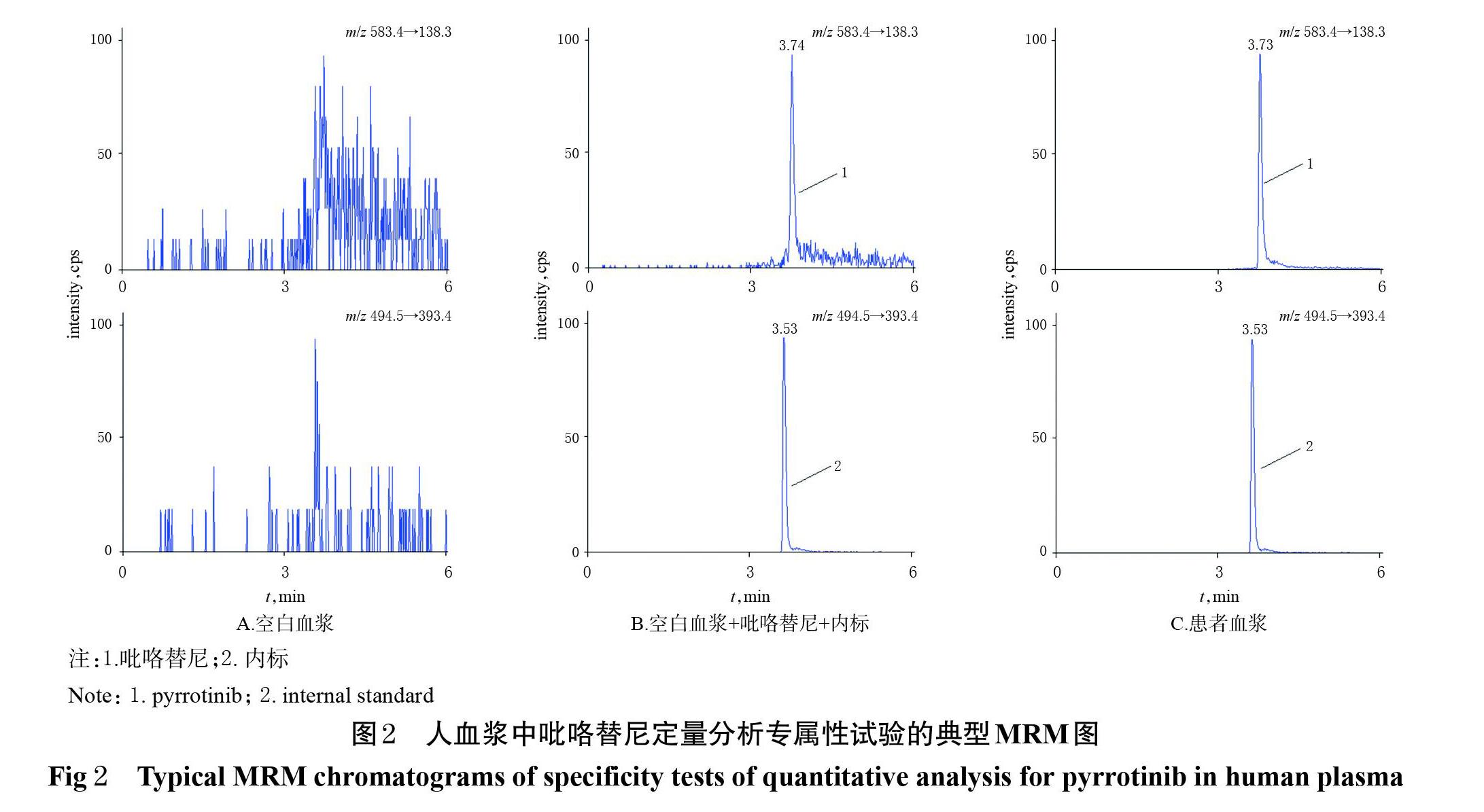
2.4.1 专属性考察 分别取空白血浆、空白血浆+吡咯替尼(质量浓度为10 ng/mL)、患者血浆样品,按“2.3”项下方法预处理(空白血浆不加内标)后,再按“2.1”项下色谱与质谱条件进样分析,记录色谱图。结果显示,吡咯替尼和内标的保留时间分别约为3.7、3.5 min,空白血浆中的磷脂、氨基酸等小分子内源性物质对吡咯替尼及内标的测定无干扰,表明该方法专属性良好。结果见图2。
2.4.2 线性关系考察 取“2.2.2”项下系列标准曲线溶液,按“2.3”项下方法预处理后,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积。以待测物的质量浓度(x,ng/mL)为横坐标、待测物与内标的峰面积之比(y)为纵坐标进行加权线性回归(权重为1/x2),得吡咯替尼的回归方程为y=6.9×10-3x+1.9×10-2(r=0.999 3),表明吡咯替尼检测质量浓度的线性范围为5~300 ng/mL,定量下限为5 ng/mL。
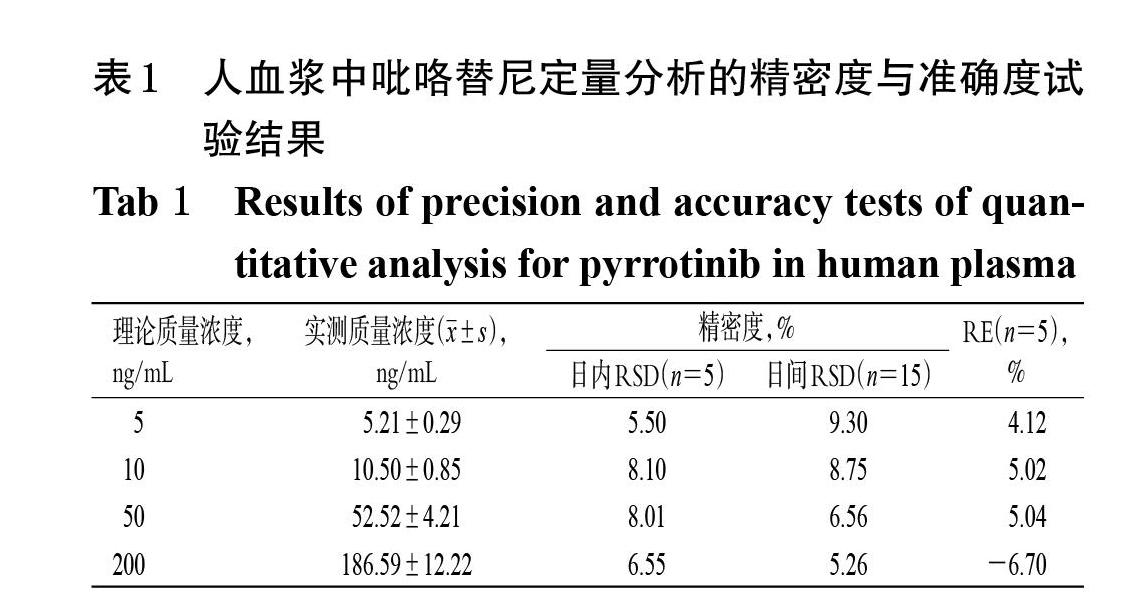
2.4.3 精密度与准确度试验 取“2.2.2”项下质量浓度为5 ng/mL(即定量下限)的标准曲线溶液和10、50、200 ng/mL的质控样品溶液各5 份,于1 d内按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,考察日内精密度;连续3 d按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,考察日间精密度。以实测质量浓度与理论质量浓度进行比较,用相對误差(RE)考察准确度。结果显示,各样品的日内、日间RSD均不高于9.30%,RE为-6.70%~5.04%,符合生物样品定量分析的相关要求[15]。结果见表1。
2.4.4 稳定性试验 按“2.2.2”项下方法制备10、50、200 ng/mL的质控样品溶液,分别于室温下放置24 h、 -20 ℃冰箱中放置30 d、反复冻融(-20 ℃~室温)3次后,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积,以实测质量浓度与理论质量浓度进行比较,用RE考察样品在室温下放置、低温下长期储存和反复冻融条件下的稳定性。另取10、50、200 ng/mL的质控样品溶液,按“2.3”项下方法预处理后,于4 ℃自动进样器中放置12 h,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积,以实测质量浓度与理论质量浓度进行比较,用RE考察经预处理后样品在待测过程中的稳定性。每质量浓度各条件均平行5份操作,结果见表2。由表2可知,各样品的RE为-1.92%~5.42%,表明其在上述各种条件下的稳定性良好。
2.4.5 提取回收率与基质效应考察 按“2.2.2”项下方法制备10、50、200 ng/mL的质控样品溶液,分别按“2.3”项下方法预处理后,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积A。取“2.2.1”项下对照品溶液,用75%甲醇稀释,制成质量浓度分别为10、50、200 ng/mL的对照工作溶液,按“2.3”项下方法预处理后,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积B。取空白血浆,按“2.3”项下方法预处理后,于60 ℃下以氮气流吹干,得空白基质,用上述10、50、200 ng/mL的对照工作溶液复溶,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积C。提取回收率=A/C×100%,基质效应=C/B×100%。每质量浓度平行5份操作。结果显示,吡咯替尼的平均提取回收率为93.52%~95.93%(RSD≤4.42%),平均基质效应为96.08%~97.53%(RSD≤3.05%);内标的平均提取回收率为96.37%(RSD=3.51%),平均基质效应为97.67%(RSD=2.63%),表明基质不干扰样本和伊马替尼的测定。结果见表3。
2.4.6 残留效应考察 取“2.2.2”项下300 ng/mL的标准曲线溶液,按“2.3”项下方法预处理后,再按“2.1”项下色谱与质谱条件进样分析,同法测定空白血浆以考察方法的残留效应。结果显示,在吡咯替尼和内标对应的保留时间处,空白血浆未见明显的色谱峰,且噪音与5 ng/mL质控样品相应色谱峰峰面积的比值小于0.17%,表明残留效应不影响后续血浆样品的测定。
2.5 临床应用
2.5.1 纳入与排除标准 本研究的纳入标准为:(1)年龄大于18岁,体质量不限;(2)经病理学检查确诊为乳腺癌,原发病灶或转移病灶经荧光原位杂交技术检测并确诊为HER2 阳性;(3)服用吡咯替尼1周以上且规律服药,中途无中断或更改剂量;(4)均签署了知情同意书。本研究的排除标准为:(1)连续服用吡咯替尼短于1周或1周内更改剂量者;(2)不耐受不良反应而擅自减少药物剂量或中断服药者;(3)1周内服用CYP3A或P-糖蛋白强抑制剂或诱导剂者;(4)妊娠期或哺乳期妇女。
2.5.2 资料来源 收集2020年6-11月于青岛大学附属医院接受吡咯替尼治疗的30例乳腺癌患者,平均年龄(49.2±5.3)岁。本研究方案经医院医学伦理委员会审核批准,批件号为QYFYWZLL26449。
2.5.3 用药方法 所有患者均口服马来酸吡咯替尼片[江苏恒瑞医药股份有限公司,国药准字H20180013,按C32H31ClN6O3计80 mg]每天1次,每次400 mg,连续服用至少1周。
2.5.4 检测方法与检测结果 待患者血药浓度达到稳态后,于下次用药前采集患者静脉血3~5 mL,置于乙二胺四乙酸(EDTA)抗凝管中,以3 500 r/min离心10 min,分离上层血浆,置于EP管中,于-20 ℃保存。取上述血浆样本,按“2.3” 项下方法预处理后,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积,并根据随行标准曲线计算患者血浆中吡咯替尼的质量浓度。每个样本检测1次。结果显示,30例患者的吡咯替尼稳态谷浓度为32.6~82.8 ng/mL,高浓度约为低浓度的2.54倍,提示不同患者体内吡咯替尼的血药浓度差异较大;平均血药浓度为53.8 ng/mL,所有结果均在定量分析线性范围内。结果见图3。
3 讨论
本课题组前期研究发现,吡咯替尼易于形成[M+H]+峰,且该母离子易形成更小的碎片离子,故采用MRM模式进行正离子检测时的灵敏度较高;随后对去簇电压和碰撞能量等质谱参数进行优化,以进一步提高检测的灵敏度,最终得到了“2.1.2”项下质谱条件。
因伊马替尼与吡咯替尼化学结构相似且色谱保留时间相近,理化性质稳定且提取率高,加之方法学验证的各项指标均能满足生物样品定量分析的相关要求[15],故本研究选择伊马替尼为内标。本课题组前期预测了所测样本的质量浓度,故在样本预处理时采用甲醇蛋白沉淀法。结果显示,吡咯替尼和内标的提取率高且稳定,虽然对样本有一定程度的稀释,灵敏度略有下降,但該方法操作简便、快捷,灵敏度能满足临床血药浓度监测的要求。在采用等度洗脱方式分离吡咯替尼和伊马替尼时,所得色谱峰较宽且拖尾严重,待测成分易受基质效应的干扰,因此采用梯度洗脱,结果所得色谱峰峰形尖锐、不拖尾,基质效应不干扰测定。本课题组前期还发现,流动相中甲酸的浓度会显著影响吡咯替尼和伊马替尼的峰面积,为了提高检测的准确性,本研究在有机相和水相中均加入了甲酸,随着流动相中甲酸浓度的升高,吡咯替尼和伊马替尼的响应强度均有所增强,当甲酸浓度达到0.1%时,响应强度增加不明显,故为避免甲酸对色谱柱的损害,本研究选择流动相中甲酸的浓度为0.1%。
目前,色谱法被认为是小分子靶向药物血药浓度监测的理想方法,主要包括液相色谱-紫外(LC-UV)法和LC-MS/MS法,但哪种方法更适合则主要由样本中代谢产物的性质和浓度所决定[16]。有的小分子靶向药物,如伊马替尼在患者体内的血药浓度较高,采用LC-UV法基本能满足临床需求。但随着新药开发的不断进展,新一代小分子靶向药物的活性更强、血药浓度更低,LC-UV法已不能满足临床需求,而LC-MS/MS法专属性较强,可以降低内源性物质和患者服用的其他药物的干扰,更适合低血药浓度药物的监测[17]。考虑到吡咯替尼在患者体内的血药浓度较低,本研究选择了灵敏度更高的LC-MS/MS法,该方法操作简便,灵敏度和检测效率均较高,适用于吡咯替尼的血药浓度监测。本研究结果显示,30例患者体内吡咯替尼的稳态谷浓度为32.6~82.8 ng/mL,高浓度约为低浓度的2.54倍,个体差异较大,这可能与吡咯替尼的体内代谢和转运有关[9,11]。
综上所述,本研究所建方法操作简便、灵敏度和准确度较高,可用于乳腺癌患者体内吡咯替尼的血药浓度监测。但由于该药上市较晚,目前尚无明确的与有效性和安全性相关的血药浓度范围,虽然本研究初步测得部分患者的吡咯替尼稳态谷浓度,但个体差异较大,因此在后续研究中将扩大样本量,并收集疗效、不良反应等数据,以获取该药的临床药动学数据,并确保其疗效和安全性。
参考文献
[ 1 ] SIEGEL R L,MILLER K D,JEMAL A. Cancer statistics,2018[J]. CA Cancer J Clin,2018,68(1):7-30.
[ 2 ] XU B,HU X,ZHENG H,et al. Outcomes of re-treatment with first line trastuzumab plus a taxane in HER2 positive metastatic breast cancer patients after (neo) adjuvant trastuzumab:a prospective multicenter study[J]. Oncotarget,2016,7(31):50643-50655.
[ 3 ] HARBECK N. Advances in targeting HER2-positive breast cancer[J]. Curr Opin Obstet Gynecol,2018,30(1):55-59.
[ 4 ] COBLEIGH M,YARDLEY D A,BRUFSKY A M,et al. Baseline characteristics,treatment patterns,and outcomes in patients with HER2-positive metastatic breast cancer by hormone receptor status from SystHERs[J]. Clin Cancer Res,2020,26(5):1105-1113.
[ 5 ] NEMETH B T,VARGA Z V,WU W J,et al. Trastuzumab cardiotoxicity:from clinical trials to experimental studies
[J]. Br J Pharmacol,2017,174(21):3727-3748.
[ 6 ] MA F,OUYANG Q,LI W,et al. Pyrotinib or lapatinib combined with cape-citabine in HER2-positive metastatic breast cancer with prior taxanes,anthracyclines,and/or trastuzumab:a randomized,phase Ⅱ study[J]. J Clin Oncol,2019,37(29):2610-2619.
[ 7 ] ZHOU C,LI X,WANG Q,et al. Pyrotinib in HER2-mutant advanced lung adenocarcinoma after platinum-based chemotherapy:a multicenter,open-label,single-arm,phase ii study[J]. J Clin Oncol,2020,38(24):2753-2761.
[ 8 ] 宋国红,李惠平,邸立军,等.真实世界吡咯替尼治疗HER2阳性转移性乳腺癌的疗效及安全性[J].北京大学学报(医学版),2020,52(2):254-260.
[ 9 ] HUYNH H H,PRESSIAT C,SAUVAGEON H,et al. Development and validation of a simultaneous quantification method of 14 tyrosine kinase inhibitors in human plasma using LC-MS/MS[J]. Ther Drug Monit,2017,39(1):43-54.
[10] 尤國皎,乔逸,文爱东. 4种常用酪氨酸激酶抑制剂的药动学特征[J].中国药房,2016,27(13):1854-1857.
[11] MENG J,LIU X Y,MA S,et al. Metabolism and dispo- sition of pyrotinib in healthy male volunteers:covalent binding with human plasma protein[J]. Acta Pharmacol Sin,2019,40(7):980-988.
[12] ZHU Y,LI L,ZHANG G,et al. Metabolic characterization of pyrotinib in humans by ultra-performance liquid chromatography/quadrupole time-of-flight mass spectro- metry[J]. J Chromatogr B,2016,1033/1034:117-127.
[13] 郭玮,陈文祥,尚红,等.液相色谱-质谱临床应用建议[J].中华检验医学杂志,2017,40(10):770-779.
[14] 王国才,贺玖明.液相色谱质谱联用技术在临床检测和代谢研究中的应用进展[J].国际检验医学杂志,2018,39(22):2750-2755.
[15] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[16] KOLLER D,VAITSEKHOVICH V,MBA C,et al. Effective quantification of 11 tyrosine kinase inhibitors and caffeine in human plasma by validated LC-MS/MS method with potent phospholipids clean-up procedure:application to therapeutic drug monitoring[J]. Talanta,2020,208:120450.
[17] MERIENNE C,ROUSSET M,DUCINT D,et al. High throughput routine determination of 17 tyrosine kinase inhibitors by LC-MS/MS[J]. J Pharm Biomed Anal,2018,150:112-120.
(收稿日期:2021-05-24 修回日期:2021-10-25)
(编辑:陈 宏)

