3-[2-(5-溴-噻吩基)]-1-苯基-2-丙烯酮与牛血清白蛋白的相互作用*
王会镇,雷琴,张弛翔,姚小军,陈绍玲,刘家琴,王琰
1. 西华大学理学院,四川成都 610039
2. 兰州大学化学化工学院,甘肃兰州 730000
血清白蛋白在生命活动中起着非常重要的作用,与生命体内环境的变化密切相关[1]。近几十年来,药物与血清白蛋白的相互作用引起了研究者的高度关注[2-4]。本研究的内容有助于探究影响药物治疗效果的结构特征,对新药的研发及设计具有很好的指导意义。由于牛血清白蛋白(BSA)和人血清白蛋白(HSA)在结构上具有相似性,因此BSA 已被广泛用于研究蛋白质与药物相互作用机理[5]。查尔酮可作为类黄酮和异黄酮的前体,广泛存在于可食用植物中,且已被证明具有多种药理活性[6-7]。3-[2-(5-溴-2-噻吩基)]-1-苯基-2-丙烯酮(BTPPO,图1)是一种带有噻吩基团的新型查耳酮衍生物,其与BSA 的相互作用机理尚未得到深入研究。
本文中,我们在模拟生理环境下,使用光谱分析法研究了BTPPO 与BSA 的相互作用以及几种金属离子的影响。研究了淬灭机理,结合力类型以及BTPPO 对BSA 构象的影响。得到了结合常数、结合位点和结合距离等数据。此外,还使用分子对接模拟研究了BTPPO 和BSA 之间的相互作用。以上研究有助于阐明BTPPO 与BSA 相互作用的机制,并为进一步研究药物作用机制奠定基础。
1 实验过程
1.1 原料
牛血清白蛋白(组分V,φ=99%,Sigma 公司)溶于Tris-HCl(pH = 7.40)缓冲溶液中制成1.54×10-5mol•L-1的母液;BTPPO 为实验室合成,溶于Tris-HCl 缓冲溶液中制成4.53×10-5mol•L-1的母液;Cu2+,Co2+,Pb2+,Ag+,Hg2+,Cd2+金属离子溶于Tris-HCl 缓冲溶液制成浓度为4.53×10-5mol•L-1的溶液。实验用水为二次蒸馏水。
1.2 仪器
荧光分光光度计(F-4600,日立,日本);紫外可见分光光度计(CARY 100,安捷伦,美国);数字式pH计(pHS-25,雷磁,上海)。
1.3 实验方法
1.3.1 BTPPO的合成将5 mmol苯乙酮溶于10 mL乙醇中,加入5 mLw=10%的氢氧化钠溶液,之后加入5 mmol 5-溴-噻吩-2-甲醛,室温下搅拌8 h。反应结束后,加入200 mL 去离子水,之后用盐酸调节pH 值为6.8~7.2。过滤得沉淀,之后用乙醇重结晶得白色固体产物,产率:80%。合成路线如图1所示。

图1 BTPPO的合成路线Fig.1 Synthesis of BTPPO
1H NMR(300 MHz,CDCl3)δ:7.0(d,J=3.9 Hz,1H ),7.1 ( d,J=3.6 Hz, 1H ) , 7.2 ( d,J= 15.3 Hz,1H),7.5(t,J=7.3 Hz,2H),7.6(d,J=7.2 Hz,1H),7.8(d,J=15.3 Hz,1H),8.0(d,J=7.5 Hz,1H)。
1.3.2 光谱研究方法在紫外-可见光谱(UV-vis)的测试中,设定光谱测量范围为200~400 nm。在荧光光谱测试中,设定激发波长为280 nm,发射光谱扫描范围为300~450 nm。激发和发射狭缝的宽度均设定为5 nm。具体方法为:移取1.54×10-5mol•L-1的BSA 母液3 mL 于石英比色皿中,测定其发射光谱,然后用微量进样器逐次加入4.53×10-5mol•L-1的BTPPO母液进行荧光滴定。所有实验均在3 个不同的温度(293、310、318 K)下进行。然后将激发和发射波长间隔(Δλ)设置为15 nm和60 nm,进行同步荧光光谱测量。
通过以下公式进行了荧光强度值的校正以消除内部滤镜效果的影响[8]
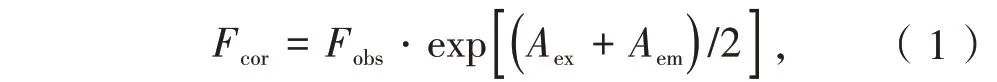
其中Fcor和Fobs分别是荧光强度校正值和测量值;Aex和Aem分别是BTPPO-BSA 体系在激发和发射波长下的吸光度。
1.3.3 分子对接模拟首先使用Schrödinger 2009
软件中的2D Sketcher 构建了BTPPO 的分子结构模型。然后在OPLS-2005 力场中使用LigPrep 连接酶对BTPPO 进行预处理,并计算出化合物低能量状态下的3D 构象异构体[9-10]。使用Epik 技术[11]在7.0±2.0 的pH 值下进行了离子化状态分布。从蛋白质数据库(PDB ID 代码4OR0)[12]检索到BSA 的3D 晶体结构用于分子对接模拟。使用蛋白质制备向导去除结晶水分子的影响并进行氢原子的添加。使用OPLS-2005 力场进行部分电荷的分配[10],同时进行质子化状态分配。当均方根偏差(RMSD)达到最大值0.30 时,终止最小化。使用Glide[13]在标准精度(SP)下进行分子对接模拟。在对接计算的初始阶段生成了500 个位姿,从中选择了100 个最佳位姿,通过1 000 步共轭梯度最小化算法来进行最低能量优化。所有的分子对接模拟过程均使用Schrödinger 2009软件进行。
2 结果与讨论
2.1 紫外光谱
紫外吸收光谱见图2,其中曲线1 是BTPPOBSA 体系的紫外吸收光谱,曲线2 是BSA 的紫外吸收图谱。对比曲线1 和曲线2 可以看出:BTPPO 与BSA的结合导致吸光度的显著下降,最大吸收波长从198 nm 红移至208 nm,这表明BSA 和BTPPO 之间形成了复合物[14]。
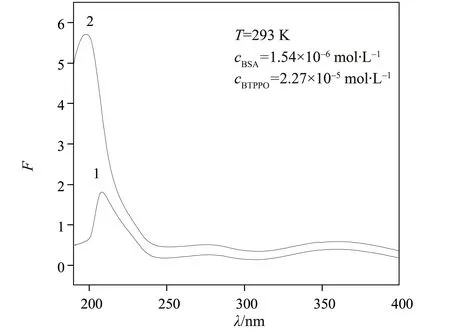
图2 BTPPO和BSA作用的紫外光谱图Fig. 2 UV of BTPPO-BSA and BSA
2.2 荧光光谱
BTPPO 对BSA 荧光发射光谱的影响见图3,可以看出:当激发波长为280 nm 时,BSA 的荧光强度值随着BTPPO 浓度的增加而逐渐降低,这是因为BTPPO 可以与BSA 结合形成BTPPO-BSA 复合物,从而导致荧光淬灭[15]。另外,随着BTPPO 浓度的增加,荧光具有蓝移现象,这是由荧光发色团周围微环境的极性降低引起的[16]。
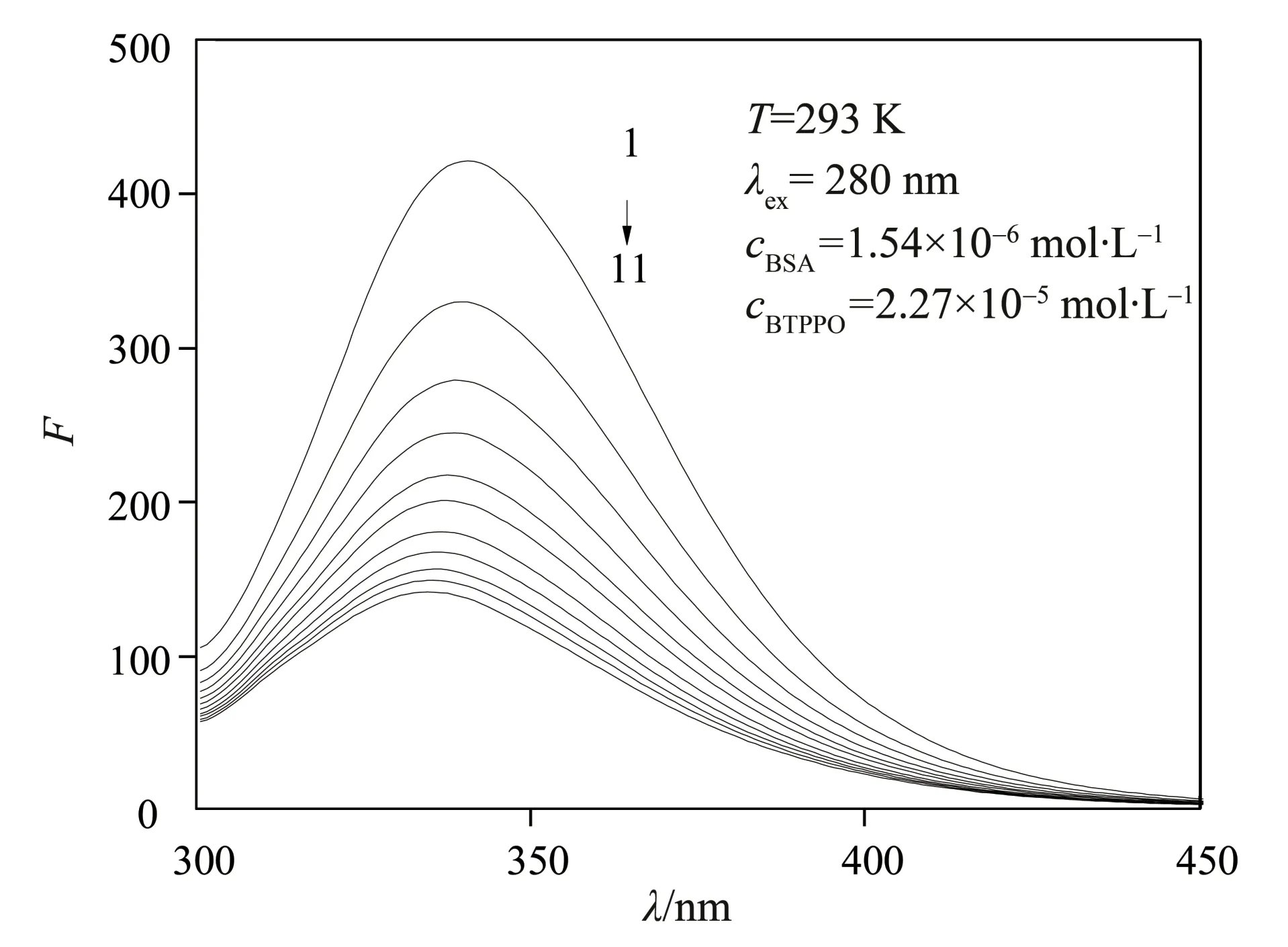
图3 BTPPO与BSA相互作用的荧光光谱图Fig.3 Fluorescence spectra of BSA-BTPPO system
采用同步荧光光谱法在Δλ=15 nm 和Δλ=60 nm 条件下研究了BTPPO 对BSA 构象的影响,结果见图4。由图4 可见,随着BTPPO 浓度的增加,BSA 中酪氨酸(Tyr)和色氨酸(Trp)残基的荧光强度逐渐降低。同时,最大发射波长没有出现明显的位移,表明BTPPO 不会对BSA 的结构产生明显的影响[17]。
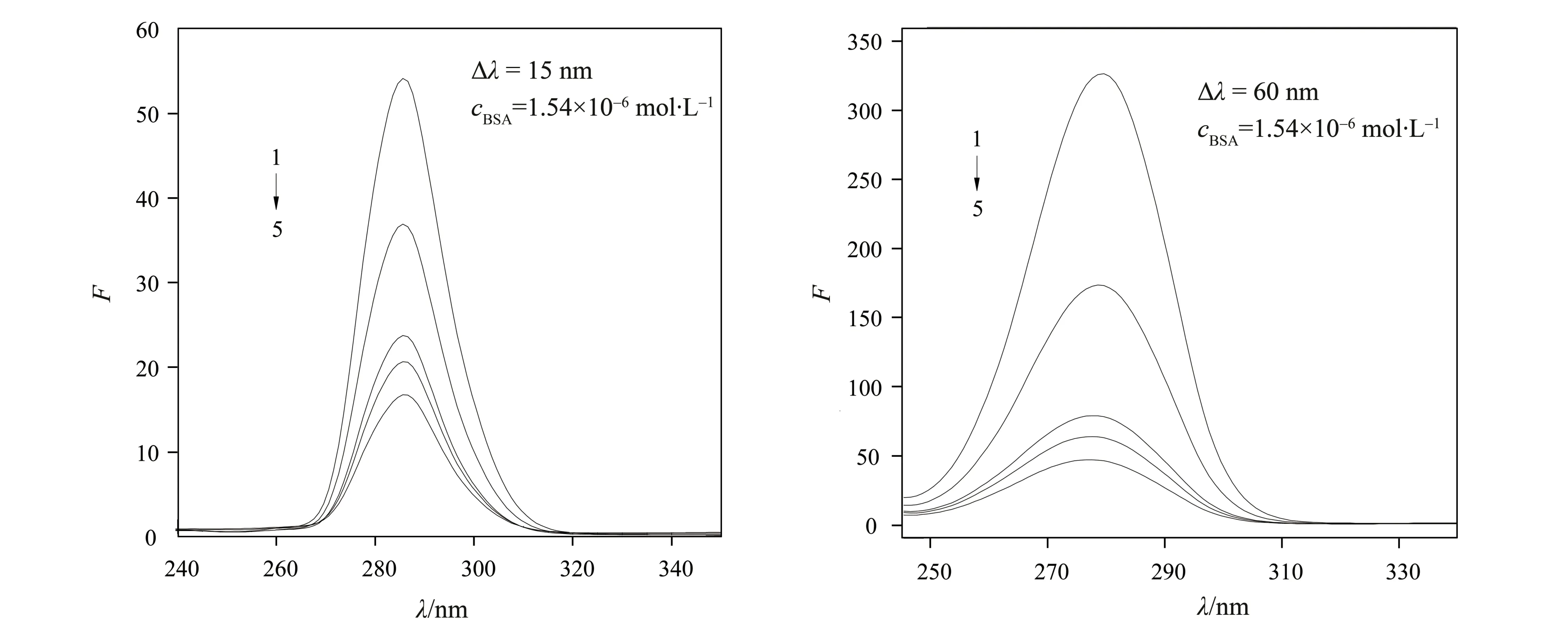
图4 BTPPO与BSA相互作用的同步荧光光谱图Fig.4 Synchronous fluorescence spectra of BSA-BTPPO(T=293 K)
2.3 结合位点
为了确定BSA的酪氨酸(Tyr)和色氨酸(Trp)残基是否都与BTPPO 发生了作用,在激发波长为280 和295 nm 时测量了BTPPO 存在时BSA 的荧光光谱,结果见图5。由图可见,在激发波长为280 nm 和295 nm 时的BSA 荧光淬灭曲线没有重叠,并且激发波长为280 nm 时的荧光淬灭程度略微强于激发波长为295 nm 时。这表明酪氨酸(Tyr)和色氨酸(Trp)残基都参与了反应,同时也表明BTPPO 主要结合在BSA的亚结构域ⅡA(site Ⅰ)处[18]。

图5 BTPPO对BSA的荧光淬灭曲线1~11的cBTPPO/(10-5 mol•L-1)分别为0,0.45,0.91,1.36,1.81,2.27,2.72,3.17,3.63,4.08,4.53。Fig.5 Fluorescence quenching curves of BTPPO-BSA
2.4 结合常数和淬灭机理
BTPPO 对BSA 的淬灭机理可通过修正后的Stern-Volmer方程[8]推断

式中F0和F分别是不存在和存在淬灭剂时蛋白质的荧光强度。f是淬灭剂可接近的初始荧光物质的分数,K是淬灭常数。f-1和(K f)-1分别是F0/(F0-F)对1/[Q]做曲线的截距和斜率。计算结果见表1。
从计算结果可以看出,BTPPO 与BSA 之间存在很强的相互作用,并且荧光淬灭常数随温度的升高而降低,这表明BTPPO 对BSA 为静态淬灭过程[8]。
2.5 结合力
BTPPO 与BSA 相互作用的结合力数据及热力学参数可以通过公式(3)和(4)计算得到

其中T为实验温度,K为相应温度下的结合常数,R为气体常数。根据热力学参数的大小,可以推算得到药物—蛋白质结合过程中的结合力[19-21]。
BTPPO-BSA 体系的ΔG,ΔH和ΔS值如表1 所示。ΔG<0 说明结合过程是自发进行的。ΔS>0,ΔH<0 说明BTPPO 和BSA 之间的结合方式主要是静电作用和疏水作用。

表1 BTPPO与BSA的结合常数和热力学参数Table 1 Binding constants and thermodynamic parameters for the binding of BTPPO to BSA
2.6 结合距离
供体与受体的结合距离可以通过Förster 理论计算得到[22]。能量传递效率E可以通过以下公式求得

其中r是供体和受体之间的距离。R0是传输效能为50%时的距离,可以通过以下公式求得
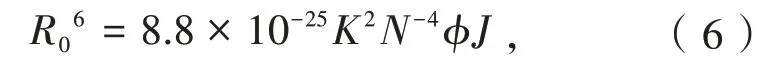
其中K2是偶极子的空间取向因子,N是介质的折射率,φ是不存在受体时供体的量子产率。K2、N和φ分别取2/3、1.336和0.15。供体和受体之间的重叠面积可以通过下式求得

其中F(λ)和ε(λ)分别是激发波长为λ时BSA 的荧光强度和BTPPO 的吸光度。通过公式(5)~(7)可以分别求得J,E和R0的值,进而求得r的值。
BTPPO 的紫外吸收图谱与BSA 的荧光发射图谱积分面积(A)见图6。由图6 可见,BTPPO 的加入对BSA 中色氨酸残基的荧光产生淬灭效应。图6重叠部分的积分面积为1.19×10-14cm3·L·mol-1。进而求得R0=1.68 nm,r=2.52 nm。供体和受体之间的距离小于7 nm,说明BTPPO 与BSA 之间可以发生能量转移。

图6 BTPPO的紫外图谱与BSA的荧光图谱的重叠图Fig.6 Overlap of the fluorescence emission spectrum of BSA
2.7 金属离子的影响
在生命体内,金属离子的存在可能会影响药物与蛋白质的相互作用[23]。通过荧光光谱法研究了金属离子(Cu2+,Co2+,Pb2+,Ag+,Hg2+,Cd2+)对BTPPO 与BSA 相互作用的影响。通过公式(2)求得结合常数,结果见表2。
由表2 可以看出:金属离子(Co2+,Ag+,Hg2+,Cd2+)的存在使得结合常数降低,这是由于金属离子与BTPPO 之间的竞争行为所致。离子-蛋白质复合体的形成会影响蛋白质的结构进而抑制BTPPO 与BSA 的结合[24],并且缩短BTPPO 在血清白蛋白中的停留时间。与此相反,Pb2+存在时BTPPO-BSA的结合常数会增加,这是因为体系中Pb2+,BTPPO和BSA 可以共存,Pb2+与BSA 通过金属离子桥形成Pb2+-BSA 前体,进而与BTPPO 结合形成BTPPOPb2+-BSA复合物。
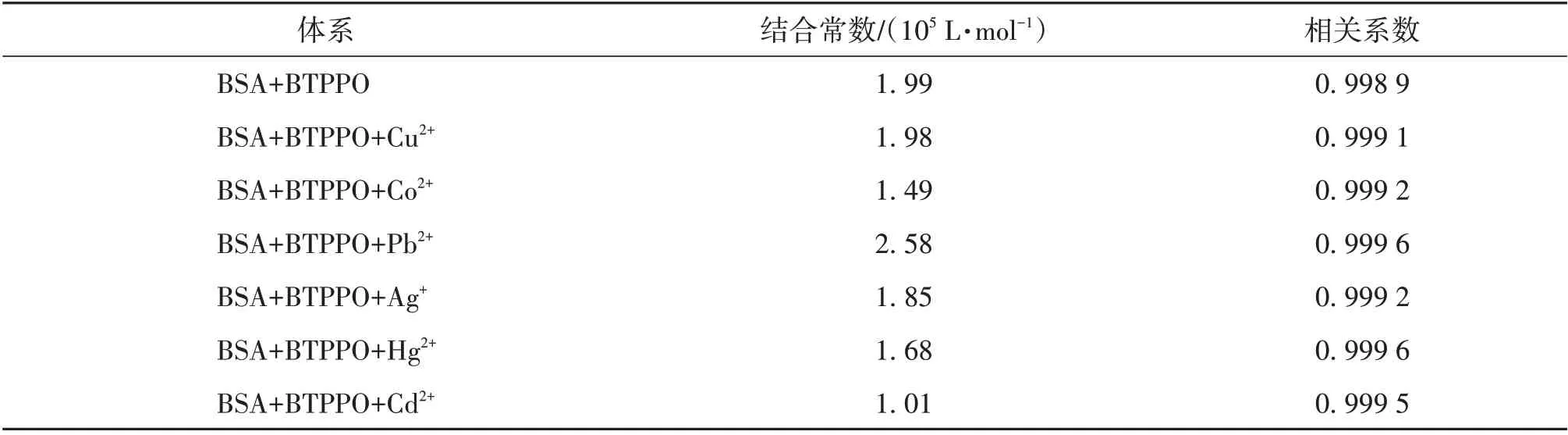
表2 金属离子对BTPPO-BSA体系结合常数的影响Table 2 Binding constants of BTPPO-BSA system in the presence of metal ions
3 分子对接
通过分子对接模拟研究了BTPPO 与BSA 的作用方式。从图7可以看出,BTPPO 与BSA的结合位点是在BSA 的亚结构域ⅡA(siteⅠ)上。分子对接模拟的结果:结合自由能是-27.4 kJ·mol-1,说明结合过程是自发的,作用方式主要是通过疏水和极化作用。在BTPPO-BSA 体系中,BTPPO 的疏水基团主要是与BSA 的Leu386, Ile387, Leu429,Val432,Gly433,Cys436,Thr448 和Leu452 位点进行作用。极化基团主要是与ⅠAsn390,Arg409,Ser488和Ala489位点进行作用。
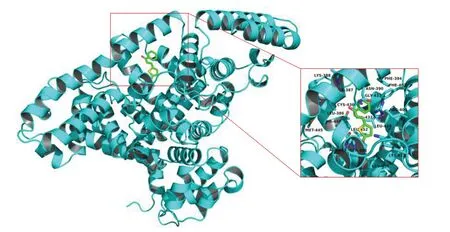
图7 BTPPO-BSA的分子对接模拟Fig.7 The docking results of BTPPO-BSA system
4 结 论
本文合成了小分子BTPPO 并进行了结构表征。通过荧光光谱法和分子对接模拟研究了BTPPO 与BSA的相互作用,并研究了金属离子对作用过程的影响。荧光分析结果表明BTPPO 对BSA 的淬灭是因为形成了BTPPO-BSA 复合物,结合常数为104左右。BTPPO 分子通过疏水作用和静电作用嵌入BSA 的疏水腔,且优先与BSA 的ⅡA 子域(siteⅠ)结合。结合距离小于7 nm,表明存在非辐射能量转移。

