生姜样地根际土壤AM真菌群落结构分析
汪 茜,宋 娟,李冬萍,陈廷速,覃晓娟,车江旅*
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西农业科学院,广西 南宁 530007)
【研究意义】姜瘟病是生姜(ZingiberofficinaleRosc.)细菌性青枯病(Bacterial wilt of ginger)的俗称[1-2],其致病菌曾为青枯假单胞菌(PseudomonassolanacearumSmith),现已根据分类地位命名为青枯劳尔氏菌(Ralstoniasolanacearum)[3]。据调查,由姜瘟病所造成的生姜产量损失一般为20%~30%,有的高达50%~70%甚至绝产[4-5],严重制约我国生姜产业的可持续发展。国内对于姜瘟病的防治主要依赖于化学药物[6],通常使用高锰酸钾或甲醛对种姜进行消毒及施用氯化苦原液对土壤进行熏蒸,以减少种姜和土壤中的病原菌,但化学防治会产生一系列农药残留等问题[7]。目前用于姜瘟病生物防治的微生物主要为木霉(Trichoderma)、芽孢杆菌(Bacillus)和链霉菌(Streptomyces)等真菌、细菌和放线菌[8-10],但这些生防微生物多数只定殖于生姜根际土壤,受土壤环境因子影响较明显,导致田间生防效果不稳定,很难大面积推广应用,亟待发掘生防效果稳定的新型生防微生物。丛枝菌根(AM)是自然界中最普遍的一种菌根类型,是由球囊菌门(Glomeromycota)真菌与植物根系形成的互惠共生体,80%以上的陆地植物(约20万种)都能形成AM[11-13]。AM真菌是一类在改善土壤生态、抑制土传病害和提高植物抗病性等方面极具应用潜力的微生物资源,相对于木霉、芽孢杆菌和链霉菌等完全暴露在根际土壤中的生防微生物,其受到环境的影响较小,更容易获得稳定的防治效果。因此,分析健康和患病生姜样地根际土壤AM真菌的群落组成,对筛选具有抗病效果的AM真菌优势菌株及利用微生态调控手段进行姜瘟病综合防治具有重要意义。【前人研究进展】自Safir[14]首次发现接种摩西管柄囊霉(Funneliformismosseae)能降低由土棘壳孢(Pyrenochaetaterrestris)引起的洋葱根腐病发病率以来,众多研究已证实AM真菌能帮助宿主抵御病原物侵染[15],如对番茄青枯病、玉米纹枯病、黄瓜立枯病和甘薯菌核病等[16-18]均有明显的防治效果。已有研究表明,土传病害的发生与土壤微生物群落结构和土壤养分指标密切相关[19-20]。陈海念[21]开展烟草青枯病病区与健康区土壤微生物群落结构研究,结果发现烟草发生青枯病后期根际土壤微生物的物种数量略有减少;土壤有机质含量偏高会导致烟草青枯病病情加剧,青枯病发生后患病烟株根际土壤的全钾和速效钾含量显著高于健康烟株。Wang等[22]研究表明,与青枯病发病烟田相比,健康烟田烟株根际土壤具有较高的微生物群落多样性和丰富度。邓晓等[23]研究显示,中度和重度香蕉枯萎病危害土壤的真菌种类与轻度和无香蕉枯萎病危害土壤无明显改变,但真菌数量明显增加。汪茜等[24]研究发现,健康生姜根际土壤的AM真菌孢子数量明显高于患姜瘟病生姜根际土壤。目前,传统的平板计数法仍是生姜土壤微生物生态研究的主要方法,但由于可培养的微生物仅为自然界微生物总数的1%~10%,再加上一些人为限定的培养条件(如培养温度和培养时间)限制,该方法无法全面反映微生物生长的自然条件。因此,采用平板计数法对土壤微生物群落结构开展的研究通常仅局限于可培养细菌、真菌和放线菌数量的变化方面[25]。随着分子生物学方法的发展,数据分析系统渐趋完善,宏基因组测序方法中的Illumina MiSeq测序技术为微生物群落结构的深层次分析提供了更经济、高效、快捷的途径。【本研究切入点】目前,利用Illumina MiSeq测序技术分析患病生姜与健康生姜根际土壤AM真菌多样性的研究鲜见报道。【拟解决的关键问题】以患病生姜根际土壤和健康生姜根际土壤为研究对象,采用Illumina MiSeq高通量测序技术分析其AM真菌的群落多样性及理化性质差异,探究土壤中制约姜瘟病发生的关键因素,揭示姜瘟病发生与土壤微生物种群间的相关性,为利用微生态调控手段进行姜瘟病综合防治提供理论依据。
1 材料与方法
1.1 试验材料
患病生姜和健康生姜根际土壤10个样品分别采自桂林市全州县重病姜田(KJB2_S)、桂林市全州县健康姜田(KJJ2_S)、柳州市三都镇重病姜田(BMB1_S)、柳州市三都镇健康姜田(BMJ1_S)、柳州市柳城县重病姜田(LCB1_S)、柳州市柳城县健康姜田(LCJ1_S)、百色市德保县重病姜田(FGB_S)、百色市德保县健康姜田(FGJ_S)、百色市田林县重病姜田(NGB_S)和百色市田林县健康姜田(NGJ_S)。5个样地的土壤样品均采用五点取样法采集(各样地采集的样品最后分别混合为1个样品)。各土壤样品的理化性质见表1。
1.2 试验方法
DNA提取:按照土壤DNA提取试剂盒(Fast DNA spin kit for soil,Bio 101,La Jolla,Calif.)说明进行操作。
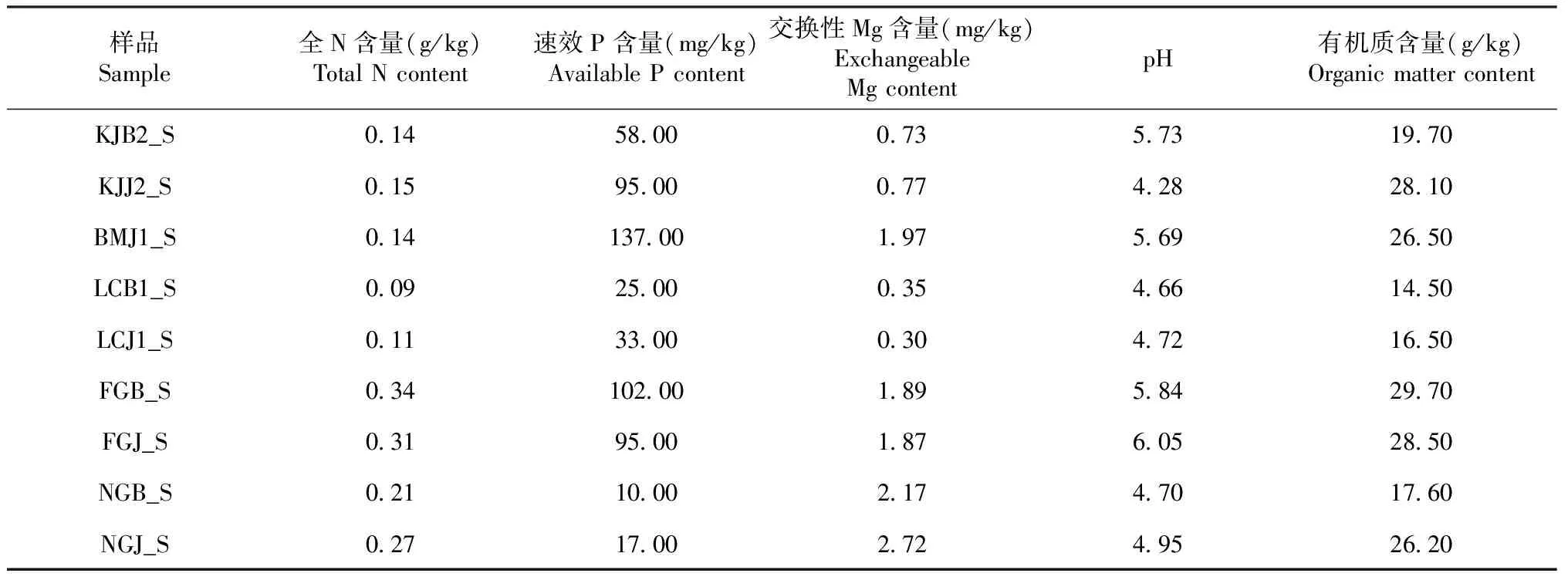
表1 患病生姜和健康生姜样地土壤的理化性质
PCR扩增:参考Wu等[25]的方法,使用巢式PCR对土壤AM真菌的SSU rDNA进行扩增,PCR引物为5′-AAGCTCGTAGTTGAATTTCG-3′和5′-CCCAACTATCCCTATTAATCAT-3′,扩增片段大小约300 bp。PCR反应体系50.0 μL:2.0 μL DNA 模板(第1次PCR)或2.0 μL PCR产物(第2次PCR)、5.0 μL 10×Buffer、0.5 μL dNTP(10 mmol/L each)、0.5 μLTaqDNA聚合酶(5 U/μL)、1.0 μL引物(50 μmol/L,上、下游引物各0.5 μL),最后用ddH2O补足至50.0 μL。扩增程序:95 ℃ 预变性5 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,进行25 个循环;72 ℃ 延伸10 min。扩增得到的PCR产物经1%琼脂糖凝胶电泳检测后,由上海美吉生物医药科技公司测序[26]。
1.3 统计分析
利用Mothur 1.30.1计算丰富度指数(Sobs和Chao 1指数)和多样性指数(Shannon-Wiener和Simpson指数),并进行多样性分析。利用Version 1.9.1分析属(Genus)分类水平上不同样品的AM真菌群落组成。利用Canoco 4.5中的冗余分析(RDA)明确AM真菌群落组成与土壤环境因子间的关系。基于Spearman等级相关系数,绘制优势属与环境因子相关性的Heatmap图[27]。

图1 不同生姜根际土壤样品的丰富度稀释曲线Fig.1 Dilution curves of different sample richness of soil in ginger
2 结果与分析
2.1 MiSeq测序结果
MiSeq测序结束后,共获得299680条有效序列,最终划分为312个AM真菌操作分类单元(OTU),隶属于1域1界1门1纲5目6科7属13种。采用随机抽样方法,以抽到的序列数与其对应的OTUs数构建丰富度稀释曲线(图1)。从图1可看出,随着测序量的不断增大,各样品的OTUs数增加趋于平缓,说明测序量能覆盖样本中的绝大部分物种。从图2可看出,Shannon-Wiener曲线趋于平缓,测序数据达到饱和状态,说明样品的大部分多样性已经产生,测序数据量足够大。

图2 不同生姜根际土壤样品的Shannon-Wiener曲线Fig.2 Shannon-Wiener curves of different samples of soil in ginger
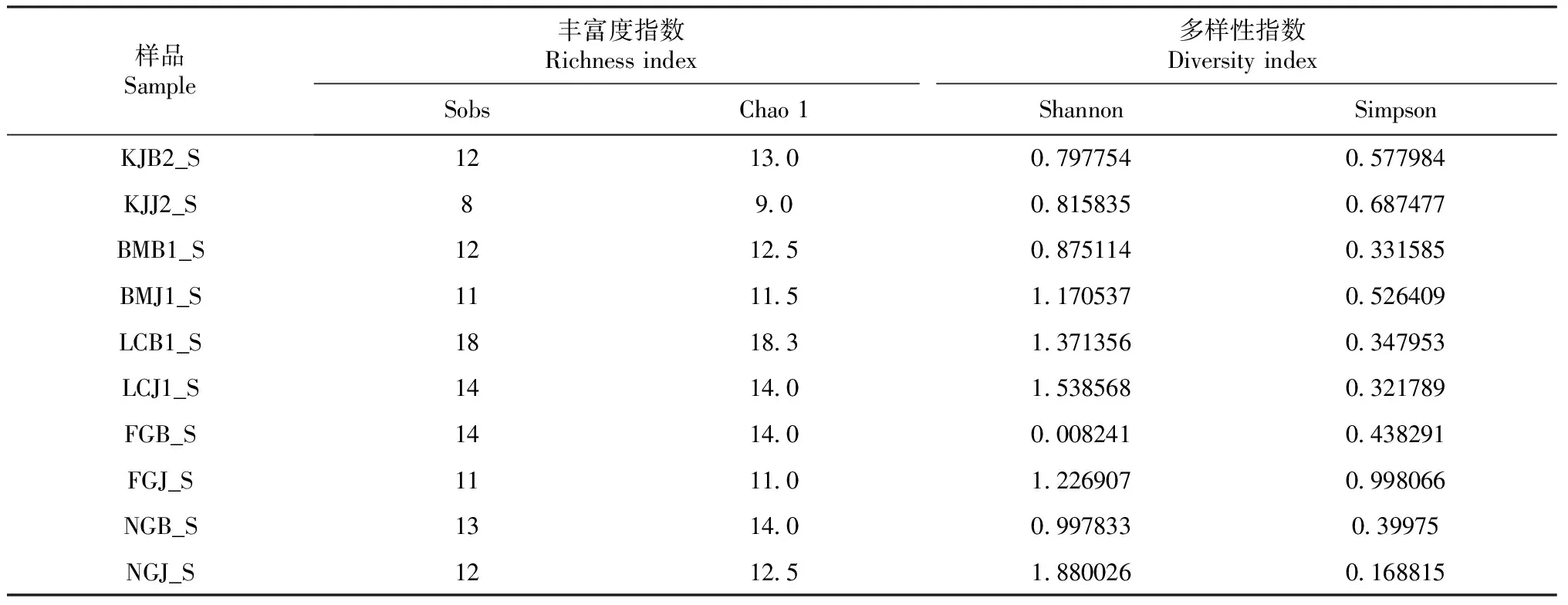
表2 生姜根际土壤中AM真菌的Alpha多样性指数
2.2 患病生姜和健康生姜根际土壤的AM真菌多样性
以Sobs指数和Chao 1指数评估AM真菌的物种丰富度,结果(表2)表明不同土壤样品AM真菌的丰富度存在差异;Chao 1指数的总体变化趋势与Sobs指数表现一致,Chao 1指数随着Sobs指数的升高而升高;所有患病生姜土壤样品的Sobs指数和Chao 1指数均高于对应健康生姜土壤样品的Sobs指数和Chao 1指数。以Shannon指数和Simpson指数评估AM真菌的物种多样性,结果(表2)发现所有健康生姜土壤样品的多样性均高于患病生姜土壤样品。
2.3 不同采样点生姜根际土壤的AM真菌群落组成
在属分类水平上,312个OTUs被分类为4个属和1个其他类别,4个属分别为类球囊霉属(Paraglomus)、无梗囊霉属(Acaulospora)、球囊霉属(Glomus)和球囊霉纲未分类的属(unclassified_c_Glomeromycetes)。从图3可看出,LCJ1_S、FGJ_S、LCB1_S和FGB_S样品的优势AM真菌属均为Glomus,且球囊霉属占比超过60%;NGJ_S和NGB_S样品的优势AM真菌属为Acaulospora;KJJ2_S样品的优势AM真菌属为Glomus,KJB2_S样品的优势AM真菌属为unclassified_c_Glomeromycetes;BMJ1_S样品的优势AM真菌属为unclassified_c_Glomeromycetes,BMB1_S样品的优势AM真菌属为Glomus。说明不同样地生姜根际土壤的AM真菌群落存在差异,但健康生姜根际土壤(KJJ2_S、BMJ1_S、LCJ1_S、FGJ_S、NGJ_S)的AM真菌群落组成总体上较患病生姜根际土壤(KJB2_S、BMB1_S、LCB1_S、FGB_S、NGB_S)稍微丰富。

图3 不同采样点生姜根际土壤AM真菌在属水平上的相对丰度 Fig.3 The relative abundance of AM fungi community on genus level at different sampling point
2.4 患病生姜和健康生姜根际土壤AM真菌群落结构的偏最小二乘法(PLS-DA)判别分析
患病与健康生姜土壤样品的PLS-DA分析结果(图4)表明,第一主成分(COMP1)可解释变量方差的13.49%,第二主成分(COMP2)可解释变量方差的14.03%,累计方差贡献率为27.52%;不同土壤样品在坐标系中的分布存在明显差异,健康生姜土壤样品与患病生姜土壤样品在横坐标轴可明显区分并聚成两个类群,说明健康生姜根际土壤的AM真菌群落组成与患病生姜根际土壤存在明显差异。此外,通过PLS-DA分析中样本点分布的离散情况(图4)也可看出,患病生姜土壤样品不同个体的微生物菌群组成差异较明显。
2.5 环境因子与真菌群落组成的关联分析结果
将测得的土壤理化性质作为环境因子与土壤样品真菌群落组成进行冗余分析,结果(图5)表明,有效P含量对土壤AM真菌的群落组成影响显著(P<0.05,下同),全N、有机质(Organic)、Mg含量和pH对AM真菌的群落组成无显著影响(P>0.05)。其中,在土壤速效P含量较高时,生姜生长对土壤中AM真菌的依赖性较小,AM真菌群落组成较简单,而在土壤速效P含量较低时,生姜生长对土壤中AM真菌的依赖性较大,AM真菌群落组成较丰富。通过Heatmap图分析不同环境因子对生姜根际土壤AM真菌属水平群落组成的影响,结果(图6)发现Paraglomus与有效P含量呈极显著负相关(P<0.01),与有机质含量呈显著负相关。可见,土壤有效P含量是主导土壤AM真菌群落组成的主要因子,健康生姜根际土壤的有效P含量普遍偏高于患病生长根际土壤,AM真菌群落组成也相对丰富。

图4 患病生姜和健康生姜根际土壤AM真菌的PLS-DA分析结果Fig.4 Analysis of soil AM fungi PLS-DA in healthy and diseased groups
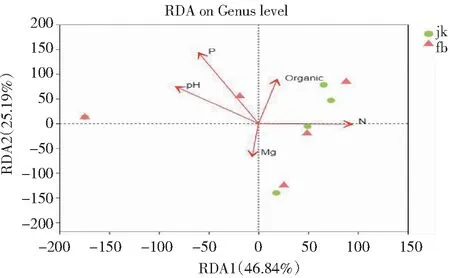
图5 土壤理化性质与AM真菌群落结构的冗余分析结果Fig.5 Redundant analysis of soil physicochemical properties and classification level of AM fungi
3 讨 论
本研究利用Illumina MiSeq测序技术首次探讨患姜瘟病生姜和健康生姜根际土壤AM真菌的群落结构,其中,使用特异性引物进行土壤AM真菌的SSU rDNA扩增,实测的AM真菌OTUs数和Shannon多样性指数的稀释曲线均能达到平缓期,说明本研究中AM真菌的丰富度和多样性均能较好地描述患姜瘟病生姜和健康生姜根际土壤的AM真菌群落。已有研究表明,病害发生能引起其根际土壤真菌富集,土壤真菌数量和致病真菌的种类均明显增加[28-30]。本研究发现,柳州市三都镇、桂林市全州县、柳州市柳城县、百色市德保县和百色市田林县5个样地患病生姜根际土壤AM真菌的OTUs数和丰度均高于健康生姜根际土壤,但真菌的多样性降低,与刘海洋等[30]的研究结果相似,说明姜瘟病的发病程度不是单纯由菌源数量决定,微生物数量高的姜田不能有效降低姜瘟病发病率,而土壤中的青枯菌数量才是决定姜瘟病发生的主导因素;生姜根际土壤球囊霉属和无梗囊霉属的相对丰度较高,其中有些样品中球囊霉属占比超过60%,与前人[31-32]对长期施肥农田、内蒙古盐碱土及青藏高原自然生态系统AM真菌群落结构的研究结果相似,说明球囊霉属和无梗囊霉属AM真菌在很多生态环境中均占据重要地位,能适应不同的环境条件。

图6 环境因子与菌群相关性的Heatmap图分析结果Fig.6 Correlation heatmap of environment factor and microflora
除地面植被外,土壤环境因子对AM真菌群落结构也具有非常重要的影响。大量研究表明,土壤pH、有机质和养分含量等均是影响土壤微生物群落结构的重要因素[33-34],但由于生姜在长期种植过程中土壤pH未发生明显变化,因此其根际土壤pH不是影响AM真菌群落发生变化的关键因子。本研究冗余分析结果表明,影响AM真菌群落组成的主要因子是土壤有效P含量,与Xiang等[35]、Likar等[36]的研究结果一致,表明土壤有效P含量可影响植物对AM真菌的依赖性,当土壤速效P含量较高时,植物不需要过多依赖AM真菌就能获得满足自身生长需求的P,从而逐渐降低对AM真菌的依赖,影响AM真菌群落组成;土壤有机质、全N、交换性Mg含量和pH与AM真菌群落组成的相关性不密切,与Xiang等[35]和Camenzind等[37]的研究结果存在差异,可能与开展研究地区土壤全N含量不同等有关。
4 结 论
健康生姜样地和患病生姜样地土壤的AM真菌群落组成存在明显差异,患姜瘟病生姜根际土壤AM真菌的OTUs数和丰度均高于健康生姜根际土壤,但其多样性低于健康生姜根际土壤;不同采样点生姜根际土壤AM真菌的优势种属存在差异,其多样性、丰度及群落组成和群落结构主要受有效P含量影响,健康生姜根际土壤的有效P含量高于患病生姜根际土壤。

