微生物菌肥对水稻土壤细菌群落结构与活性的影响
肖 娴,桂一峰,朱 艳,符 菁,朱雪松,朱 显,赵 远*
(1.常州大学环境与安全工程学院,江苏 常州 213164;2.江苏普泽环境工程有限公司,江苏 常州 213200)
【研究意义】水稻是世界上最重要的主食之一[1],在中国已有上千年的种植历史,对提高我国经济水平具有十分重要的作用,总而言之,“民以食为天,食以稻为先”[2]。在当前农业发展形势下,人们为了增加水稻产量,不断增加化肥、农药和化学壮秧营养剂等农用化学品的用量。然而,农作物对化肥的利用率却比较低,大约有70%的化肥不仅仅固定在土壤中,还易挥发或伴随着雨水而流失,结果导致了土壤有机质含量的降低、板结、酸化、有益微生物数量减少等一系列的问题。这使得农作物产量出现不同程度的减产及品质下降,不仅仅影响了土壤的可持续利用,更是对农业生产和人类健康造成了巨大威胁[3-4]。随着环境安全意识的普及,人们意识到目前迫切需要解决因化肥无节制的施用所引起的作物安全问题,因此我国致力于推广新型肥料的使用,以实现化肥、农药减量投入的“双减政策”[5]。【前人研究进展】微生物菌肥是含有特定微生物活体的制品,可以通过促进养分吸收和维持植物健康来促进植物生长,被认为是一种前景广泛的生物肥料[6],因其环境友好,功能全面,在农作物生产中逐渐代替化肥、农药等的使用。微生物菌肥如固氮菌、解磷菌等,通过其所含微生物的生命活动分解土壤中的有机物和无机物,增加土壤养分有效性,提高肥料的利用率,从而减少肥料用量[7]。【本研究切入点】光合细菌是地球上一类最早被发现且具有光能合成体系的原核生物,拥有较强的固定氮、碳的能力,在改善作物品质方面发挥重要作用[8]。在研究施加光合细菌对水稻株高、出穗率及产量等的影响中发现,光合细菌可以促进水稻生长并显著提高其产量[9]。此外,芽孢杆菌也是较为常用的微生物菌肥之一,它可分泌生长素和抗生素,刺激和调节水稻生长,提高水稻抗逆性及抗病能力,改善水稻品质及农业生态环境等[10]。【拟解决的关键问题】目前关于光合细菌和芽孢杆菌联合作用于农产品产量方面的研究依然较少。因此,本文以水稻作为研究对象,通过盆栽试验,研究水稻生长过程中施用单一及混合菌群对水稻产量、土壤酶活性及土壤微生物群落所引起的变化,分析在影响过程中发生的主要微生物机制,为今后应用于田间试验提供参考价值,同时为混合微生物菌肥在农业生产上以及发展新型高效肥料等推广应用方面提供参考。

表1 供试土壤初始理化性质
1 材料与方法
1.1 供试土壤
盆栽试验供试土壤为长期水稻土,取自于江苏省丹阳市某水稻田(珥陵镇31°51′54″N,119°35′27″E)。水稻种子购自农技站,供试水稻品种为南粳5055号。于2018年5—11月在常州大学知行楼北侧的空地进行,供试土壤的基本理化性质如表1。
1.2 供试菌株
本研究所用的微生物菌种包括沼泽红假单胞菌(Rhodopseudanonaspalustris)和枯草芽孢杆菌(Bacillussubtilis),均于新疆光合元生物科技有限公司采购。使用时首先将菌种在无菌培养基中培养24 h,然后以12 000 r/min离心10 min,将离心后的细胞重新悬浮在无菌蒸馏水中,最终达到2×108c.f.u./mL的浓度。
1.3 实验设计
本水稻盆栽试验包括4个处理,分别为常规施肥(Control)、沼泽红假单胞菌(R.palustris)、枯草芽孢杆菌(B.subtilis),沼泽红假单胞菌+枯草芽孢杆菌(R.palustris+B.subtilis,v/v=1∶1),每个处理3个平行。田间土壤自然风干破碎后过8目筛,每盆装入风干土 6 kg,播种采用人工插播,种植密度为每盆3穴,每穴2株,各处理放置在室外自然光下生长。菌液的施用量为24 mL/m2,常规施肥处理中施加等量灭菌后的菌液。分别在水稻分蘖期根灌1次,在抽穗期时喷施1次。各处理以每盆施入磷酸二氢钾1.71 g、氯化钾0.5 g、尿素 0.66 g 作为基肥,在水稻分蘖期和抽穗期追施氮肥(尿素:0.66 g),各处理作物生长作统一管理。
在水稻的收割期进行土壤样品采集,按五点法进行采样。将每个处理的土壤样品装入无菌聚乙烯袋中(约200 g),运回实验室;之后将其中约150 g存于4 ℃冰箱,用于测定土壤的理化性质及酶活性;另外50 g保存于-80 ℃超低温冰箱,用于土壤DNA的提取。
1.4 测定项目及实验方法
土壤理化性质测定方法如下[11]:碱解氮采用碱解扩散法;硝态氮采用氯化钙浸提—紫外可见分光光度法;铵态氮采用靛酚蓝比色法;有效磷采用钼锑抗比色法;土壤有机质采用重铬酸钾法。
土壤酶活性的测定方法如下[12]:土壤磷酸酶活性采用磷酸苯二钠比色法测定;土壤脲酶活性采用苯酚钠—次氯酸钠比色法测定;土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;土壤过氧化氢酶活性采用高锰酸钾溶液滴定法测定;土壤FDA水解酶活性采用紫外分光光度计进行测定。
土壤微生物总DNA提取:将2.0 g水稻土样置于研钵中使用液氮进行冷冻研磨后,采用土壤微生物DNA强力提取试剂盒(PowerSoil®DNA Isolation Kit)试剂盒提取水稻土的总DNA,详细操作步骤参见试剂盒说明书。
16S rDNA测序:采用Illumina测序平台MiSeq系列测序仪,对细菌 16S rDNA(V4-V5区)进行高通量测序,委托上海天昊生物科技有限公司完成。首先,基因组 DNA 质量的检测分为两个部分鉴定是否能支撑文库的扩增及其构建,对于抽提的基因组 DNA 其完整性可以通过琼脂糖凝胶电泳系统来检测(电泳条带清晰可见且明显降解),以及使用 Nanodrop 2000 检测出的高质量则要满足(浓度≥20 ng/μL,总量≥500 ng,OD260/280=1.8~2.0)。其次,进行目的区域(土壤细菌 16S rRNA 序列V4-V5区片段)检测扩增,然后添加能够区别各样本的标签序列。随后对文库进行定量,将样本按照比例混合后通过Agilent 2100 Bioanalyzer检测确定测序文库浓度。最终利用Miseq上机测序,将得到的序列与RDP数据库作比对,确认物种后进行生物信息分析的研究策略。
1.5 数据分析
土壤理化性质及酶活性、微生群落多样性之间的相关性采用Pearson相关性分析法;显著性差异分析采用单因素方差分析 ANOVA(Duncan)在 SPSS 22.0(IBM SPSS Statistics 22)中完成;使用 Origin 9.0 软件绘制成图。土壤微生物群落的α-多样性指数包含了物种多样性(Shannon 指数)和丰富度(Chao 指数);群落的β-多样性分析是基于所有 OUT 代表序列以样本间 Bray-Curtis 距离进行评估的。以上α-多样性和β-多样性分析均在R-3.2.5(vegan 数据包)中完成。冗余分析(RDA)使用R软件中vegan包进行数据分析,即物种组成(OUT 丰度表)和环境因子数据进行对应分析,图的呈现由 Origin 所绘制,从而可直观反映出影响群落结构变化的主要因素。利用结构方程模型(SEM)分析土壤氮、有机质、细菌群落结构、Shannon多样性和微生物酶活性对水稻产量的直接和间接影响。
2 结果与分析
2.1 微生物菌肥对水稻产量及土壤理化性质的影响
2.1.1 微生物菌肥对水稻产量的影响 本研究基于盆栽试验探究了微生物菌肥对水稻产量的影响。结果表明对照组(Control)水稻产量最低,施加混合菌群比单一菌肥对水稻产量的提高效果更显著,其中混合菌群处理组水稻产量比对照高17.71%,达到了7893 kg/hm2(图1)。这与史鸿志等[13]人结果相似,对种植水稻的土壤中施用混合微生物肥后对水稻产量的影响和产生效益情况,结果显示在同等施肥成本条件下,与传统的施肥相比较,混合微生物肥的增产幅度为 331.41 kg/hm2,通过增加每穗粒数和实粒数的方法,水稻产量与原来相比有了明显增加。
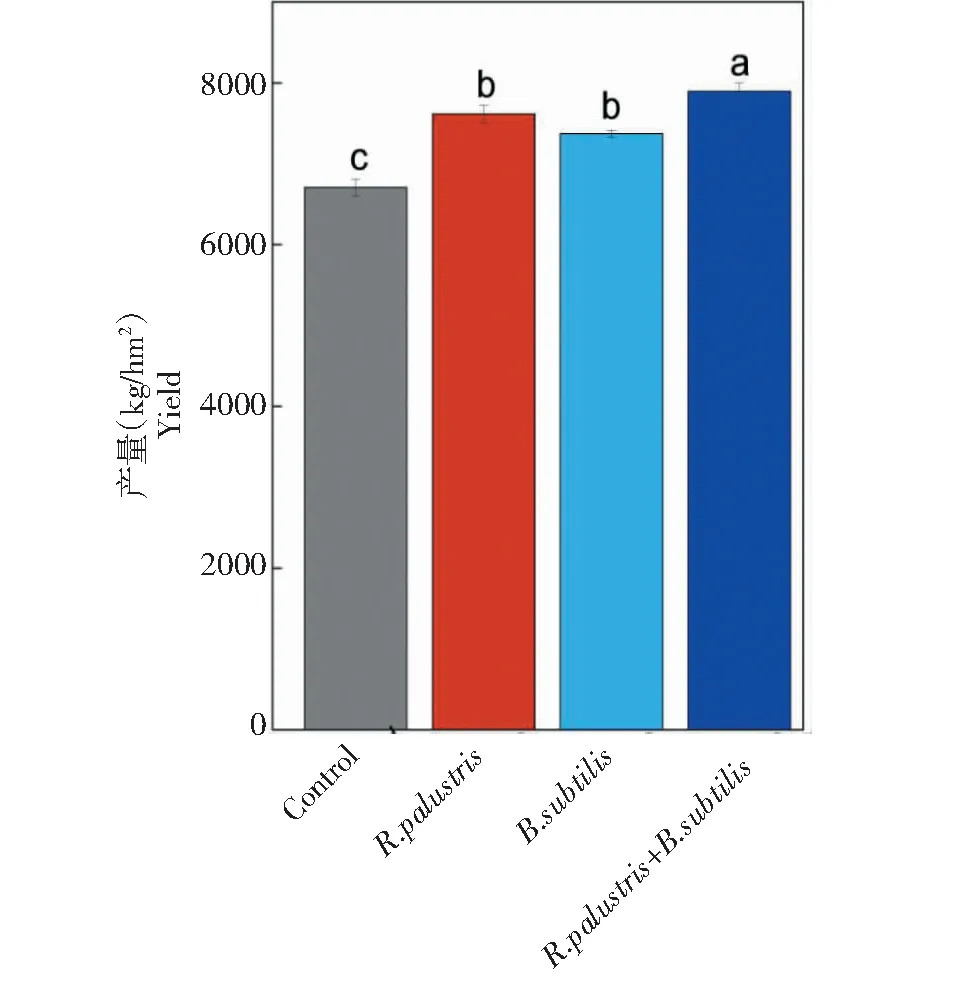
不同小写字母表示处理间差异显著(P<0.05) The different lowercase letters indicate significant differences among treatments (P<0.05)图1 施用微生物菌肥对水稻产量的影响Fig.1 Effect of microbial inoculations on the rice yield
通常水稻产量是反映土壤肥力和土壤养分稳定输出的关键。混合菌群施用于土壤中,能满足水稻生长对氮素营养和微量元素的需求,促进土壤有机质的分解转化,使土壤中有益微生物能够快速繁殖。大量研究表明,施用微生物菌肥增加了水稻根际土壤中的细菌数量,改善了土壤微生态环境,加快了土壤养分的转化,促进水稻根部生长、茎秆粗壮,提高了水稻产量[14-15]。另外微生物活动可以使土壤疏松,改善土壤的渗透性和结构。在水稻分蘖期间,施用混合微生物菌肥可以提高土壤中有益微生物的数量,从而产生更多的代谢产物。这些代谢产物会促进作物生长,为作物提供足够的养分,从而提高作物的产量。杜海霞等[16]人通过研究发现,在减少化肥用量、增加混合微生物肥料用量的情况下,能有效提高大姜的出箭数,使作物达到 12.8%的增产效果。
2.1.2 微生物菌肥对土壤理化性质的影响 微生物菌肥的施加显著影响了土壤的化学性质(表2)。微生物接种对土壤硝态氮、碱解氮和pH值的提高较为显著(P<0.05),其中施用沼泽红假单胞菌(R.palustris)、枯草芽孢杆菌(B.subtilis)以及混合菌群(Mix)分别高出对照组29.17%、9.52%和18.31%。说明微生物菌肥的添加有助于缓解土壤酸化的问题。除此之外,硝态氮和碱解氮提升也可能是混合菌中具有自生固氮能力的菌株(沼泽红假单胞菌)发挥了固氮作用,同时混合菌中的芽孢杆菌加快了土壤有机氮的矿化[17]。两种菌肥混合后能够大大提升土壤中可被植物吸收的的养分,同时减少化肥的投放量[18]。
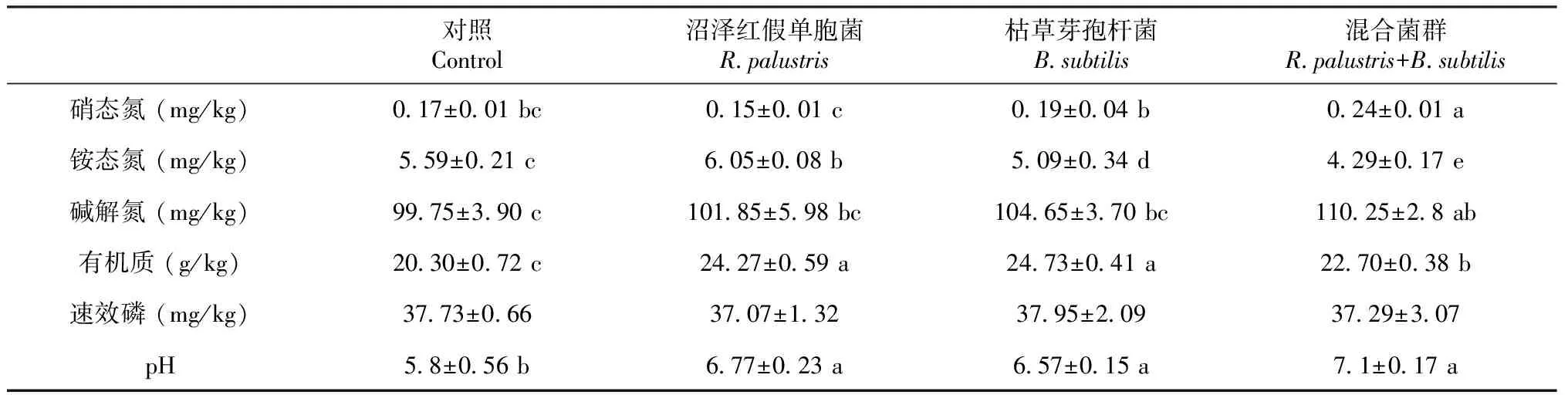
表2 施用微生物菌肥对土壤化学性质的影响
单独施加枯草芽孢杆菌处理组中的有机质和速效磷的含量最高,这与逄焕成在研究微生物菌肥对土壤理化性质中得到的结论一致,在土壤有机质状况得到改善时,减少了磷的固定,从而提高土壤磷有效性[19]。郜胜涛等[20]在使用微生物菌肥代替化肥研究水稻土壤理化性质时也发现了类似的结果,微生物菌肥中因含有多种微生物,可以增加土壤有机质的含量,从而提高了土壤的pH值及其肥力。对于铵态氮的变化,发现在施用沼泽红假单胞菌处理组中其含量是最高的,其它两组处理中铵态氮含量都显著低于对照组。推测原因可能是在通透性较好的土壤中添加芽孢杆菌后容易造成土壤氮素的淋失和流失[21-22]。
2.2 微生物菌肥对土壤微生物酶活性的影响
施用微生物菌肥后,土壤中微生物酶活性较对照组均有显著提高(表3),其中添加枯草芽孢杆菌处理组过氧化氢酶和脲酶活性相对最高,分别比对照组处理高了20.88%和29.03%(P< 0.05)。过氧化氢酶广泛存在于土壤中和生物体内,并有效参与物质和能量在土壤中的相互转换,在一定程度上其活性主要与土壤有机质及微生物数量有关,可表征土壤腐殖质化强度大小和土壤生物氧化过程的强弱[23]。添加枯草芽孢杆菌的土壤其群落结构得到了改善,土壤肥力得到增强,物质转换和循环加快,从而过氧化氢酶活性也得到了提升[24]。土壤脲酶的提升能够催化土壤中的尿素转化为NH3和CO2,常用脲酶活性表征土壤供氮能力[25]。
此外,添加混合菌群处理组中的磷酸酶和蔗糖酶含量最高,可能由于混合菌群内含有丰富的活性物质对土壤磷酸酶活性产生了影响,使土壤磷酸酶促进作物对磷素营养的吸收利用,增强土壤速效磷的有效性[24],从而导致磷酸酶的升高。土壤蔗糖酶,是有机碳分解的重要指标[26],也是表征土壤生物学活性的一种重要水解酶[27]。蔗糖酶的提高可能是由于混合菌群中有益菌群加速了土壤有机化合物的分解,提供了酶促反应底物,从而促进了微生物的生长,而蔗糖酶是土壤微生物生长代谢的产物,所以将微生物菌肥混合使用时更能有效提高土壤蔗糖酶的活性[28]。此外,施加沼泽红假单胞菌的处理组中FDA水解酶活性最高。
2.3 施用微生物菌肥对土壤微生物群落的影响
2.3.1 土壤微生物群落多样性 为了揭示通过施加不同微生物菌肥后各处理的土壤细菌群落物种多样性及丰富度的变化情况,并将测序所获得的样品 OTUs 进行处理后加以分析可得每个处理间α-多样性指数的差异,主要通过 Shannon、Chaol、ACE和Observed指数和进行分析(图2)。其中 Chao1 指数、ACE 指数和Observed指数用于表征细菌的丰富度,Shannon 指数表征微生物的多样性和均匀度,是目前描述物种多样性的常用统计指标[29]。对照组、沼泽红假单胞菌、枯草芽孢杆菌、混合菌群处理组所对应每个 OUTs 数量大小依次为 5304、5288、5022和5011。分析结果发现四个处理的多样性指数之间均无显著差异(P> 0.05),表明表明微生物菌肥未能显著改变土壤中细菌的丰富度,在提高土壤细菌多样性和均匀度方面也没有显著作用。但是在不同处理间的Shannon指数、Chao1指数和ACE 指数中,沼泽红假单胞菌处理组的Shannon指数(7.13)和Chao1 指数(6948)相对于其他处理来说是最高的。此外,施加枯草芽孢杆菌处理组和混合菌群处理组的多样性指数均低于对照组。所以,施加微生物菌肥会适当降低细菌的物种数目,其群落多样性和丰富度也会随之减少,对土壤细菌群落结构多样性产生的影响也是有所不同的。
2.3.2 土壤微生物群落组成 施加不同微生物菌肥后,各处理组的细菌相对丰度都发生了变化。从图3中可以看出变形菌门(Proteobacteria)是所有处理土壤中的优势门类。此外,绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的相对丰度也相对较高。
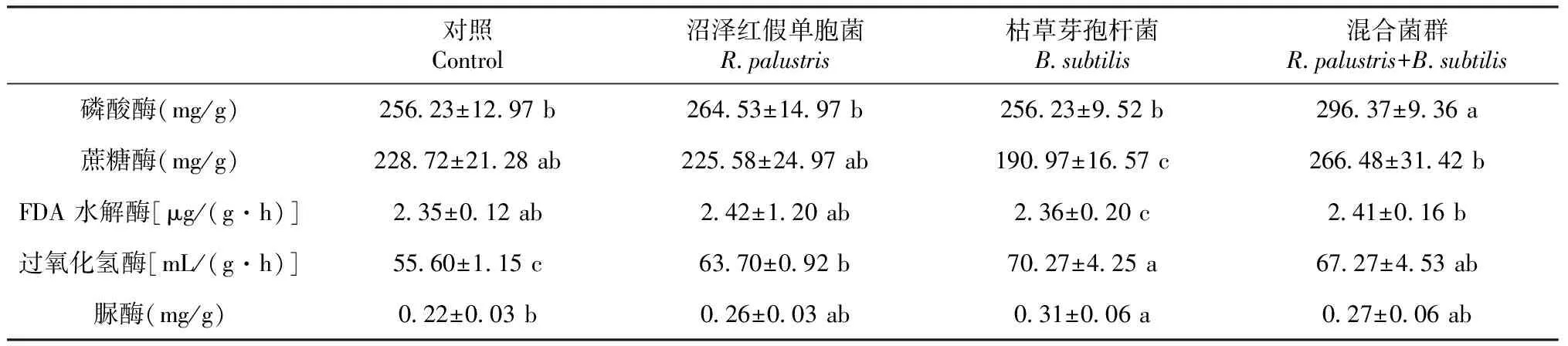
表3 施用微生物菌肥对土壤酶活性的影响

不同小写字母表示处理间差异显著(P<0.05) The different lowercase letters indicate significant differences among treatments (P<0.05)图2 土壤细菌群落的α-多样性指数Fig.2 The α-diversity index of soil bacterial communities
与对照处理相比,施用沼泽红假单胞菌处理中,酸杆菌门与放线菌门的相对丰度发生变化,分别提高了 42.78%和 32.44%(P>0.05);在枯草芽孢杆菌处理中,丰度变化提高最为明显的是厚壁菌门(38.46%),其次为酸杆菌门(21.40%),随后是放线菌门(16.36%);混合菌群处理中,微生物类群相对丰厚影响由高到低的顺序是:放线菌门>厚壁菌门>酸杆菌门,相对丰度值分别为70.04%、54.87%、37.01%。与对照处理组相比,除沼泽红假单胞菌处理外的其他处理相对丰度均有提高的是厚壁菌门。结果说明在不同微生物菌肥的作用下,会对细菌类群的相对丰度造成不同程度的影响。

图3 不同处理土壤细菌类群相对丰度图Fig.3 Relative abundance of soil bacteria under different treatments
2.3.3 土壤环境因子与微生物群落之间的关系 为了解施用微生物菌肥后土壤化学性质与微生物群落之间的潜在关系,以细菌群落 OTU(聚类>97%)数据作为物种数据,土壤化学性质数据用作环境变量进行冗余分析(RDA)。RDA分析的前两个排序轴总共解释土壤细菌群落组成的72.88%累积解释量,其中第一排序轴(RDA1)解释了52.61%,第二排序轴(RDA2)解释了20.27%。如图4所示,沼泽红假单胞菌处理组、混合菌群处理组群落结构的土壤环境影响因子主要是集中在第一、二排序轴负半轴上,它们的相关性依次为铵态氮(r= 0.762,P<0.01)、碱解氮(r= 0.581,P< 0.05)、pH、硝态氮、有机质和有效磷。不同的环境因子对土壤细菌群落的变化也会存在不同程度的影响,其中产生影响最大的是铵态氮。对照处理组的土壤细菌群落结构变化与所选取的影响因子相关性比较小。混合菌群处理组的群落结构变化主要是受到硝态氮含量高低的影响。土壤细菌群落的变化受到铵态氮和碱解氮的影响且呈现出较强的正相关关系。这可能是因为施入不同微生物菌肥在不同程度上对细菌群落的变化会产生一定的影响,其中混合菌群中含有沼泽红假单胞菌、枯草芽孢杆菌这两种微生物,沼泽红假单胞菌能使某些土壤有益微生物的增殖,芽孢杆菌对某些细菌具有抑制或刺激作用。本实验结果与柳晓磊等[30]研究结果一致,通过在香蕉土壤中施用微生物菌肥,由 RDA 结果表明,碱解氮对细菌群落结构影响较大主要是由于施用微生物菌肥所造成的直接影响(P<0.05)。
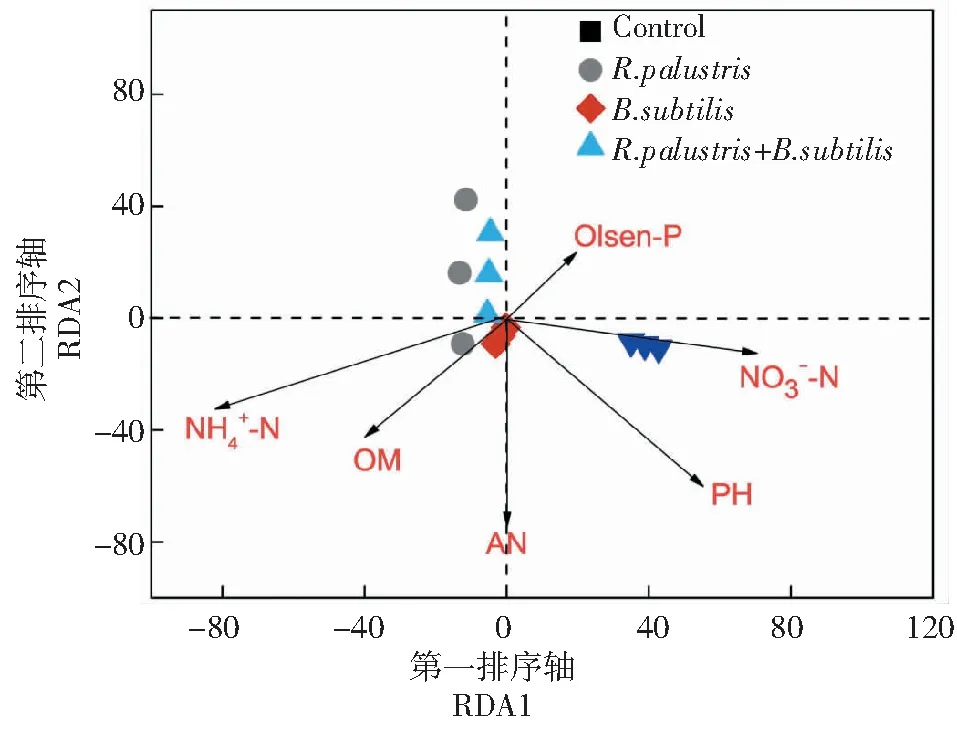
Olsen-P:有效磷;硝态氮;铵态氮;AN:碱解氮;OM:有机质 nitrogen;AN,alkaline hydrolysis of nitrogen;OM,organic matter图4 冗余分析方法确定土壤环境因子对细菌群落组成的影响Fig.4 The influence of soil environmental factors on bacterial community composition by redundancy analysis
2.4 土壤微生物群落组成对水稻产量的潜在影响
为了探究在门水平上土壤细菌群落与水稻产量之间的关系,将细菌类群的相对丰度和水稻产量之间进行Pearson相关性分析,其结果如下表4所示。在水稻生长收割期,有5个细菌类群与土壤理化因子表现出了显著相关(P<0.05)。其中,酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)与水稻产量(r=0.828~0.870,P<0.05)呈极显著正相关性,而绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)与水稻产量(r=-0.801~-0.771,P<0.05)呈极显著负相关。

表4 土壤细菌类群相对丰度与水稻产量间的相关关系
研究发现施加微生物菌肥能显著提高水稻产量,所以采用一种含有指示变量与潜在变量的结构方程模型(SEM)方法用以推断出土壤氮、SOM、微生物酶活性、细菌群落结构和微生物多样性对水稻产量的直接和间接影响(卡方值=3.89;自由度=2;图5)。结构方程模型分析的结果说明,土壤氮与有机质对产量均有着直接正向影响。首先,利用微生物菌肥改良土壤养分可以直接促进水稻植株的生长,因为微生物菌肥在参与土壤养分循环方面起着关键作用[31]。另外,微生物菌肥施加到土壤中后分泌的有机酸能释放土壤颗粒对有效氮、磷、钾进行吸附,从而延长土壤养分对水稻植株的有效供给[32]。
此外,施加微生物菌肥引起的细菌群落组成的改变可能有助于群落功能的转变。比如酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)等有益菌群的增加,不仅保护了植物的生长,而且促进了它们对营养物质的吸收[33],微生物菌肥也可以和这些有益微生物作为植物对抗病原体的有益联合体。同时,一些可能对土壤产生负面影响的菌群由于微生物菌肥的施加而显著减少,如着色菌门(Allochromatium)等[34]。
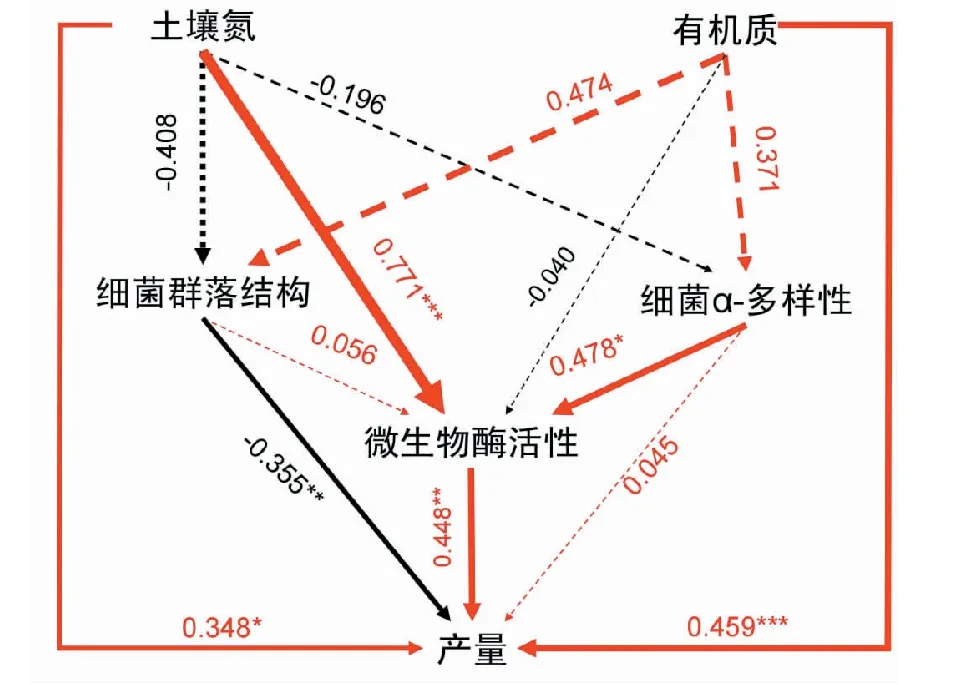
红线表示正影响,黑线表示负影响;显著路径(P<0.05)用实线表示,不显著路径(P>0.05)用虚线表示;连线粗细表示回归系数的大小 Red line indicates a positive impact.Black lines indicate negative effects.Significant path (P< 0.05) was represented by solid line.The non-significant paths (P> 0.05) were represented by dashed lines.The thickness of the line indicates the size of the regression coefficient图5 土壤肥力及微生物互作对产量影响的结构等式方程图Fig.5 Effects of soil fertility and microbial interaction on yield based on structural equation
细菌的α-多样性可以影响微生物酶活性从而间接影响水稻产量。土壤酶是土壤中动植物和微生物活动的产物,数量极微作用却极大的土壤组成部分,在物质转化、能量代谢和土壤修复等过程中起着重要作用[35-36]。虽然有研究表明细菌群落组成的改变可能不会由于细菌冗余而改变系统的功能[37],但本研究实验结果显示微生物菌肥对土壤酶活性产生了巨大影响,进而促进了水稻植株的生长。相关性分析揭示了水稻产量与微生物酶活性(r=0.448)之间的显著关系,这可能与土壤中的碳和磷循环密切相关[38]。微生物酶活性的显著增加,表明了施加的微生物菌肥(沼泽红假单胞菌和枯草芽孢杆菌)与土壤中的宿主微生物之间存在着积极的相互作用。Prasanna等[39]人通过施加微生物菌肥促进了土壤碱性磷酸酶和脱氢酶活性从而改善了土壤质量。
3 结 论
(1)微生物菌肥的施用能有效提高水稻产量,其中混合菌群处理组的作用最显著,此外经微生物菌肥处理的土壤化学性质也产生了变化,其差异都达到了显著水平,其中混合菌群处理组对土壤的硝态氮、碱解氮和pH值的提高较为显著(P<0.05),单独施加枯草芽孢杆菌处理组中的有机质和速效磷的含量最高。
(2)与对照组相比,微生物菌肥施用后土壤中酶活性都有显著提高,其中添加枯草芽孢杆菌处理组过氧化氢酶和脲酶活性相对最高,添加混合菌群处理组中的磷酸酶和蔗糖酶含量最高,施加沼泽红假单胞菌处理组中FDA水解酶活性最高。
(3)施加不同微生物菌肥后各处理的土壤细菌群落物种多样性及丰富度并没有发生显著变化,但是细菌相对丰度都发生了变化。不同的环境因子对土壤细菌群落的变化也会存在不同程度的影响,其中产生影响最大的是铵态氮。
(4)结构方程模型结果显示,利用微生物菌肥改良土壤养分可以直接促进水稻植株的生长,细菌群落组成的改变也可能有助于群落功能的转变,此外细菌的α-多样性可以通过影响微生物酶活性从而间接影响水稻产量。

