南亚热带森林2种菌根类型树木水分传导和养分利用策略的对比研究
赵敏, 练琚愉, 刘小容, 刘慧, 叶清*
南亚热带森林2种菌根类型树木水分传导和养分利用策略的对比研究
赵敏1,2,3, 练琚愉1,2, 刘小容1, 刘慧1, 叶清1,2*
(1. 中国科学院华南植物园退化生态系统植被恢复与管理重点实验室,广州 510650; 2. 南方海洋科学与工程广东省实验室(广州),广州 511458; 3. 中国科学院大学,北京 100049)
为揭示南亚热带季风常绿阔叶林在季节性干旱加剧和氮沉降增加等环境影响下,菌根树木优势度变化趋势机理,对3种优势EM树木黄杞()、锥()、黧蒴锥()和3种优势AM树木云南银柴()、山蒲桃()、广东金叶子(var.)的水力性状和养分性状进行了研究。结果表明,EM树木叶片导水率下降50%和88%时的水势(50、88)和膨压丧失点(tlp)均低于AM树木,边材比导水率(S)、叶片比导水率(L)、光合氮利用效率(PNUE)和光合磷利用效率(PPUE)均高于AM树木。可见,EM树木比AM树木具有更强的抗旱能力以及更高的导水效率和养分利用效率,这可能是在干旱加剧和氮沉降增加背景下EM树木优势度增加而AM树木优势度减少的生理机制。
外生菌根树木;内生菌根树木;水力性状;养分性状;南亚热带森林
近几十年来, 人类活动加剧导致我国南亚热带季风常绿阔叶林面临多种环境变化,其中最突出的是季节性干旱加剧和氮沉降增加[1–3]。干旱时植物水势下降会造成导管栓塞和叶片气孔关闭,进而影响植物水分传导和光合作用,导致植物生长受限甚至死亡[4–5]。此外,亚热带地区氮沉降降低了土壤磷含量,加剧植物生长的磷限制,使得植物生长的养分条件更加恶化[6]。与真菌共生形成菌根是植物最常见的水分养分吸收策略,以协助自身生存和生长[7]。菌根真菌吸收土壤中的水分和氮磷等矿质营养并提供给宿主植物,宿主植物则为菌根真菌提供光合产物[8]。80%的植物根系与真菌以不同形式共生形成菌根,其中外生菌根(ectomycorrhiza, EM)和内生菌根(arbuscular mycorrhiza, AM)是2种最常见的菌根类型[9–11]。EM真菌侵染宿主植物根系后, 在根内形成包裹皮层细胞的哈氏网并向外形成包裹根尖的菌鞘和延伸到根外的菌丝[12]。AM真菌侵染的菌丝能够穿透植物根系细胞壁,在根系皮层细胞内形成丛枝体和囊泡[13–14]。2种菌根类型的真菌侵染方式具有很大差异,这可能导致它们的水分养分吸收能力不同。Allen指出EM真菌比AM真菌具有更大的菌丝生物量,能够更有效地转运土壤中的水分[15],因此与EM真菌共生的植物可能具有更强的水分传导能力。此外在营养吸收方面,EM真菌能够通过菌丝网包罗有机体并分泌酶降解有机体获得植物可利用氮磷, AM真菌则主要直接吸收土壤中无机态氮磷[11]。因此,在土壤氮磷以有机态形式为主的温带和北方森林,与EM真菌共生有利于植物生存与生长;热带地区的土壤营养元素主要是无机态形式,更有利于AM植物生长[11]。南亚热带处于热带和温带的过渡地区,大量EM植物和AM植物在季风常绿阔叶林中共存,但是有关2种菌根类型植物的氮磷获取和利用能力的差异还鲜有研究。
植物功能性状能够反映植物对环境的响应和适应,其中水力性状反映植物对水分的吸收、传导和利用情况[16]。边材比导水率(S)和叶片比导水率(L)分别表征植物枝条和叶片的水分运输效率,水分运输效率高的植物能够具有更高的养分运输效率和光合速率[17–18]。叶片水势下降50%时的导水率(50)、叶片水势下降88%时的导水率(88)和膨压丧失点(tlp)均是衡量植物水力传导安全的重要水力性状, 能够表征植物的抗旱能力[19–21]。而植物养分性状反映植物的养分吸收与利用策略[16],包括叶片单位质量氮含量(mass)、单位质量磷含量(mass)、叶片光合氮利用效率(PNUE)和光合磷利用效率(PPUE)等[22–23]。
鼎湖山大样地是典型的南亚热带季风常绿阔叶林,季节性干旱加剧和氮沉降增加导致该森林EM树木优势度升高而AM树木优势度降低。菌根类型可能影响植物水分和养分获取能力,从而影响植物对水分和养分条件变化的响应,导致2类树木优势度呈现相反的变化趋势。水力性状和养分性状直接反映植物对水分和养分的吸收和利用情况,因此能够指示不同菌根类型树木的适应能力。本研究以6种南亚热带季风常绿阔叶林优势物种(3种EM树木和3种AM树木)为研究对象, 测定其水力性状和养分性状,以探究季节性干旱加剧和氮沉降增加背景下EM树木优势度增加而AM树木优势度减少的原因,为此地区森林如何响应环境变化提供重要的生理解释。
1 材料和方法
1.1 研究地概况
鼎湖山大样地位于广东省肇庆市鼎湖区,处于鼎湖山自然保护区(23.16°~23.19° N, 112.51°~112.56°E)中心地带,年均温度20.9℃,年均降雨量1 956 mm, 森林类型是典型的南亚热带季风常绿阔叶林[24]。受季风影响,降水量全年分布不均,其中湿季降水量占全年降水量的80%[25]。大样地建立于2005年, 海拔230~470 m,东西长400 m,南北长500 m,面积为20 hm2[26],从2005年开始,每5 a对样地内胸径≥1 cm的木本植物进行每木调查,记录种名、编号、胸径等[27]。
1.2 材料
通过文献确定鼎湖山季风常绿阔叶林中优势度(基于胸高断面积)高树木的菌根类型,本研究选取3种EM树木黄杞(, 缩写ER, 下同)[28–29]、锥(, CC)[2,30]、黧蒴锥(, CF)[28–29]和3种AM树木云南银柴(, AY)[29]、山蒲桃(, SL)[29,31]、广东金叶子(var., CSK)[28],测定其水力性状和养分性状。
1.3 方法
清晨5:00-7:00采集同一物种3~5株健康成熟个体的5~10根向阳的冠层枝条(直径约为1 cm), 置于黑色塑料袋中并喷撒少量水雾,密封并迅速带回实验室,用于后序试验。
边材比导水率和叶片比导水率 用Sperry等[32]的方法测定。枝条基部没在已除气的超纯水中剪下至少5 cm, 喷洒少量水雾并放入湿毛巾后罩上黑袋防止失水。将枝条逐根没在已除气的超纯水中剪下6段直径5~10 mm、长度20~25 cm的茎段并剥去两端一小段树皮, 在压力喷壶0.1 MPa加压下用已过滤并除气的KCl溶液(0.02 mol/L)冲洗20 min,以去除茎段内的栓塞。控制室温25℃,利用水力传导装置,在0.005 MPa的压力下让KCl溶液(0.02 mol/L)流经茎段并记录流速(, mmol/s)。将茎段取下后测量长度(, m)、边材面积(S, m2)和总叶面积(L, m2)。边材比导水率[s, kg/(m·s·MPa)]=(×)/(S×0.005), 叶片比导水率[L, mg/(m·s·MPa)]=(×)/(L×0.005)。
叶片的50和88将枝条基部没在已除气的超纯水中剪下至少5 cm,喷洒少量水雾并罩上黑袋复水过夜。第2天用蒸腾法测量叶片各水势(leaf, MPa)下的标准温度导水率[leaf(25℃),mmol/(MPa·m2·s)][33]。以leaf为横坐标,leaf(25℃)为纵坐标绘制拟合曲线[34],得到叶片导水率下降50%时的水势(50, MPa)和叶片导水率下降88%时的水势(88, MPa)。
叶片膨压丧失点 将枝条基部没在已除气的超纯水中剪下至少5 cm,喷洒少量水雾并罩上黑袋复水过夜。第2天选取健康成熟叶片,迅速测量饱和鲜重(SW, g)。用压力室(PMS, Corvallis, Oregon, USA)测定叶片水势后称取对应的鲜质量(FW, g),然后静置叶片,待水势约下降0.3 MPa,再次测量叶片水势和鲜质量,重复此步骤直至叶片水势无明显下降。测定后将叶片于70℃烘72 h,称量干质量(DW, g)。叶片相对含水量RWC=100×(FW-DW)/(SW-DW), 采用Schulte等[35–36]的方法拟合叶片水势和相对含水量曲线,得到膨压丧失点(tlp, MPa)。
叶片氮磷含量 将叶片烘干磨碎后测定叶片氮磷含量。用凯氏定氮法测量叶片的总氮含量, 计算单位质量叶片氮含量(mass, mg/g),用原子吸收光谱法测量叶片的总磷含量,计算单位质量叶片磷含量(mass, mg/g)。
叶片光合氮磷利用效率 每物种选取3~5株,每株至少采集20片健康、展开且向阳的叶片。用叶面积仪(Li-3000A; Li-Cor, Lincoln, NE, USA)测定去掉叶柄的叶片面积(LA, m²),然后放入70℃烘箱烘72 h,测量叶片干质量(DW),比叶重(LMA, g/m2)为单位面积叶片质量,即LMA=DW/LA。每物种选取3~5株,每株选取5片健康成熟且阳生的叶片,用光合仪(Li-6400, Li-Cor, Lincoln, NE, USA)测定叶片最大净光合速率[area,mol/(m2·s)]。选择晴天9:00-11:00测定,测前预热15 min,光量子密度设为1 500mol/(m2·s),叶片温度设为28℃,腔室CO2浓度设为400mol/mol。光合氮利用效率[photo- synthetic nitrogen use efficiency, PNUE,mol/(mol·s)]= (area×14000)/(mass×LMA), 光合磷利用效率[photo- synthetic phosphorous use efficiency, PPUE]=(area× 31)/(mass×LMA), 单位为mmol/(mol·s)。
1.4 数据分析
用R语言包拟合叶片水力脆弱度曲线获得叶片50和88[34],用Excel 365对EM和AM树木性状指标进行检验并作图。
2 结果和分析
结果表明(图1, 表1),EM树木叶片导水率下降50%时的水势(50)显著低于AM树木(<0.05), 分别是-1.69和-1.06 MPa。EM树木叶片导水率下降88%时的叶片水势(88)显著低于AM树木(< 0.05),分别是-2.95和-1.72 MPa。同时EM树木叶片的膨压丧失点(tlp)为-2.12 MPa,显著低于AM树木的-1.49 MPa (<0.05)。
从图2可见,EM树木的边材比导水率(S)显著高于AM树木,分别为5.17和1.32 kg/(m·s·MPa) (< 0.05)。EM树木的叶片比导水率(L)显著高于AM树木,分别是0.62和0.22 mg/(m·s·MPa) (<0.05)。
EM树木和AM树木的单位质量叶片氮含量(mass)和磷含量(mass)没有差异。但是EM树木的光合氮利用效率(PNUE)显著高于AM树木(<0.05), 分别是112.78和49.25mol/(mol·s),并且EM树木的光合磷利用效率(PPUE)为4.76 mmol/(mol·s),极显著高于AM树木[2.19 mmol/(mol·s)] (<0.01, 图3)。

图1 EM和AM树木叶片导水率下降50%时的水势(P50)、导水率下降88%时的水势(P88)和膨压丧失点(Ψtlp)。*: P<0.05。

图2 EM和AM树木的边材比导水率(KS)和叶片比导水率(KL)。*: P<0.05。
3 结论和讨论
近几十年来南亚热带季风常绿阔叶林土壤水分养分和环境条件发生了很大变化,导致EM树木优势度增加而AM树木优势度减少。本研究利用植物地上部分水力性状和养分性状,对比3种EM树木和3种AM树木的水分传导和养分利用策略,结果表明EM树木具有比AM树木更强的抗旱能力, 以及更高的导水效率和光合氮磷利用效率,从而揭示了季节性干旱加剧和氮沉降增加背景下EM树木优势度增加而AM树木优势度减少的原因。虽然后期需要增加物种和性状测定来进一步验证我们的结论,但本研究为地上地下生态学相结合研究提供了新思路并做出了初步尝试。
3.1 EM树木和AM树木水力性状的差异
叶片50和88常用于量化植物叶片的水力脆弱性和抗气穴化能力,能够表征植物的耐旱性[37–38]。tlp是叶片细胞发生质壁分离时的水势,具有较低tlp的植物在干旱时能够维持气孔导度和水力导度等, 以此维持植物生长[39–40]。本研究结果表明,EM树木具有更强的抗旱能力,这与前人报道EM真菌能提高宿主植物抗旱能力的结论一致,如花旗松()、异色桉()和胡杨()等[41–43]。虽然植物的水力脆弱性与木质部结构有关,不受EM真菌的影响, 但是木质部导管细胞的形成与植物的水分状态密切相关[44]。EM真菌能够产生大量菌丝增加与土壤的接触面积并扎向深层的土壤,以充分吸收土壤中水分帮助植物在干旱情况下改善水分状态[45–46]。因此EM真菌侵染可能通过改善植物水分状态间接提高植物的抗旱能力。有研究指出,与AM植物相比,EM植物呈现出更保守的生存策略,因为EM首先出现在适宜保守策略的营养贫乏地区[47]。Reich等指出植物对于所有资源的利用,可能呈现出相同的策略[48]。抗旱是保守型植物在水分方面的重要表现,这可能是EM树木具有更强抗旱能力的原因。
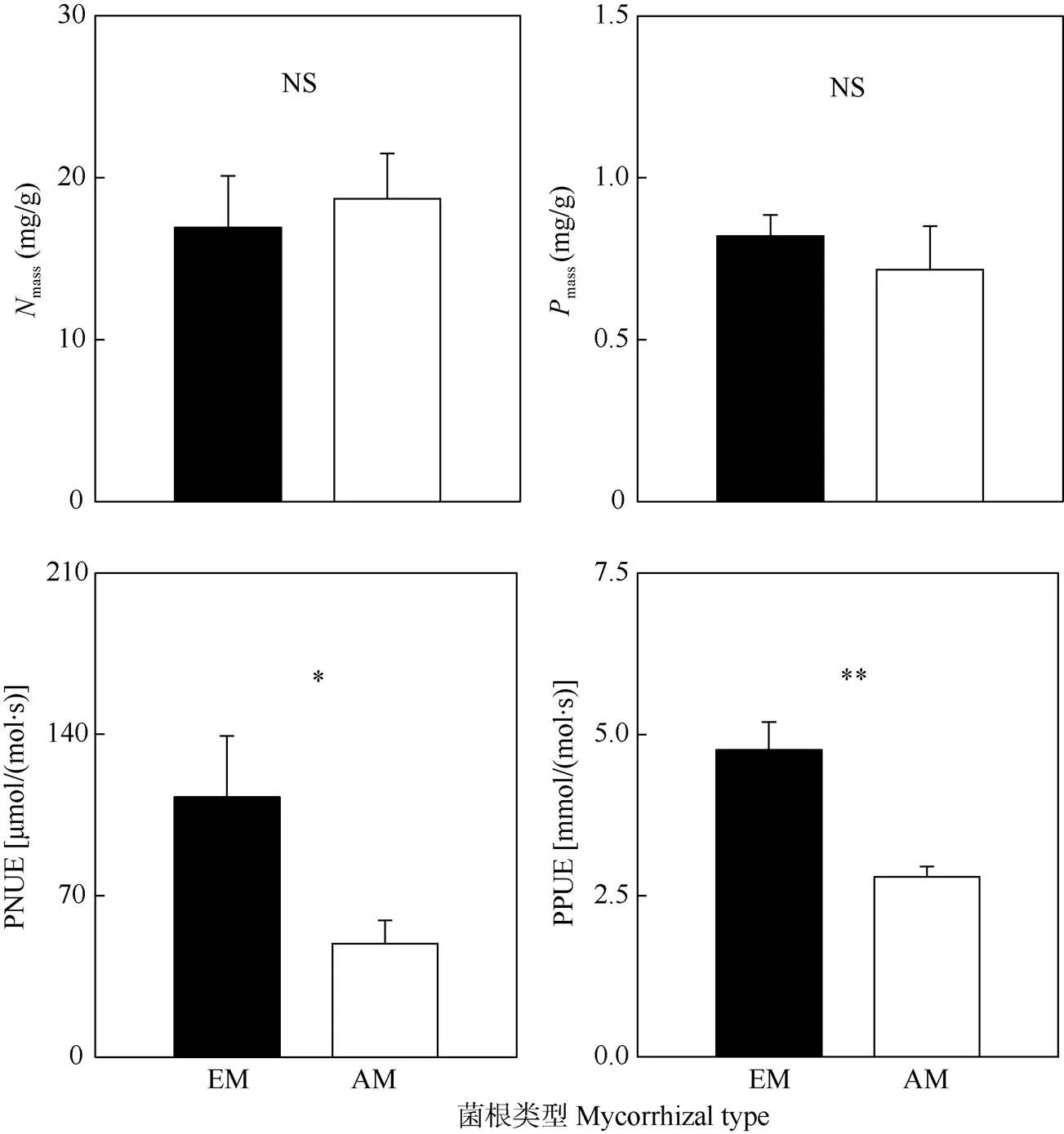
图3 EM和AM树木叶片的单位质量叶片氮含量(Nmass)、单位质量叶片磷含量(Pmass)、光合氮利用效率(PNUE)和光合磷利用效率(PPUE)。NS: P>0.05; *: P<0.05; **: P<0.01。
S和L分别表征植物边材和叶片的水分传导效率,体现植物水分传导的有效性[17]。有研究表明,EM真菌能够通过提高根系质外体运输能力增加植物的根系导水率[49],植物从土壤到叶片水分运输存在协同作用[50],这可能导致EM树木具有较高边材比导水率和叶片比导水率。
本研究结果表明,EM树木的水力传导效率和水力传导安全均显著高于AM树木,这与传统的理论“植物水力传导效率和水力传导安全之间存在权衡[51]”相违背。但最新的研究指出,植物能够同时具备更高的导水效率和抗旱能力,使植物在干旱愈发严重的环境中存活和生长[52]。南亚热带地区存在明显的干湿季,近几十年来虽然年降水量不变,但是湿季暴雨日增加,干季无雨日增多且小雨日减少,导致此地区季节性干旱加剧[1]。EM树木同时具备较高的导水率和抗旱能力,这也使得EM树木更适应季节性干旱这一环境变化因子。
3.2 EM树木和AM树木养分性状的差异
植物对营养元素的获取能力反映植物竞争自然资源的能力,也影响植物在群落中的种群维持。EM树木和AM树木的叶片氮磷含量没有差异,这可能是因为南亚热带森林氮饱和,EM树木和AM树木均能吸取足以供应自身生长的氮[53]。而Averill等对比全球EM树木和AM树木磷含量发现,在热带地区EM树木和AM树木磷含量没有差异[54],与我们的结果一致。南亚热带与热带具有相似的土壤环境(磷限制),可能使得磷元素成为各物种首要竞争的营养资源[55],因此在EM树木和AM树木间没有差异。
虽然EM树木和AM树木叶片氮磷含量没有差异,但是EM树木的光合氮磷利用效率均比AM树木高。南亚热带季风常绿阔叶林是磷限制环境,且氮沉降使得土壤淋溶作用增强,进一步加剧了磷限制[6],在这种条件下具有较高光合磷利用效率的EM树木可能在竞争中占有优势。此外,EM树木的PNUE和PPUE高于AM树木, 主要是因为EM树木的最大光合速率高于AM树木[分别是11.23和5.12mol/(m2·s)]。Li等研究表明南亚热带季风常绿阔叶林中最大光合速率大的树木在全球变化中多度增加,因为光合速率大的树木能够快速生长并形成种群优势[17],佐证了我们的结果。
本研究表明,南亚热带季风常绿阔叶林中EM树木具有比AM树木更强的抗旱能力,以及更高的导水效率和光合氮磷利用效率,意味着EM树木的水分养分策略可能更适应本地区季节性干旱加剧和氮沉降增加引起的磷限制加剧等环境变化,因而在近几十年来优势度增加,而AM树木则优势度减少。本文综合植物地上部分功能性状和地下部分菌根类型,对比分析3种EM树木和3种AM树木在季节性干旱加剧和氮沉降增加的南亚热带季风常绿阔叶林优势度变化相反的原因,为不同菌根植物如何响应全球变化提供了一定的生理解释。
[1] ZHOU G Y, WEI X H, WU Y P, et al. Quantifying the hydrological responses to climate change in an intact forested small watershed in southern China [J]. Glob Change Biol, 2011, 17(12): 3736–3746. doi: 10.1111/j.1365-2486.2011.02499.x.
[2] LU X K, VITOUSEK P M, MAO Q G, et al. Plant acclimation to long-term high nitrogen deposition in an N-rich tropical forest [J]. Proc Natl Acad Sci USA, 2018, 115(20): 5187–5192. doi: 10.1073/pnas. 1720777115.
[3] ZHOU G Y, YAN J H. The influences of regional atmospheric preci- pitation characteristics and its element inputs on the existence and development of Dinghushan forest ecosystems [J]. Acta Ecol Sin, 2001, 21(12): 2002–2012. doi: 10.3321/j.issn:1000-0933.2001.12.006.
周国逸, 闰俊华. 鼎湖山区域大气降水特征和物质元素输入对森林生态系统存在和发育的影响 [J]. 生态学报, 2001, 21(12): 2002– 2012. doi: 10.3321/j.issn:1000-0933.2001.12.006.
[4] BRODRIBB T J, HOLBROOK N M, GUTIÉRREZ M V. Hydraulic and photosynthetic co-ordination in seasonally dry tropical forest trees [J]. Plant Cell Environ, 2002, 25(11): 1435–1444. doi: 10.1046/j.1365- 3040.2002.00919.x.
[5] ZHANG S B, WEN G J, YANG D X. Drought-induced mortality is related to hydraulic vulnerability segmentation of tree species in a savanna ecosystem [J]. Forests, 2019, 10(8): 697–709. doi: 10.3390/ f10080697.
[6] HUANG W J, LIU J X, WANG Y P, et al. Increasing phosphorus limitation along three successional forests in southern China [J]. Plant Soil, 2012, 364(1/2): 181–191. doi: 10.1007/s11104-012-1355-8.
[7] ZEMUNIK G, TURNER B L, LAMBERS H, et al. Diversity of plant nutrient-acquisition strategies increases during long-term ecosystem development [J]. Nat Plants, 2015, 1(5): 15050. doi: 10.1038/nplants. 2015.50.
[8] VAN DER HEIJDEN M G A, BARDGETT R D, VAN STRAALEN N M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems [J]. Ecol Lett, 2008, 11(3): 296– 310. doi: 10.1111/j.1461-0248.2007.01139.x.
[9] WANG B, QIU Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants [J]. Mycorrhiza, 2006, 16(5): 299–363. doi: 10.1007/s00572-005-0033-6.
[10] STEIDINGER B S, CROWTHER T W, LIANG J, et al. Climatic controls of decomposition drive the global biogeography of forest-tree symbioses [J]. Nature, 2019, 569(7756): 404–408. doi: 10.1038/s41586- 019-1128-0.
[11] BRUNDRETT M C, TEDERSOO L. Evolutionary history of mycorr- hizal symbioses and global host plant diversity [J]. New Phytol, 2018, 220(4): 1108–1115. doi: 10.1111/nph.14976.
[12] ZHENG L, WU X Q. Review on the structure of plant mycorrhiza [J]. J Nanjing For Univ (Nat Sci), 2008, 32(5): 135–139. doi: 10.3969/j.issn. 1000-2006.2008.05.030.
郑玲, 吴小芹. 植物菌根共生体结构的研究进展 [J]. 南京林业大学学报(自然科学版), 2008, 32(5): 135–139. doi: 10.3969/j.issn.1000- 2006.2008.05.030.
[13] EOM A H, HARTNETT D C, WILSON G W T. Host plant species effects on arbuscular mycorrhizal fungal communities in tallgrass prairie [J]. Oecologia, 2000, 122(3): 435–444. doi: 10.1007/s00442005 0050.
[14] GERATS T, STROMMER J. Petunia [M]. 2nd ed. New York, USA: Springer, 2009: 131–156.
[15] ALLEN M F. Mycorrhizal fungi: Highways for water and nutrients in arid soils [J]. Vadose Zone J, 2007, 6(2): 291–297. doi: 10.2136/vzj 2006.0068.
[16] LI R H, ZHU S D, CHEN H Y H, et al. Are functional traits a good predictor of global change impacts on tree species abundance dynamics in a subtropical forest? [J]. Ecol Lett, 2015, 18(11): 1181–1189. doi: 10.1111/ele.12497.
[17] ZHU S D, SONG J J, LI R H, et al. Plant hydraulics and photo- synthesis of 34 woody species from different successional stages of subtropical forests [J]. Plant Cell Environ, 2013, 36(4): 879–891. doi: 10.1111/pce.12024.
[18] SANTIAGO L S, GOLDSTEIN G, MEINZER F C, et al. Leaf photo- synthetic traits scale with hydraulic conductivity and wood density in Panamanian forest canopy trees [J]. Oecologia, 2004, 140(4): 543–550. doi: 10.1007/s00442-004-1624-1.
[19] DOMEC J C, GARTNER B L. Cavitation and water storage capacity in bole xylem segments of mature and young Douglas-fir trees [J]. Trees, 2001, 15(4): 204–214. doi: 10.1007/s004680100095.
[20] URLI M, PORTÉ A J, COCHARD H, et al. Xylem embolism threshold for catastrophic hydraulic failure in angiosperm trees [J]. Tree Physiol, 2013, 33(7): 672–683. doi: 10.1093/treephys/tpt030.
[21] MARÉCHAUX I, BARTLETT M K, SACK L, et al. Drought tolerance as predicted by leaf water potential at turgor loss point varies strongly across species within an Amazonian forest [J]. Funct Ecol, 2015, 29 (10): 1268–1277. doi: 10.1111/1365-2435.12452.
[22] WRIGHT I J, REICH P B, WESTOBY M, et al. The worldwide leaf economics spectrum [J]. Nature, 2004, 428(6985): 821–827. doi: 10. 1038/nature02403.
[23] WRIGHT I J, REICH P B, CORNELISSEN J H C, et al. Assessing the generality of global leaf trait relationships [J]. New Phytol, 2005, 166 (2): 485–496. doi: 10.1111/j.1469-8137.2005.01349.x.
[24] HUANG Z L, KONG G H, WEI P. Plant species diversity dynamics in Dinghu Mountain forests [J]. Chin Biodiv, 1998, 6(2): 116–121. doi: 10.3321/j.issn:1005-0094.1998.02.006.
黄忠良, 孔国辉, 魏平. 鼎湖山植物物种多样性动态 [J]. 生物多样性, 1998, 6(2): 116–121. doi: 10.3321/j.issn:1005-0094.1998.02.006.
[25] ZOU S, ZHOU G Y, ZHANG Q M, et al. Long-term (1992–2015) dynamics of interspecific associations among tree species in a monsoon evergreen broad-leaved forest in Dinghushan Biosphere Reserve [J]. Acta Ecol Sin, 2019, 39(17): 6362–6371. doi: 10.5846/stxb2018 04030753.
邹顺, 周国逸, 张倩媚, 等. 1992–2015年鼎湖山季风常绿阔叶林群落种间关联动态 [J]. 生态学报, 2019, 39(17): 6362–6371. doi: 10. 5846/stxb201804030753.
[26] LIAN J Y, CHEN C, HUANG Z L, et al. Community composition and stand age in a subtropical forest, southern China [J]. Biodiv Sci, 2015, 23(2): 174–182. doi: 10.17520/biods.2014243.
练琚愉, 陈灿, 黄忠良, 等. 鼎湖山南亚热带常绿阔叶林不同成熟度群落特征的比较 [J]. 生物多样性, 2015, 23(2): 174–182. doi: 10. 17520/biods.2014243.
[27] GUI X J, LIAN J Y, ZHANG R Y, et al. Vertical structure and its biodiversity in a subtropical evergreen broad-leaved forest at Dinghu- shan in Guangdong Province, China [J]. Biodiv Sci, 2019, 27(6): 619– 629. doi: 10.17520/biods.2019107.
桂旭君, 练琚愉, 张入匀, 等. 鼎湖山南亚热带常绿阔叶林群落垂直结构及其物种多样性特征 [J]. 生物多样性, 2019, 27(6): 619–629. doi: 10.17520/biods.2019107.
[28] NIU J Q. An investigation on mycorrhiza from Dinghu Shan [C]// Tropical and Subtropical Forest Ecosystem, Vol. 6. Beijing: Science Press, 1990: 37–40.
牛家琪. 鼎湖山一些树种的菌根调查 [C]// 热带亚热带森林生态系统研究, 第6集. 北京: 科学出版社, 1990: 37–40.
[29] KONG D L, MA C E, ZHANG Q, et al. Leading dimensions in absorp- tive root trait variation across 96 subtropical forest species [J]. New Phytol, 2014, 203(3): 863–872. doi: 10.1111/nph.12842.
[30] GURMESA G A, LU X K, GUNDERSEN P, et al. Species differences in nitrogen acquisition in humid subtropical forest inferred from15N natural abundance and its response to tracer addition [J]. Forests, 2019, 10(11): 991. doi: 10.3390/f10110991.
[31] ZHUANG X Y, CHEN Y J. Investigation of plant mycorrhizae in secondary forests of Hong Kong [J]. Chin Biodiv, 1997, 5(4): 287–292. doi: 10.17520/biods.1997049.
庄雪影, 陈咏娟. 香港次生林下植物菌根的调查 [J]. 生物多样性, 1997, 5(4): 287–292. doi: 10.17520/biods.1997049.
[32] SPERRY J S, DONNELLY J R, TYREE M T. A method for measuring hydraulic conductivity and embolism in xylem [J]. Plant Cell Environ, 1988, 11(1): 35–40. doi: 10.1111/j.1365-3040.1988.tb01774.x.
[33] SACK L, SCOFFONI C. Measurement of leaf hydraulic conductance and stomatal conductance and their responses to irradiance and dehydration using the Evaporative Flux Method (EFM) [J]. J Vis Exp, 2012(70): e4179. doi: 10.3791/4179.
[34] DUURSMA R, CHOAT B. Fitplc: An R package to fit hydraulic vulnerability curves [J]. J Plant Hydraul, 2017, 4: e002. doi: 10.20870/ jph.2017.e002.
[35] TYREE M T, RICHTER H. Alternative methods of analysing water potential isotherms: Some cautions and clarifications: I. The impact of non-ideality and of some experimental errors [J]. J Exp Bot, 1981, 32 (128): 643–653. doi: 10.1093/jxb/32.3.643.
[36] SCHULTE P J, HINCKLEY T M. A comparison of pressure-volume curve data analysis techniques [J]. J Exp Bot, 1985, 36(171): 1590– 1602. doi: 10.1093/jxb/36.10.1590.
[37] BRODRIBB T J, COCHARD H. Hydraulic failure defines the recovery and point of death in water-stressed conifers [J]. Plant Physiol, 2009, 149(1): 575–584. doi: 10.1104/pp.108.129783.
[38] KURSAR T A, ENGELBRECHT B M J, BURKE A, et al. Tolerance to low leaf water status of tropical tree seedlings is related to drought performance and distribution [J]. Funct Ecol, 2009, 23(1): 93–102. doi: 10.1111/j.1365-2435.2008.01483.x.
[39] BARTLETT M K, SCOFFONI C, SACK L. The determinants of leaf turgor loss point and prediction of drought tolerance of species and biomes: A global meta-analysis [J]. Ecol Lett, 2012, 15(5): 393–405. doi: 10.1111/j.1461-0248.2012.01751.x.
[40] XU L, HE P C, ZHANG T, et al. Comparative studies on leaf hydraulic traits of six palm (Arecaceae) species originally distributed in different habitats [J]. J Trop Subtrop Bot, 2020, 28(5): 472–478. doi: 10.11926/ jtsb.4199.
徐龙, 贺鹏程, 张统, 等. 不同原生境的6种棕榈科植物叶片水力性状的对比研究[J]. 热带亚热带植物学报, 2020, 28(5): 472–478. doi: 10.11926/jtsb.4199.
[41] PARKE J L, LINDERMAN R G, BLACK C H. The role of ectomy- corrhizas in drought tolerance of Douglas-fir seedlings [J]. New Phytol, 1983, 95(1): 83–95. doi: 10.1111/j.1469-8137.1983.tb03471.x.
[42] BOUGHER N L, MALAJCZUK N. Effects of high soil moisture on formation of ectomycorrhizas and growth of karri () seedlings inoculated with,and[J]. New Phytol, 1990, 114(1): 87–91. doi: 10.1111/j.1469-8137.1990.tb00377.x.
[43] LUO Z B, LI K, JIANG X N, et al. Ectomycorrhizal fungus () and hydrogels affect performance ofexposed to drought stress [J]. Ann For Sci, 2009, 66: 106. doi: 10. 1051/forest:2008073.
[44] CASTAGNERI D, BATTIPAGLIA G, Von Arx G, et al. Tree-ring anatomy and carbon isotope ratio show both direct and legacy effects of climate on bimodal xylem formation in[J]. Tree Physiol, 2018, 38(8): 1098–1109. doi: 10.1093/treephys/tpy036.
[45] KILPELÄINEN J, APHALO P J, LEHTO T. Temperature affected the formation of arbuscular mycorrhizas and ectomycorrhizas inseedlings more than a mild drought [J]. Soil Biol Biochem, 2020, 146: 107798. doi: 10.1016/j.soilbio.2020.107798.
[46] LUKAC M, GRENNI P, GAMBONI M. Soil Biological Communities and Ecosystem Resilience [M]. New York, USA: Springer, 2017: 123– 142. doi: 10.1007/978-3-319-63336-7.
[47] CORNELISSEN J, AERTS R, CERABOLINI B, et al. Carbon cycling traits of plant species are linked with mycorrhizal strategy [J]. Oecologia, 2001, 129(4): 611–619. doi: 10.1007/s004420100752.
[48] REICH P B. The world-wide 'fast-slow' plant economics spectrum: A traits manifesto [J]. J Ecol, 2014, 102(2): 275–301. doi: 10.1111/1365- 2745.12211.
[49] LIU H, GLEASON S M, HAO G Y, et al. Hydraulic traits are coordi- nated with maximum plant height at the global scale [J]. Sci Adv, 2019, 5(2): eaav1332. doi: 10.1126/sciadv.aav1332.
[50] YAO G Q, NIE Z F, TURNER N C, et al. Combined high leaf hydraulic safety and efficiency provides drought tolerance inspecies adapted to low mean annual precipitation [J]. New Phytol, 2021, 229 (1): 230–244. doi: 10.1111/nph.16845.
[51] MUHSIN T M, ZWIAZEK J J. Ectomycorrhizas increase apoplastic water transport and root hydraulic conductivity inseedlings [J]. New Phytol, 2002, 153(1): 153–158. doi: 10.1046/j. 0028-646X.2001.00297.x.
[52] BUCCI S J, SCHOLZ F G, CAMPANELLO P I, et al. Hydraulic differences along the water transport system of South Americanspecies: Do leaves protect the stem functionality [J]. Tree Physiol, 2012, 32(7): 880–893. doi: 10.1093/treephys/tps054.
[53] FAN Y X, LIN F, YANG L M, et al. Decreased soil organic P fraction associated with ectomycorrhizal fungal activity to meet increased P demand under N application in a subtropical forest ecosystem [J]. Biol Fertil Soils, 2018, 54(1): 149–161. doi: 10.1007/s00374-017-1251-8.
[54] AVERILL C, BHATNAGAR J M, DIETZE M C, et al. Global imprint of mycorrhizal fungi on whole-plant nutrient economics [J]. Proc Natl Acad Sci USA, 2019, 116(46): 23163–23168. doi: 10.1073/pnas.1906655116.
[55] VITOUSEK P M. Litterfall, nutrient cycling, and nutrient limitation in tropical forests [J]. Ecology, 1984, 65(1): 285–298. doi: 10.2307/1939 481.
Comparison Studies on Water Transport and Nutrient Acquisition of Trees with Different Mycorrhiza Types in Subtropical Forest
ZHAO Min1,2,3, LIAN Juyu1,2, LIU Xiaorong1,2, LIU Hui1,2, YE Qing1,2*
(1. Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystems, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 2 Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China; 3University of Chinese Academy of Sciences,Beijing 100049, China)
To reveal the mechanisms of changing trend of mycorrhizal tree dominance under the environmental influence of increasing seasonal drought and nitrogen deposition in the lower subtropical monsoon evergreen broad-leaved forest, the hydraulic traits and nutrient traits of three ectomycorrhizal (EM), including,and, and three arbuscular mycorrhizal (AM) dominant trees, including,andvar., were measured. The results showed that the leaf water potential at which 50% and 88% hydraulic conductance are lost (50and88) and leaf turgor loss point (tlp) of EM trees were lower than those of AM trees, while thesapwood specific hydraulic conductivity (S), leaf specific hydraulic conductivity (L), photosynthetic nitrogen use efficiency (PNUE) and photosynthetic phosphorus use efficiency (PPUE) of EM trees were higher than those of AM trees. The results suggested that EM trees have stronger drought resistance ability and higher water and nutrient use efficiency compared with AM trees. This might be the physiological mechanism of increasing dominance of EM trees while decreasing dominance of AM trees under the background of increasing drought and nitrogen deposition.
Ectomycorrhizal tree; Arbuscular mycorrhzial tree; Hydraulic trait; Nutrient trait; Lower subtropical forest
10.11926/jtsb.4385
2020-01-20
2021-03-06
南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0408)资助
This work was supported by the Key Special Project for Introduced Talents Team of Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou) (Grant No. GML2019ZD0408).
赵敏,女,硕士研究生,从事植物生理生态研究。E-mail: zhaomin1223@163.com
通信作者 Corresponding author. E-mail: qye@scbg.ac.cn

