基于网络药理学分析青蒿素治疗炎症性肠病的靶点及机制
雷玉婷 ,杨艳红,雷自立
[1.广东药科大学中医药研究院,广东广州 510006;2.广东药科大学附属第一医院(临床医学院),广东广州510080]
炎症性肠病(inflammatory bowel disease,IBD)是一种病因不明的慢性胃肠道炎症性疾病,主要分为克罗恩病(inflammatory bowel disease,CD)和溃疡性结肠炎(inflammatory bowel disease,UC)2类[1]。近年来,随着现代人的饮食和生活习惯的改变,IBD的发病率和患病率迅速增加,由IBD 引起的医疗费用也给社会和经济发展带来了巨大负担[1-3]。用于治疗IBD 的传统药物包括磺胺嘧啶、5-氨基水杨酸制剂、糖皮质激素和免疫抑制剂等[1]。抗肿瘤坏死因子(TNF)单克隆抗体和抗整合素,以及新开发的白介素(IL)-12 和IL-23 的抗p40 亚基也已被批准用于治疗IBD[4-6]。这些药物可以控制炎症并促进肠黏膜的愈合,但具有一些副作用,例如肝肾毒性,并且仍无法长期缓解[1,6]。天然化合物具有多种生物和医学活性,其有效性、高安全性、低毒性和可利用性吸引了越来越多的关注[7]。
青蒿素(artemisinin,分子式为C15H22O5)是一种倍半萜内酯分子,含过氧基团,有研究表明青蒿素及其衍生物在治疗IBD 及结肠癌等方面有积极作用[8-9]。本实验室前期工作研究表明,双氢青蒿素(dihydroartemisinin,DHA)可明显减轻葡聚糖硫酸钠盐(dextran sulfate sodium salt,DSS)诱导的IBD小鼠模型腹泻和便血情况,显著降低IBD 小鼠血清TNF-α、IL-1β和IL-23 水平,下调TNF-α、IL1β和IL-6在小鼠肠道的表达水平。此外,DHA 可改善IBD 小鼠肠道炎症细胞的浸润,上调小鼠结肠EpCAM、Claudin-1、Claudin-2、Claudin-3、Claudin-4、Claudin-7的表达水平,通过修复肠道紧密连接以及调控肠道菌群改善IBD[10]。
传统中药具有多成分、多靶点的作用特点,研究其治病机制比较困难[11]。IBD 患者呈现出多种多样的病理特征,有各种先天性和适应性免疫效应子参与,这种异质性导致各种动物模型上的研究还是有缺陷的[12]。因此,应用人类生物数据库进行研究很有必要。网络药理学是基于系统生物学,通过生物网络分析技术,查找相关数据库、利用多种信息化分析工具和方法来构建各种生物、基因之间的关系网络图,借此系统地阐述“基因-靶点-疾病-药物”之间复杂关系的一门新兴网络交叉学科[13]。本研究使用该方法,预测青蒿素对IBD 治疗的活性成分、潜在作用靶点及作用机制,旨在为青蒿素在IBD 的潜在临床应用和深入研究提供新的思路。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 葡聚糖硫酸钠(大连美仑生物技术有限公司);羧甲基纤维素钠(天津致远化学试剂有限公司);双氢青蒿素(上海阿拉丁生化科技股份有限公司);Trizol(Invitrogen 公司);反转录试剂盒(日本Takara 公司);引物(上海生工生物工程股份有限公司);PikoReal 96型Real-time PCR仪(美国Thermo Fisher公司)。
1.1.2 实验动物 7周龄雌性SPF级C57BL/6小鼠购自湖南斯莱克景达实验动物有限公司,体质量20~23 g,实验动物合格证号43004700064578,在广东药科大学动物中心饲养,室温25 ℃,12 h/12 h昼夜间断光照。
1.2 方法
1.2.1 青蒿素靶点收集 以“artemisinin(青蒿素)”为关键词在中药系统药理学数据库与分析平台数据库(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)收集数据,并按一定条件筛选青蒿成分,同时搜索Pubchem等其他数据库作为补充,将获得的Canonical SMILES 导 入Swiss Target Prediction(http://www.swisstargetprediction.ch/)、Drugbank 数据库(https://www.Drugbank.ca/)、PharmMapper(http://lilab.ecust.edu.cn/phanmmapper/index.php),获得青蒿素靶点[13]。
1.2.2 IBD 的靶点信息收集 通过查找TTD 数据库(http://db.idrblab.net/ttd/)、Dru-gbank数据库(https://www.Drugbank.ca/)、DisGeNET 数据库(http://www.disgenet.org/web/DisGeNET/menu/home)中与IBD相关的靶点基因,将收集到的有关靶点基因信息全部导入Uniprot 数据库(http://www.Uniprot.org/),并对多个疾病数据库收集到的结果进行整合[14]。
1.2.3 青蒿素与IBD 共同靶点收集 将收集到的青蒿素靶点和IBD 靶点制作成韦恩图,两图交集区域即为共同靶点,是青蒿素对IBD的作用靶点。
1.2.4 构建蛋白相互作用网络 运用STRING 数据库将筛选出的直接作用靶点进行蛋白相互作用,获得蛋白相互作用网络,导出相关文件并分析,筛选出关键靶点。
1.2.5 生物学功能和通路分析 将青蒿素与IBD 共同靶点导入ClueGO 和DAVID 6.8 数据库(https://david.Ncifcrf.gov/),物种选择人类(Homo sapiens,Human),进行GO(Gene Ontology)分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)分析。利用ImageGP 工具(http://www.ehbio.com/ImageGP/)绘制青蒿素和IBD 共同靶点的前20 条生物学过程分析气泡图、细胞组分气泡图、分子功能气泡图以及KEGG通路气泡图[15]。
1.2.6 炎症性肠病小鼠模型的建立 将7 周龄的C57BL/6 雄性小鼠放置于SPF 级动物实验室喂养,并随机分为3 组:对照组、DSS 组和DHA 组。其中DSS 组和DHA 组小鼠自由饮用4%(质量浓度,下同)的DSS 水,对照组自由引用纯净水。第7 天时,DSS 组和DHA 组小鼠停止饮用4%的DSS 水,改为饮用与对照组一样的纯净水。第12天时,DSS 组和DHA 组继续自由饮用2%浓度的DSS 水,对照组继续自由饮用纯净水,同时对照组和DSS组用0.5%羧甲基纤维素钠每日灌胃1 次,DHA 组则用混悬于羧甲基纤维素钠的0.5%双氢青蒿素每日灌胃1 次,剂量为150 mg/kg。第18 天麻醉处死小鼠,取出结肠等组织进行后续实验。
1.2.7 组织RNA 提取和Real-time PCR 使用TRIzol®reagent 试剂盒提取小鼠结肠组织的总RNA,并使用PrimeScriptTM RT Reagent kit 试剂盒去除基因组DNA 和逆转录。E-cardherin 引物序列为:E-cardherin-F,GGTCTCTTGTCCCTTCCACA;E-cardherin-R,CCTGACCCACACCAAAGTCT。使用PikoReal PCR 系统进行Real-time PCR,反应条件为:95 ℃预变性30 s,95 ℃5 s,60 ℃20 s,65 ℃15 s,40个循环,GAPDH作为内参基因。
1.2.8 16S rDNA 基因分析及数据处理 粪便细菌DNA提取和16S rDNA基因测序分析由广州基迪奥生物科技有限公司完成。从样本中提取基因组DNA 后,用特异引物扩增16S rDNA 的V3+V4 区,引物序列为:341F,CCTACGGGNGGCWGCAG;806R,GGACTACHVGGGTATCTAAT。将纯化回收后的扩增产物连接测序接头,构建测序文库,上机测序。利用quantitative insights into microbial ecology(QIIME,version1.9.1)进行数据分析,将得到的Raw reads 进行过滤,得到Clean Tag,接下来对Clean Tag 进行聚类,得到的数据为Effective Tag。将这些基因序列用Uparse(version 9.2.64_i86linux32)进行比对,得到OUT(operational taxonomic units),随后使用Ribosomal database project classifier(version 2.2)对这些数据进行物种组成分析。使用Ace 和chao的方法计算细菌的丰度,使用Shannon和Simpson的方法计算细菌的多样性,使用KEGG 对菌群进行功能富集分析。
1.2.9 统计学方法 采用软件IBM SPSS Statistics 24.0 和graphpad Prism 7 进行统计分析,3 组样本采用单因素ANOVA 方法,以P<0.05 为差异具有统计学意义。
2 结果
2.1 青蒿素靶点的筛选
在Pubchem 数据库中获得青蒿素的Canonical SMILES:CC1CCC2C(C(=O)OC3C24C1CCC(O3)(OO4)C)C,用得到的Canonical SMILES 在Swiss Target Prediction、Drugbank 数据库、Pharm Mapper等多个数据库中搜索获得青蒿素相关靶点,其中Swiss Target Prediction数据库252个、Drugbank数据库3个、Pharm Mapper数据库100个,导入Uniprot数据库进行基因标准化、去掉重复值,最终得到341个青蒿素靶点。其中包括细胞色素氧化酶(cytochrome oxidase,CYP1A2)、脂肪酰胺水解酶(fatty acid amide hydrolase,FAAH)、Toll 样受体9(toll-like receptor 9,TLR9)、丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)、非受体型蛋白酪氨酸磷酸酶1(recombinant protein tyrosine phosphatase,PTPN1)、毒蕈碱型胆碱受体(M1 recombinant cholinergic receptor,Muscarinic 1,CHRM1)等。
2.2 IBD靶点信息收集和筛选
以“inflammation bowel disease”为关键词,选择homo spanies 作为物种,在疾病相关数据库中搜索IBD 的靶点基因,其中TTD 数据库57 个、isGeNET数据库1 577个、Drugbank数据库11个,将靶点基因导入Uniprot数据库进行基因标准化后归纳整理,合并去掉重复基因,共得到1 629 个疾病基因,包括肿瘤坏死因子(TNF)、白介素10(IL-10)、白介素23(IL-23)、HPS1 溶酶体细胞器复合物3(HPS1 biogenesis of lysosomal organelles complex 3 subunit 1)、白介素6(IL-6)、Toll 样受体9(toll-like receptor 9,TLR9)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM1)、趋化因子2(chemokine 2,CCL2)等。
2.3 青蒿素治疗IBD的靶点收集
将青蒿素靶点和IBD 靶点取交集绘制成韦恩图(见图1),得到青蒿素和IBD的共同靶点有84个。将共同靶点导入STRING 数据库,构建共同靶点间相互作用关系,其中置信度得分排名前20的蛋白相互作用见表1,以JAK2、AKT、ⅩIAP、MAPK、EFGR及STAT1 等蛋白相互作用置信度得分较高,这些基因主要集中在几条重要的信号通路上,涉及肠道炎症反应、细胞的生长、增殖和分化、细胞之间信号传导及转录激活等方面,说明了这些靶点在青蒿素治疗IBD过程中起主导作用。
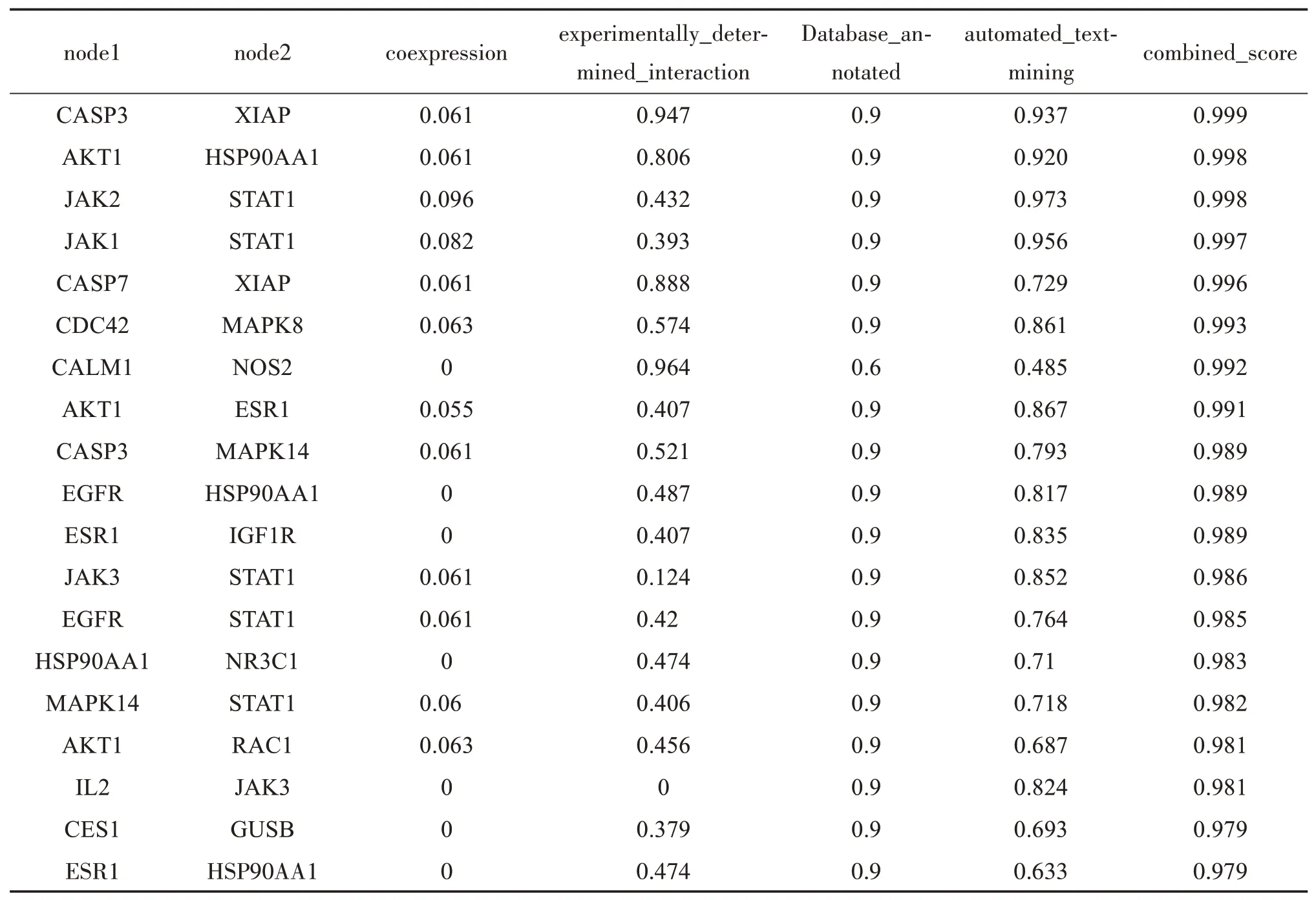
表1 置信度得分排名前20的青蒿素和IBD共同靶点蛋白相互作用关系Table 1 Common target protein interaction between artemisinin and IBD with top 20 confidence score

图1 青蒿素IBD交集靶点Venn图Figure 1 Venn diagram of artemisinin and IBD
2.4 生物学功能和通路分析
2.4.1 GO 分析 将青蒿素和IBD 的84 个共同靶点导入ClueGO 分析,物种选择Homo sapiens(Human),获得富集网络分析结果,其中GO-terms 为94个,GO-terms关系115条,总体统计之后做饼状图分析,见图2。可见大部分GO-terms富集在调节分泌、平滑肌细胞增殖、细胞因子的产生与免疫反应等过程中。将青蒿素和IBD 的84 个共同靶点导入DAVID 6.8 数据库,物种选择Homo sapiens(Human),GO 分析共获得288 条富集结果,其中189 个生物学过程分析、31个细胞组分、68个分子功能,主要涉及到细胞连接、信号传导、凋亡过程的负调控、先天免疫反应、MAPK 级联、嗜酸性粒细胞趋化性、革兰阴性菌的防御反应、寄主共生体生长的负调控、单核巨噬细胞趋化性、氧气输送及免疫应答等方面。

图2 青蒿素与IBD靶点的富集网络饼状图Figure 2 Pie chart of enrichment network of the targets of artemisinin and IBD
2.4.2 KEGG 分析 将青蒿素和IBD 的84 个共同靶点导入DAVID 6.8 数据库,物种选择Homo sapiens(Human),得到72 条KEGG 通路,其中有多条通路与青蒿素治疗IBD 紧密相关,其中包括一些与细胞黏附连接有关的信号通路,如黏着斑(focal adhesion)信号通路和黏附连接(adherens junction)信号通路等,还包括大量与炎症反应密切相关的信号通路,如趋化因子信号通路(chemokine signaling pathway)、T细胞受体信号通路(T cell receptor signaling pathway)和NOD 样受体信号通路(NOD-like receptor signaling pathway)、癌症通路(proteoglycans in cancer、pathways in cancer)、Rap1 信号通路(rap1 signaling pathway)、结肠癌(colorectal cancer)、幽门螺杆菌感染中的上皮细胞信号传导(epithelial cell signaling in helicobacter pylori infection)、TNF 信号通路(TNF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)等,见表2。利用imageGP 工具绘制青蒿素IBD 信号通路气泡图,见图3。最后将共同靶点导入Cytoscape中绘制“药物-疾病-靶点-通路图”,见图4。

图3 青蒿素治疗IBD的KEGG通路气泡图Figure 3 Bubble diagram of KEGG pathway in IBD of artemisinin treatment
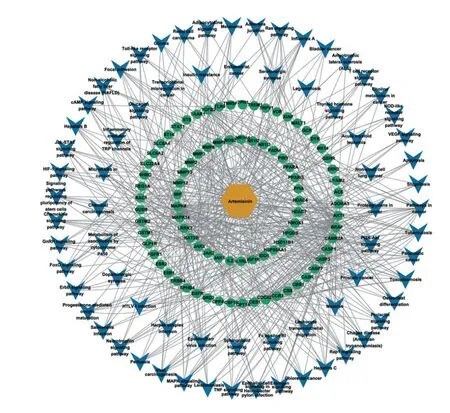
图4 青蒿素与IBD的药物—疾病—靶点—通路网络互作图Figure 4 Interaction network of drug-disease-target-pathway of artemisinin and IBD
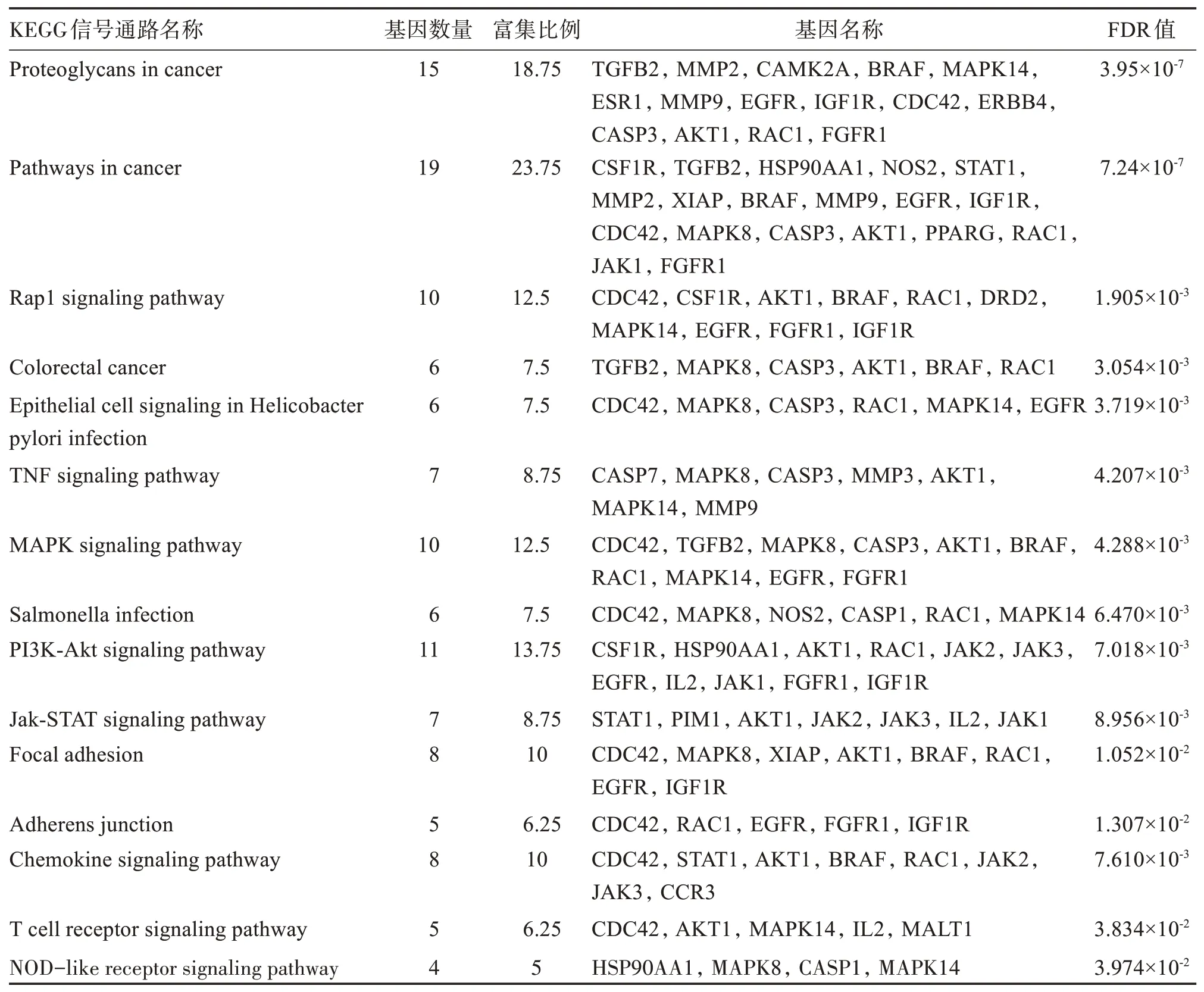
表2 青蒿素和IBD的共同靶点富集的重要KECG信号通路Table 2 Important KECG signaling pathways enriched by common targets of artemisinin and IBD
2.5 相关实验验证及分析
以上部分相关信号通路已经在本课题组前期的研究中得到了实验数据支持[9]。实验结果表明,与对照组相比,DSS 诱导的炎症性肠病小鼠肠道组织中黏附连接因子E-cardherin 表达水平显著降低,用青蒿素衍生物双氢青蒿素(DHA)处理后,结肠上黏附连接因子E-cardherin有恢复上调的趋势,见图5。肠道菌群测序结果显示Bacteroidales_S24-7_group 在所有菌群丰度中占很大的比重,同时在门水平上,与对照组小鼠相比,DSS 组的Bacteroidales_S24-7_group丰度显著降低,而给予DHA处理后,丰度明显升高,见图6。图7 为3 组小鼠肠道菌群功能丰度热图。
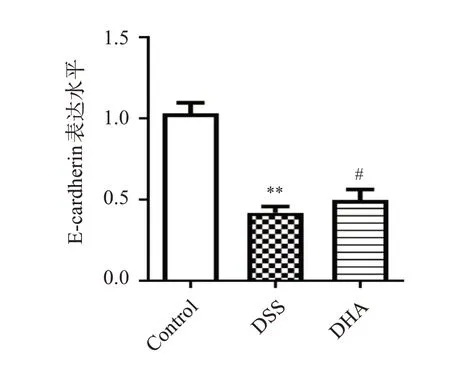
图5 E-cardherin在炎症性肠病小鼠结肠组织中的表达水平Figure 5 Expression of E-cardherin in the colon of mice with inflammatory bowel disease
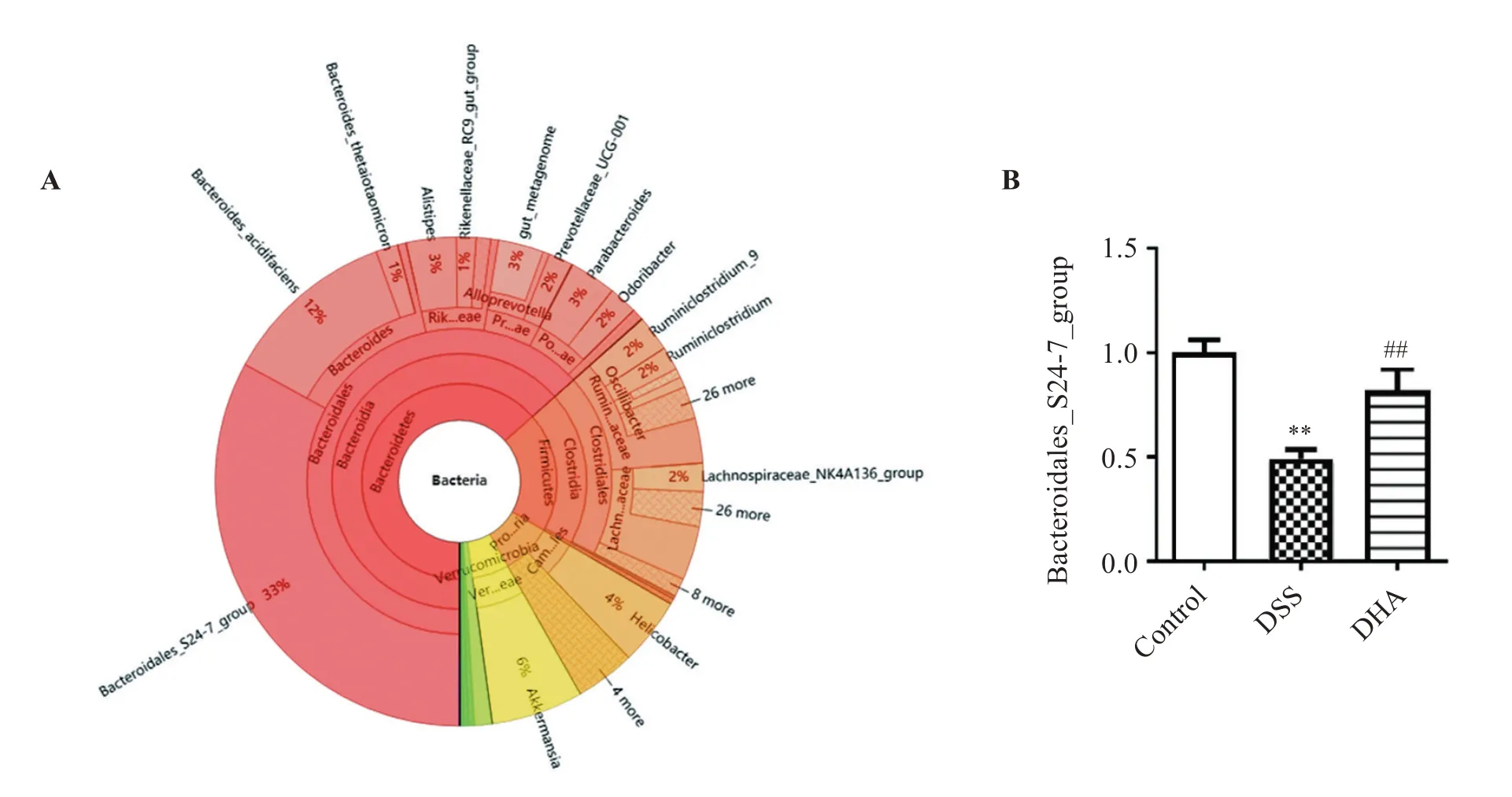
图6 肠道菌群丰度分析Figure 6 Analysis of intestinal flora abundance
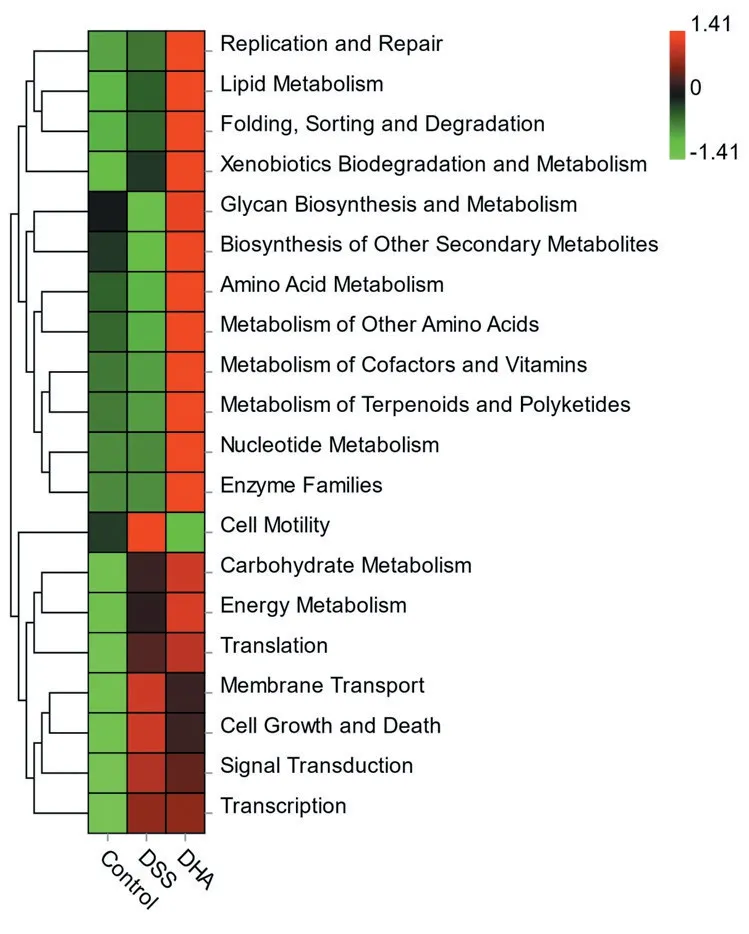
图7 炎症性肠病小鼠肠道菌群功能丰度热图Figure 7 Thermogram of functional abundance of the gut microbiota of the IBD mice
3 讨论
本次研究中共收集获得IBD 靶点1 629 个,青蒿素有效成分靶点341 个。其中,包含了84 个共同靶点,在这之中相互作用置信度得分比较高的靶点包括非受体型酪氨酸蛋白激酶家族(Janus kinase family,JAK family)、信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、AKT 丝氨酸/苏氨酸激酶1(AKT Serine/Threonine Kinase 1,AKT1)和丝裂原激活的蛋白激酶14(mitogen-activated protein kinase 14,MAPK14)等。对青蒿素治疗IBD 的共同靶点进行GO 富集分析后,结果提示青蒿素可以通过调控多种生物学过程和分子功能来干涉和改善肠道炎症,主要集中在positive regulation of secretion(分泌的正向调节)、regulation of smooth muscle cell proliferation(平滑肌细胞增殖的调节)、cytokine production involved in immune response(免疫反应中的细胞因子产生)等GO过程。这些GO过程提示了青蒿素不仅能调节免疫细胞因子的产生、改善肠道炎症,还可能从正向调节分泌和增殖肠道平滑肌2个方向修复肠道屏障。在本课题组前期的研究中确实发现了双氢青蒿素对肠道炎症的改善作用和对肠上皮连接细胞紧密连接蛋白的上调作用[10],但目前还没有实验研究结果可以完全阐述其中的作用机制,还需要进一步的探索。同时KEGG 分析结果可看出青蒿素在抗菌和预防结肠癌症相关通路上也起到积极作用,如一些基因富集在Colorectal cancer(结肠癌)、Epithelial cell signaling inHelicobacter pyloriinfection(幽门螺杆菌感染中的上皮细胞信号传导)等相关通路上。另外因炎症因子生成和清除之间出现失衡而引发的机体损伤的积累效应可显著影响到肝脏、脾脏、骨骼肌等组织器官,这些常见的生物过程均在本研究中得到了富集,初步证实了青蒿素可通过调节多种分子、代谢过程分子功能来促进机体改善IBD症状并预防结肠癌的发生。
本研究对P≤0.01 的信号通路进行筛选,获得多条主要信号通路,其中与青蒿素治疗IBD 紧密相关的通路主要集中在focal adhesion(黏着斑连接)和adherens junction(黏着连接)、chemokine signaling pathway(趋化因子信号通路)、T cell receptor signaling pathway(T 细胞信号通路)和NOD-like receptor signaling pathway(NOD 样受体信号通路)等。肠上皮屏障功能受损一直都被认为是炎症性肠病(IBD)的病理机制之一,肠屏障可以保护肠细胞免受病原微生物的侵害,肠屏障的损伤会改变肠道微生物群的组成、肠道的免疫系统和代谢,进而导致炎症性肠病甚至肠道癌症的发生。肠上皮屏障由各种细胞连接组成,其中黏着斑连接和黏附连接也是这些细胞连接的重要组成部分,它们对肠上皮细胞之间的连接起着关键作用。从本文的分析结果来看,青蒿素治疗IBD 的靶点在这2个重要的细胞连接通路上的富集也证明了青蒿素在修复细胞连接上有很好的效果,前期的动物实验研究也证明了DHA在对炎症性肠病小鼠的肠道上皮紧密连接方面有很显著的修复作用[9],但目前对于青蒿素修复上皮细胞连接的研究还很少,其具体的作用机制还需进一步探索。
本研究中得到的一些重要的信号通路已经在本课题组前期研究中得到了实验验证,例如DSS诱导的炎症性肠病小鼠肠道组织中黏附连接因子E-cardherin 表达水平显著降低,用DHA 处理后E-cardherin 有恢复上调的趋势,另外前期工作表明还有一些紧密连接因子,例如EpCAM、Claudin-2、Claudin-3、Claudin-7 的表达也得到了明显的恢复[10]。同时,炎症性肠病小鼠肠道菌群中拟杆菌科Bacteroidales_S24-7_group 的丰度显著降低,据相关文献报道,拟杆菌科Bacteroidales_S24-7_group的丰度与发生炎症的程度成反比[15]。在门水平上,与对照组小鼠相比,DSS 组的Bacteroidales_S24-7_group丰度显著降低,而给予DHA 处理后,Bacteroidales_S24-7_group 丰度明显升高。也就是说,DHA 能显著改善IBD 小鼠的菌群失调,增加有益菌的丰度,发挥治疗作用。这些菌群的功能分析显示DHA组菌群在cell motility 通路上显著富集,可见DHA在恢复肠上皮细胞连接的同时激活了细胞的运动能力,这与用网络药理学预测的DHA影响黏着斑信号通路的预测一致。黏着斑信号在细胞运动上起着很重要的作用,一般在炎症溃疡伤口愈合期间,细胞的黏着斑信号及黏附连接极大地影响了细胞的迁移活动,促进了伤口的愈合[16],菌群功能分析可看出DHA 对细胞连接的改善也体现在了细胞的迁移能力上。
通过网络药理学的分析,本研究发现青蒿素不仅在多个靶点和多种信号通路发挥抗炎的作用,并且能够恢复肠上皮细胞连接蛋白的水平,作用于多个通路靶点修复肠道屏障,这些特点都预示着青蒿素在治疗炎症性肠病的过程中可能会有意想不到的疗效。因此,利用网络药理学分析平台预测青蒿素靶点及IBD靶点对青蒿素治疗IBD机制的研究具有重要意义,为今后的实验研究指明方向,并对青蒿素治疗IBD的研究具有指导意义。
——青蒿素

