CuO/TiO2复合光催化剂的制备及其光催化性能
孙 权,徐兴亮,马勤清,李雅芙,齐皓琰
(天津长芦海晶集团有限公司,天津 300457)
1 前言
自1972年,日本科学家Fujishima和Honda[1]发现TiO2作为电极紫外光照射下分解水可以产生氢气,利用半导体光催化分解水制氢得到迅速的发展[2-4]。近10 a来,科学家相继发现一些含有Ti、Nb、Ta、Ga的氧化物和氮氧化物表现出良好的光催化产氢性能,现今已经发现130多种半导体材料。在众多已经报道的半导体光催化制氢材料中,TiO2因带隙位置匹配、价廉、无毒、性能稳定等特点成为目前光催化领域的热点研究材料[5-9]。然而,因TiO2的带隙较宽,其中锐钛矿带隙宽度Eg=3.2 eV,只能响应波长λ<387 nm的光,对于可见光区光催化不产氢,严重影响了其实际应用与市场推广。目前,很多新方法、新工艺已用于提高其量子效率和拓展其光响应范围。改性的方法有染料敏化[10]、半导体复合[11]、贵金属沉积[12]、金属离子掺杂[13]和非金属离子掺杂[14]等。
当前许多研究者对于p-n型纳米异质结复合半导体进行了较多研究。TiO2是n型半导体,通过p型半导体复合改善催化剂的电子能带结构,进而提高了催化剂的物化性能[15]。CuO属于p型半导体且禁带宽度窄(Eg=1.7 eV)。当前对于CuO/TiO2纳米异质结复合半导体的研究取得了一定的进展。Xu等[16]釆用浸渍法将TiO2粉末浸渍于Cu(NO3)2·6H2O的水溶液中制备了CuO/TiO2催化剂,研究表明低浓度CuO负载量高度分散于CuO/TiO2表面。Xu等[17]采用水热—吸附煅烧法制备具有高BET比表面积CuO-TNT催化剂,以Cu(NO3)2·3H2O为前躯体,水热反应制备了TNT,两者釆用浸渍—煅烧法制得了CuO/TiO2纳米管,该催化剂具有高效产氢速率。
目前对半导体光催化的研究局限于光催化剂的制备以及性能测试,光催化制氢的反应机理研究较少,文章采用了浸渍、热分解法制备了CuO/TiO2复合光催化剂,并进行了光催化性能测试,对CuO/TiO2复合半导体光催化分解水反应机理进行了探索。
2 实验方法
2.1 CuO/TiO2复合光催化剂的制备
称取4.0 g TiO2(P25,北京凤礼精求商贸有限责任公司),加入100 mL蒸馏水稀释,在烧杯中充分搅拌待固体完全溶解后,加入一定量的三水硝酸铜(Cu(NO3)2·3H2O,博欧特(天津)化工贸易有限公司)于悬浮液中,在不断搅拌下恒温蒸发多余水分至近干,然后在80 ℃烘箱中干燥6 h。取出研细,放入马弗炉中500 ℃焙烧4 h,取出冷却至室温,研细后得到不同CuO负载量的催化剂。控制操作条件:m(CuO) ∶m(TiO2)=0 ∶1、0.003 ∶1、0.006 ∶1、0.01 ∶1、0.02 ∶1、0.05 ∶1及0.10 ∶1(简记为CPz,z表示CuO占TiO2的质量分数,C表示CuO,P表示P25)。
2.2 光催化性能测试
光源为300 W的氙灯光源(CEL-HXF300,北京中教金源科技有限公司)模拟太阳光。光催化产氢实验采用CEL-SPH2N型光催化活性评价系统进行。向反应器中加入0.08 g光催化剂和100 mL含1.8 mol/L-1乙二醇水溶液,磁力搅拌下使催化剂保持悬浮,保持反应器外循环冷却水6 ℃,安装完反应器后打开真空泵抽真空,打开氙灯开始反应。反应气相产物氢气用气相色谱仪(GC-2060,滕州鲁南分析仪器有限公司)分析,检测器为TCD,载气为高纯氮,分离柱选择5A分子筛柱(不锈钢填充柱,3 mm×3 m)。
3 结果与讨论
3.1 物相分析
图1为CuO/TiO2光催化剂的XRD图谱,图中A、R分别代表锐钛矿和金红石,C代表CuO。图中衍射角25.2 °、37.8 °、48.0 °、53.9 °、55.1 °、62.8 °所对应峰强分别属于锐钛矿的(101)、(004)、(200)、(105)、(211)、(204)晶面[18];衍射角27.5 °、36.1 °、41.3 °所对应的峰强分别属于金红石的(110)、(101)、(111)晶面[9]。CuO的负载量较低时,对TiO2的晶相组成和结晶度无明显影响。随着CuO含量的增加,CuO的衍射峰逐渐增强,表明其相应晶粒越来越完整,同时锐钛矿的峰强逐渐增大、半峰宽逐渐变宽,这表明了TiO2晶粒尺寸逐渐变大、结晶程度逐渐减弱。CuO负载量为10%的样品CP10衍射角在35.52°、38.73°处出现明显的CuO的特征峰[19]。采用浸渍、热分解法成功制备了CuO/TiO2复合光催化剂。

图1 TiO2(P25)和CuO/TiO2的XRD图谱Fig.1 XRD patterns of TiO2(P25) and CuO/TiO2
3.2 形貌分析
图2为CuO/TiO2光催化剂的SEM图谱,样品的形貌呈球状。图2-a为P25团聚较明显,采用Scherrer公式D=Kλ/βcosθ计算出P25晶粒的尺寸约18 nm,负载CuO后的样品晶粒的尺寸约20 nm,较P25逐渐变大,这与3.1物相分析结果一致。其中图2-d为负载CuO的量为1%的催化剂,图2-h是其局部放大图,从图中看出晶粒尺寸约20 nm,这与采用XRD计算出粒径结果一致。

(a)0%;(b)0.3%;(c)0.6%;(d)1.0%;(e)2.0%;(f)5.0%;(g)10%;(h)1.0%图2 不同氧化铜负载量的样品的SEM图Fig.2 SEM images of the samples synthesized at different CuO loading
采用透射电子显微镜表征了CuO/TiO2光催化剂如图3-A、图3-B。
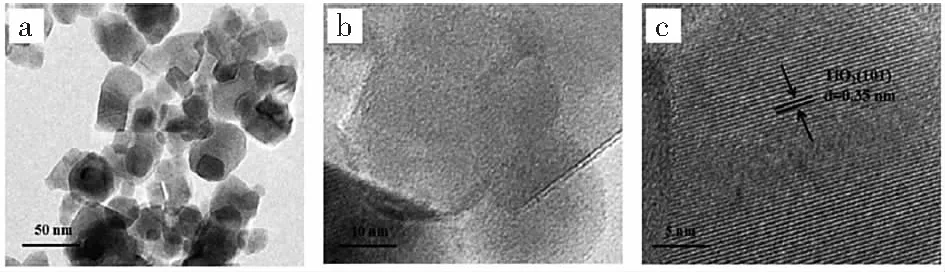
图3-A CuO/TiO2(CP1.0)的TEM图Fig.3-A TEM micrographs of the sample CuO/TiO2(CP1.0)

图3-B CuO/TiO2(CP10)的TEM图和SAED图Fig.3-B TEM micrographs of the sample CuO/TiO2(CP10)
图3-A为样品CP1.0的TEM图,图3-A中(a,b)分别为低倍率和高倍率的图,可以看出催化剂形貌为高度分散的球状晶粒,晶粒尺寸约20 nm。图中未发现负载于TiO2上的CuO晶粒,这是由于CuO负载量较低,XRD图中CuO的衍射峰较微弱证明了这一点。图3-B为CuO的负载量为10%的样品CP10的TEM图,在高倍率下如图3-B(b)箭头所示,可以明显的观察到TiO2表面上附着分散的CuO粒子,图3-B(c)中,0.35 nm的晶面间距对应于TiO2的(101)晶面[20]。
3.3 拉曼分析
图4为CuO/TiO2光催化剂的Raman谱图,图中样品P25和CP1.0的拉曼峰位置基本一致,拉曼位移在143 cm-1、197 cm-1、396 cm-1、515 cm-1和637 cm-1附近的谱峰分别对应锐钛矿相TiO2的Eg、Eg、B1g、A1g和Eg拉曼活性震动模式[21]。图中样品CP 2.0在396 cm-1、515 cm-1、637 cm-1处谱峰位置略有偏移,向低波数移动发生了红移现象,这与复合半导体CuO/TiO2禁带宽度减少有关。样品CP5.0随着CuO负载量的增加TiO2的峰强在减弱,同时在143 cm-1、197 cm-1、396 cm-1处谱峰向高波数移动,发生了蓝移现象,这可能是由于CuO和TiO2之前存在应力,原子间的键力以及距离的变化导致电子云的迁移造成的。而样品CP 5.0在515 cm-1和637 cm-1附近的拉曼峰相比CP2.0进一步向低波数移动,发生了明显的红移现象并且谱峰的半高宽在增大,而声子限域效应会引起谱峰的宽化和向低波数移动[22]。CP10纳米颗粒由于CuO的离子键增强TiO2的峰强进一步降低,在143 cm-1、197 cm-1、396 cm-1处谱峰进一步向高波段移动。而515 cm-1和637 cm-1附近的拉曼峰已经消失,同时在266 cm-1和615 cm-1处出现了两个宽化的Raman散射峰,归属于CuO的2个Bg活性模[23]。这是由于对于纳米级的CuO晶格束缚作用变弱,光子散射不能被有效地限制在布里渊区(Brillouin zone),结果导致拉曼散射峰出现宽化和向低波数移动[24]。
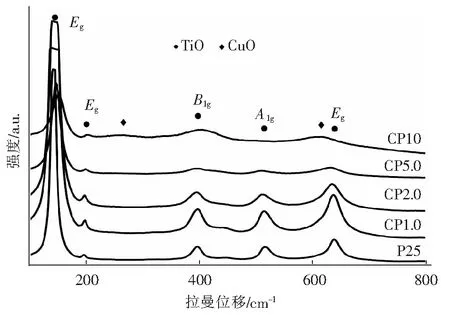
图4 P25和CuO/TiO2的Raman谱图Fig.4 Raman spectra of P25 and CuO/TiO2
3.4 CuO的最佳负载量
图5为CuO/TiO2光催化剂的制氢活性对比,采用300 W氙灯光源,选择乙二醇作为电子给体,考察光催化6 h平均速率。从图5得出最佳CuO负载量为1.0%,模拟太阳光下产氢速率为273 μmol/h·g。随着CuO含量继续增加,产氢速率先增后减。未负载CuO时,催化剂由于光生载流子复合速率快,产氢速率低下;当CuO的负载量增加时,复合光催化剂电荷得到有效转移,产氢速率有所提高。随着CuO的负载量进一步提高,如图3-B所示CuO粒子附着在TiO2的表面,占据了TiO2表面的有效活性位点,使得光照效率低下,光能利用率降低。
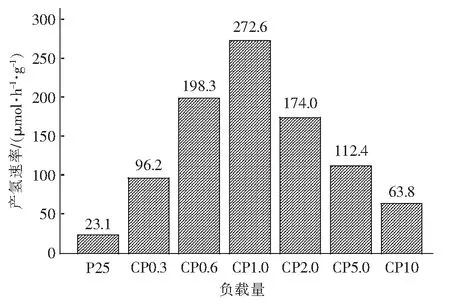
图5 样品在300 W氙灯下的光催化产氢速率Fig.5 H2-evolution photoactivity of samples under irradiation of 300 W xenon lamp(Solution 100 mL,mcatalyst=0.08 g,co(glycol)=1.8 mol·L-1)
3.5 CuO/TiO2光催化剂元素组成与价态分析
选择CuO负载量为1.0%的样品进行了XPS表征。光催化反应后的催化剂经离心过滤、烘箱中120 ℃干燥处理,相比反应前催化剂的颜色发生变化明显加深,由黄绿色变成了淡黄色。图6为CuO/TiO2光催化反应前后Cu 2p3/2和Cu2p2/1的XPS谱图,图中932.4 eV和952.12 eV的结合能分别对应于Cu 2p3/2和Cu 2p2/1,其中Cu元素以Cu2+的形式存在[25],而反应后Cu 2p3/2和Cu 2p2/1处卫星峰明显发生移动,Cu 2p峰位置向低的结合能移动,930.8 eV和950.8 eV结合能分别对应于Cu 2p3/2和Cu 2p2/1,随着光催化反应进行930.8 eV处的Cu 2p3/2和950.8 eV处的Cu 2p2/1峰很可能是由于CuO发生还原反应生成微量Cu2O。
3.6 CuO/TiO2光催化分解水反应机理的论证
通过3.4光催化活性对比,负载CuO后产氢速率明显比纯TiO2高;由3.5光催化反应后XPS结果分析CuO发生还原反应生成了Cu2O。由此推出CuO/TiO2复合光催化剂电荷转移机理。光照下,CuO与纳米TiO2同时产生光生电子—空穴对,由于CuO比表面积大,自身导带位置(0.46 eV)低于TiO2导带位置,TiO2光生电子将从异质结的其他位置向CuO表面迁移或偏移,转移的光生电子不能直接与吸附在催化剂表面的H+发生还原反应生成H2,因为CuO导带位置(0.46 eV)比标准氢电极(NHE)更正。CuO得到转移电子由+2价变为+1价,导带发生还原反应转化为Cu2O[26],Cu2O的导带位置是(-0.28 eV),符合产氢条件。Cu2O在光照下产生的电子与溶液中催化剂表面的H+发生还原反应生成H2,这样TiO2导带位置的光生电子得到了有效的转移,TiO2价带上的光生空穴具有强氧化性,与溶液中催化剂表面的电子给体乙二醇发生氧化反应。光生载流子得到有效分离,抑制复合速率,提高产氢性能。
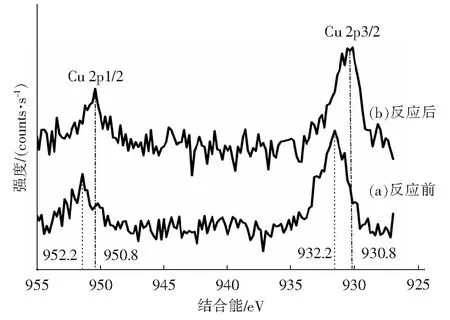
图6 CuO/TiO2催化剂的Cu 2p1/2和Cu 2p3/2的XPS谱图Fig.6 Cu 2p1/2 and Cu2p3/2 XPS spectra of the CuO/TiO2(CP1.0)
4 结论
以TiO2为载体,进行了CuO的负载,制备复合半导体CuO/TiO2光催化剂,催化剂形貌近似于球状,晶粒尺寸约20 nm。研究了CuO的负载量对于光催化性能的影响,结果表明,当CuO的负载量为1.0%,复合材料光催化6 h,模拟太阳光下产氢速率为273 μmol/h·g。使用XPS表征分析了光催化反应前后的样品,证明CuO发生还原反应生成Cu2O,复合半导体CuO/TiO2光催化分解水反应的机理为:负载在TiO2表面CuO在分解水反应过程中,导带发生迁移即发生了还原反应生成Cu2O,乙二醇作为电子给体在价带上与光生空穴发生氧化反应。

