哈茨木霉生物降解木质纤维素研究进展
宋以梅,刘晶晶,高翠娟
哈茨木霉生物降解木质纤维素研究进展
宋以梅,刘晶晶,高翠娟*
临沂大学生命科学学院, 山东 临沂 276000
20世纪工业革命以来,不可再生资源的持续大量消耗已无法支撑经济的长期飞速发展和人类社会的需求。在绿色循环经济的引领下,来源广泛、价格低廉且可再生的木质纤维素为代表的生物质被认为是世界第四大能源。利用微生物进行生物质降解是生产环保型生物化合物的决定性因素。哈茨木霉() 是一种可以抑制植物和土壤病原菌的有益微生物真菌。研究发现哈茨木霉不仅是最主要的生物防治真菌之一,还可以作为产酶系丰富的工业微生物菌株应用于木质纤维素的降解。本文着眼于生物炼制技术,综述了哈茨木霉在降解木质纤维素中的研究,为其利用生物质生产高附加值产品提供理论参考,并为哈茨木霉在生物工程中的应用奠定基础。
哈茨木霉; 降解; 木质纤维素
我国人均占有的能源资源量较低,能源不足成为制约我国经济社会可持续发展的主要因素之一。开发利用新型可再生生物质资源替代化石能源,对于改善空气质量、减少温室效应、缓解不可再生的化石能源供应短缺、建立稳定的能源供应体系具有重要意义。由植物通过光合作用产生的木质纤维素是地球上最大的可再生资源,为自然界中分布最广、含量最多的多糖类生物质。作为丰富的生物基产品原料,木质纤维素可以为乙醇等能源化合物的生产提供充足的发酵底物,因此吸引了众多研究者的目光[1]。
木霉菌属于丝状真菌,能水解天然纤维素,加速作物秸秆腐熟,促进有机废物发酵利用。哈茨木霉()是目前木霉属中研究最多的菌种之一,属半知菌类,孢子耐受力强,分布广泛,易被加工成制剂。与丝状真菌的其他木霉菌相比,哈茨木霉的生态适应性很强,可耐酸碱、低温等恶劣环境;对植物均有明显的促生反应,特别在促进种子的发芽率以及幼苗的出芽率方面效果明显[2];明显控制植物病害,对病原菌的竞争机制、重寄生作用以及抗生作用使其成为一种重要生防真菌;哈茨木霉还可诱导植物抗性,启动植物的防御反应,使植物产生和积累与抗病性有关的酚类化合物和木质素等[3]。近年的最新研究发现,哈茨木霉可产生降解木质纤维素的一系列酶系,具备水解木质纤维素制备可发酵单糖的巨大潜力,因此对生物质的开发利用具有重要研究价值[4]。本文首先介绍天然生物质资源木质纤维素的结构组成、降解机理,随后总结了哈茨木霉在木质纤维素降解中的研究进展,为下一步利用哈茨木霉降解木质纤维素生产高附加值化合物的工业应用奠定基础。
1 生物质木质纤维素
自2015年联合国气候大会通过了大力推进温室气体减排,减缓全球气温上升速度的《巴黎协定》后,开发清洁低碳、无污染、可再生的新能源以及相应资源的利用技术成为众多国家能源发展的重要战略。德国首先提出了以信息技术深度与全面应用为核心的工业4.0的概念。进入工业革命4.0时代,我国积极采取低碳与无碳并举的能源消费转型策略,加强清洁、无污染、可再生新能源技术的研发。自然界中最丰富的木质纤维类生物质或将成为最有潜力的可再生新能源。开发高效利用生物质的微生物潜在菌株以及生产步骤简化、成本低廉、清洁环保的工业生物技术迫在眉睫,在此背景下以生物质为原料的生物炼制技术得到迅速发展[5]。生物质主要是由纤维素、半纤维素、木质素组成的木质纤维素以及淀粉、蛋白胨、脂类等大量含碳化合物。其中,木质纤维素作为最丰富的生物基产品原料,将成为人类未来最有前景的替代资源之一[6,7]。实现生物质木质纤维素的合理利用还能改善大气质量,减少二氧化碳净排放,实现封闭的碳循环,减轻温室效应,还可以缓解农作物废弃物丢弃、焚烧等问题,实现秸秆就地还田。
1.1 木质纤维素的组成
木质纤维素干重的50%~80%是由五碳糖和六碳糖单体聚合而成的,主要是由纤维素、半纤维素和木质素三部分组成。纤维素是一类不溶于水的线性高分子聚合物,是木质纤维素的中含量最多的杂多糖,由8000~10000个D-葡萄糖残基通过β-1,4糖苷键连接而成,作为廉价碳源具有巨大的经济学效益[8]。半纤维素的结构复杂,是由五碳糖聚合而成的一种不均匀分支的多相的杂多糖,是纤维素与木质素的连接枢纽,它的存在使木质纤维素的网状结构更加坚固[9]。木质素是自然界中除纤维素和半纤维素外最丰富的聚合物,主要存在于植物细胞的细胞壁中,可使植物细胞保持较强的韧性、氧化应激性、难穿透性及防御性等保护性能,它的无定形杂聚合结构使其没有旋光性、难溶于水,因而成为微生物和酶水解木质纤维素的最大障碍[10]。

图1 生物质的三大组分:纤维素、半纤维素和木质素
1.2 木质纤维素的降解
木质纤维素的降解是自然界中碳素循环的关键,经过酸或酶水解等方法降解成木糖、葡萄糖等单糖进而作为发酵底物,进而生物合成各种化合物(图2),其转化与利用对解决资源短缺及人类的可持续发展具有重要意义[11]。目前,木质纤维素的降解包括机械粉碎及超声波处理等物理方法、酸或碱处理的化学方法、蒸汽爆破等的物理化学法、利用木霉菌、链霉菌、青霉菌、芽孢杆菌等微生物的生物法以及联合处理法等[12]。物理法、化学法及生物法在木质纤维素降解中的对比如表1所示。生物酶法降解木质纤维素具有反应温和、环境友好性,理化方法降解木质纤维素存在成本高、程序复杂、反应条件强烈及污染环境等问题[13]。

表1 木质纤维素降解方法对比

图2 基于木质纤维素原料为碳源的生物代谢途径总览
当前已发现多种产高活性木质纤维素酶的真菌及细菌能够降解木质纤维素,包括哈茨木霉、绿色木霉、里氏木霉等霉菌和芽孢杆菌等细菌以及部分放线菌等[14]。目前已经分离到可降解木质纤维素的细菌、真菌和放线菌200余种,细菌主要是芽孢杆菌属()、节杆菌属()、固氮螺菌()和伯氏短杆菌()等;真菌主要有木霉属()、曲霉属()和青霉属();放线菌主要是链霉菌属()[15]。表2为细菌、真菌以及放线菌三类微生物在木质纤维素降解中的比较。
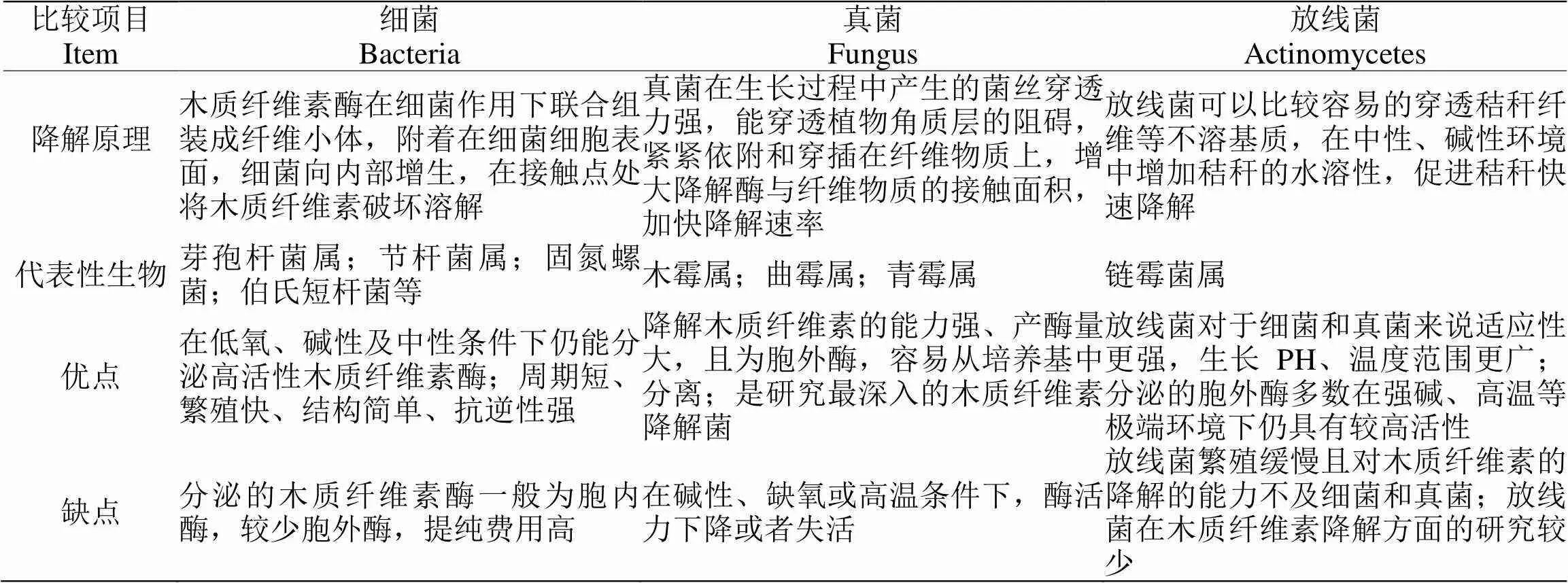
表2 三类微生物降解木质纤维素的对比
近年来,菌株选育向多功能化发展,产耐碱性和酸性、低温和高温木质纤维素酶的工业微生物菌株也受到广泛重视。筛选投入大规模生产的降解木质纤维素的工业微生物还需满足遗传性状稳定、遗传背景清晰、培养条件简单、生长繁殖快、生长周期短、来源广、价格低廉等[7]。符合度较高的真菌成为目前木质纤维素酶研究的主要微生物。木霉是当前研究较多的能够高效降解木质纤维素的丝状真菌之一,其中集生防作用和木质纤维素降解于一体的哈茨木霉是目前木霉属中研究最多的菌种[12,16]。
2 哈茨木霉降解木质纤维素
2.1 工业微生物哈茨木霉
木霉菌属于丝状真菌,广泛存在于不同环境条件的土壤中,能分泌完整的纤维素酶系,可水解天然纤维素,加快秸秆腐熟,促进有机废物的发酵与利用,并且对环境无危害性[17,18]。利用木霉降解木质纤维素是实现作物秸秆等生物质资源化的重要手段。哈茨木霉是木霉属中研究最多的菌种之一,属于丝孢纲,丛梗孢目,丛梗孢科,大量存在于土壤和有机质中,生长迅速,一旦扩增至占据该生境,便会启动强大的降解机制分解附近的基质,使其在与各种微生物的竞争中处于优势[19]。哈茨木霉对致病微生物有杀伤作用,可于生物防治[2,3]。同时,哈茨木霉因产酶系丰富在秸秆等纤维素降解领域得到广泛应用[20]。哈茨木霉生物应用相关的统计见表3。

表3 工业微生物哈茨木霉相关应用统计
2.2 哈茨木霉对木质纤维素的降解研究
目前真菌木霉属已经证实可以产生具有高木质纤维素酶活性的胞外酶。里氏木霉主要表达纤维素酶,包括纤维生物水解酶和内切葡聚糖酶,总丰度高达90%~95%。研究发现,与工业纤维素酶生产者里氏木霉相比,哈茨木霉在其基因组中含有更全面的木质纤维素降解酶编码基因。其中,哈茨木霉基因组中注释了42个纤维素酶基因和24个半纤维素酶基因,分别是里氏木霉基因组的1.5和1.7倍。同时,哈茨木霉的木聚糖酶、甘露聚糖酶和各种糖苷酶的表达量显著高于里氏木霉[19,20]。
2.2.1 纤维素的降解生物法降解纤维素主要包括微生物法和酶解法,其中近年来研究较多的为微生物法[21]。目前用于生产纤维素酶的微生物菌种以木霉属的丝状真菌居多。纤维素酶是水解木质纤维素的最重要的糖苷水解酶,是由多种水解酶组成的、能分解纤维素β-1,4葡萄糖苷键使其水解为葡萄糖的复合酶系,由外切β-1,4葡聚糖酶(exo-β-1,4-glucanase)、内切β-1,4葡聚糖酶(endo-1,4-β-D-glucanase或1,4-β-D-glucan giucano-hydrolase)和β-葡萄糖苷酶(β-glucosidase)三种组分组成[22-,24]。外切β-1,4葡聚糖酶又称为纤维二糖水解酶,对纤维素分子的非结晶区和结晶区均有作用,主要作用于纤维素线状分子的末端,断裂β-1,4-葡萄糖苷键,从纤维素分子两端切下纤维二糖分子;内切β-1,4葡聚糖酶主要对纤维素分子内部非结晶区有作用,随机切断纤维素内部的β-1,4-糖苷键,将长链的纤维素大分子截短,产生带还原性末端的小分子纤维素,从而降低纤维素的聚合度;β-葡萄糖苷酶是一种非专一性酶,又称为纤维二糖酶,主要水解纤维二糖和纤维三糖等多种可溶性的纤维寡糖[6,25]。多项研究表明哈茨木霉中存在水解纤维素的外切β-1,4葡聚糖酶基因。1999年,Guilfoile等从哈茨木霉FP108中克隆出了纤维二糖水解酶Ⅰ(Ⅰ)基因[26];Stursova等在2012年研究森林土壤中可降解纤维素的微生物的过程中,从挪威云杉()所处森林土壤微环境中克隆获得哈茨木霉Ⅰ基因的部分序列[27];但并未进行基因表达研究。2013年,吴柳等从哈茨木霉A25-2中也克隆到Ⅰ基因,并用 pPICZαA表达载体在毕赤酵母中表达,所得到的重组酶活力很低。随后该课题组又从哈茨木霉HP37-4中克隆得到Ⅰ基因的全长DNA序列,并在大肠杆菌中进行表达,结果发现该基因的产物在大肠杆菌表达时形成包涵体,对包涵体进行变性、多肽复性、纯化处理后得到的重组蛋白无酶活性,分析原因可能是大肠杆菌作为原核细胞的折叠机制与真核生物哈茨木霉细胞不同,翻译后的酶蛋白不能实现糖基化修饰,无法产生有正常功能的酶蛋白空间结构而失去酶活性[28]。
2015年,郭建华等人从烟草样本中分离筛选得到一株具有降解纤维素功能的哈茨木霉菌株TC10-13,初始羧甲基纤维素酶(CMCase)活力和滤纸纤维素酶(FPase)活力分别为3.31和0.84 U/mL,在最佳产酶条件(初始pH为5.0,碳源为秸秆,氮源为酵母浸膏)下TC10-13菌株的CMCase和FPase活力分别为15.97和6.38 U/mL[21]。2017年,Delabona等人发现当纤维素酶和半纤维素酶转录因子XYR1的主要激活因子在哈茨木霉中过表达时,β-葡萄糖苷酶含量增加了66%以上,有利于在更短的时间内释放更多的还原糖[29]。2018年,李健从大庆扎龙湿地和森林腐殖土中筛选得到耐低温高效降解纤维素菌株哈茨木霉L8,通过单因素实验确定该菌株所产纤维素酶和滤纸酶的最适温度和pH,结合单因素实验、PB试验设计法、CCD试验设计法及响应曲面模型对产酶条件进行优化,得出在CMC-Na添加量10.63 g/L、硫酸铵添加量2.22 g/L、卵磷脂添加量5.18 g/L、初始pH 5.29时,CMCase高达53.40 IU/mL[30]。2019年,郜普源利用基础盐培养基,以哈茨木霉NJAU4742的胞外木质纤维素酶活力为指标,分别对培养基中的硫酸铵、尿素、磷酸二氢钾、氯化钙含量以及接种量、温度、培养时间等变量进行优化得出:该菌产内切葡聚糖酶的最佳单因子条件为硫酸铵1.4 g/L,尿素0.3 g/L,磷酸二氢钾2 g/L,氯化钙0.5 g/L,接种量105个/mL,温度28 ℃,时间5 d。利用正交设计助手设计实验,优化后得到的产内切葡聚糖酶最佳条件为硫酸铵1.4 g/L,尿素0.3 g/L,磷酸二氢钾2.5 g/L,氯化钙0.4 g/L,接种量105个/mL,温度29 ℃,培养时间5天时内切纤维酶活力为4.93 U/mL[4]。2021年,Delabona着眼于缓解哈茨木霉碳分解代谢抑制(CCR)和增加纤维素酶产量,用空心曲霉的乙酰酰胺酶标记基因(S)替代碳分解代谢物调节器基因(1),构建了∆1哈茨木霉,研究结果表明敲除碳分解产物调节物后哈茨木霉产糖苷水解酶、β-葡萄糖苷酶和木聚糖酶的量均有所提高[31]。
2.2.2 半纤维素的降解半纤维素在自然界中为第二可再生多糖资源,最主要的组分是木聚糖,甘露聚糖是含量仅次于木聚糖的第二大复合物。木聚糖酶可将木聚糖降解为木糖和低聚糖的木糖苷键水解酶,其产生菌主要有细菌(如短小芽孢杆菌)和木霉菌属() 、曲霉菌属()、链霉菌属()等丝状真菌,且真菌木聚糖酶的活性普遍高于细菌木聚糖酶[32]。甘露聚糖由半乳糖、葡萄糖等以α/β-1,6-糖苷键聚合而成,主要由β-甘露聚糖酶将其在自然条件下水解成甘露寡糖,而β-甘露聚糖酶的最大来源是细菌和真菌等微生物[33]。
2019年,陈兴在研究不同初始pH对哈茨木霉分解木质纤维素影响时发现,哈茨木霉NJAU4742能够在pH 3.0-8.0的范围内以水稻秸秆为唯一碳源的液体培养基上生长,通过固体发酵实验得出哈茨木霉NJAU4742在pH6.0分解水稻秸秆效果最佳,并且在该条件下菌体生长最快,胞外蛋白浓度最高(36.3 mg/g),酶活力最强(内切葡聚糖酶活:87.3 U/g,木聚糖酶活:244.4 U/g)[34]。同时,郜普源通过单因子试验得到哈茨木霉NJAU4742产木聚糖酶的最佳条件(硫酸铵1.4 g/L,尿素0.25 g/L,磷酸二氢钾2 g/L,氯化钙0.4 g/L,接种量105个/mL,温度28 ℃,pH3.0,培养时间为7 d)。结合软件进行实验设计与方差分析,进而找到影响菌株产酶的核心因子,以核心因子为变量条件设计实验,木聚糖酶的最高酶活力达到19.86 U/mL,比优化之前提高了25%[4]。2021年,张梅娟等人从平菇栽培污染菌包中采用平板水解圈法筛选出1株高产木聚糖酶的哈茨木霉菌株ZJ-01,经过单因素试验得出该菌株固态发酵产木聚糖酶的最优发酵条件是玉米酒精酒糟作氮源,玉米皮为适宜碳源,氮、碳源质量比为8:2,在该条件下发酵72 h木聚糖酶活力达到3574 U/g[35]。
2.2.3 木质素的降解作为自然界含量最多的芳香化合物,木质素结构极其复杂,不易被微生物分解。因此微生物对木质素的降解机制非常复杂,木质素的降解也需要多种酶分工合作才能完成[36]。过氧化物酶(LiP)、锰过氧化物酶(MnP)以及漆酶(Lac)等是木质素降解酶系的主要降解酶,此外,葡萄糖苷酶、还原酶、过氧化物歧化酶、甲基化酶、乙二醛氧化酶、葡萄糖氧化酶等可在其中起辅助作用[37]。目前已发现的木质素降解酶系可分为从模式菌白腐真菌()中发现的LiP- MnP型、偏肿栓菌()中发现的LiP- MnP- Lac型、平菇菌()中发现的LiP- Lac型、香菇菌()中发现的MnP- Lac型[38]。其中,LiP- MnP型为木质素最有效的降解酶系类型[39]。
目前,有关哈茨木霉菌产木质素降解酶的研究较少。2010年,白娜实验室筛选到具有产酶时间短、降解木质素能力高、生长快等优点的降解木质素的新型菌株哈茨木霉WRF-2,经苯胺蓝脱色平板和鞣酸平板定性检测出具有过氧化物酶和锰过氧化物酶活性,且降解酶系属于LiP- MnP型。他们从高效产木质素降解酶系的优化入手,采用浅层振荡发酵方式进行单因素试验和正交试验,得出30 ℃、200 r/min摇床培养3天的低碳高氮浅层振荡培养为哈茨木霉的最佳产胞外过氧化物酶(LiP)条件。他们随后采用紫外线照射哈茨木霉WRF-2的孢子悬液,获得了一株细胞生长快、木质素过氧化物酶和锰过氧化物酶活性均提高的突变菌株0202。通过木质素作用条件的优化研究,得到40 ℃、pH值3.0、150 r/min酶解48 h为粗酶液降解玉米秸秆木质素的最适条件[36]。
3 展望
我国新旧动能转换的大背景下,自然界中产量最大、分布最广的生物质木质纤维素有望成为代替石油的“工业血液”。但由于其多糖结合的复杂性和高聚合性,使木质纤维素难以得到充分的开发。微生物可代谢碳源的多样性为生物质木质纤维素的开发与利用提供了突破点。目前微生物产生的木质纤维素的大部分降解酶都存在不同程度的酶活性不高、酶系不完全、酶作用条件苛刻的问题。哈茨木霉高产水解纤维素的β-1,4葡聚糖酶、降解半纤维素的木聚糖酶、降解木质素的LiP- MnP型降解酶系,集分布广泛、生长迅速、产酶相对丰富、碳源利用多样性等优点于一体的哈茨木霉有望成为充分开发利用生物质木质纤维素的潜在工业微生物菌株。加快选育性状优良的分泌高活性木质纤维素酶的菌株、提高木质纤维素的降解效率仍然是当前和今后研究的主要目标。在不断筛选、寻找新的高效降解菌株、扩充纤维素降解菌基因库的同时,有目的的不断的驯化、诱变和改造木质纤维素降解菌株,促进生物炼制产业的发展。
[1] 孔雯,谢俊,刘海英,等.木质纤维素“糖平台”的生物炼制与绿色化学[J].黄冈师范学院学报,2021,41(3):101-103,113
[2] 武慧,刘畅,樊航,等.枯草芽孢杆菌与哈茨木霉对黄瓜幼苗生长的协同促进作用[J].吉林师范大学学报(自然科学 版),2021,42(3):95-99
[3] 罗梅, 陈欣瑜,董章勇.全基因组预测哈茨木霉的效应子[J].西南农业学报,2020,33(9):1964-1968
[4] 郜普源.哈茨木霉NJAU4742产木质纤维素酶系及其降解稻草秸秆效应研究[D].南京:南京农业大学,2019
[5] 张思莹,陈彦,刘志华,等.生物炼制过程中木质素高值转化研究进展[J].生物工程学报,2021,37(9):3108-3128
[6] 翟莉莉.高产纤维素酶菌株哈茨木霉EUB11纤维素酶的发酵条件优化及棕榈空果串纤维的酶解糖化发酵[D].武 汉:武汉工程大学,2015
[7] 宋以梅,贾秀伟,李树标,等.工业微生物解脂耶氏酵母及其应用研究[J].中国生物工程杂志,2020,40(9):77-86
[8] 何楠,令利军,冯蕾,等.1株产纤维素酶细菌的筛选、鉴定及生长特性[J].微生物学杂志,2017,37(1):43-49
[9] 乐文民,李江华,刘龙,等.产中性纤维素酶细菌的筛选及培养基优化[J].食品与生物技术学报,2015,34(2):183-188
[10] Shyamal R. Pre-treatment Methods of Lignocellulosic Biomass for Biofuel Production [M]. Raton USA: CRC Press,2021
[11] 谢骜,李畅.桑天牛产纤维素酶细菌的分离及其内切葡聚糖酶基因在乳酸杆菌中的表达[D].陕西:西北农林科技大学,2020
[12] 宫秀杰,钱春荣,于洋,等.近年纤维素降解菌株筛选研究进展[J].纤维素科学与技术,2021,29(2):68-77
[13] 张毅,张宏,刘云云,等.纤维素燃料乙醇预处理技术研究进展[J].可再生能源,2021,39(2):148-155
[14] 章沙沙,徐健峰,柳增善.纤维素降解菌的研究与应用进展[J].工业微生物,2021,51(2):46-52
[15] 许从峰,艾士奇,申贵男,等.木质纤维素的微生物降解[J].生物工程学报,2019,35(11):2081-2091
[16] Zhao XL, Zheng ZH, Cai YF,. Pretreatment by crude enzymatic liquid fromandsp improving methane production performance during anaerobic digestion of straw [J]. Editorial Office of Transactions of the Chinese Society of Agricultural Engineering, 2018,34(3):219-226
[17] 屈海泳,刘连妹,吴纯.木霉菌液体发酵对秸秆的降解作用[J].江苏农业科学,2014,42(7):283-285
[18] 李含芬,马春晖,王永章,等.哈茨木霉菌对小麦秸秆降解作用的研究[J].中国农学通报,2016,32(3):120-123
[19] Zhang Y, Yang JS, Luo LJ,. Low-cost cellulase-hemicellulase mixture secreted byEM0925 with complete saccharification efficacy of lignocellulose [J]. International Journal of Molecular Sciences, 2020,21(2):371-388
[20] Borisova AS, Eneyskaya EV, Jana S,. Correlation of structure, function and protein dynamics in GH7 cellobiohydrolases from,and[J]. Biotechnology for biofuels, 2018,11(1):46-68
[21] 郭建华,奚家勤,宋纪真,等.纤维素降解菌哈茨木霉TC10-13产酶条件优化[J].南方农业学报,2015,46(1):79-84
[22] Trudeau DL, Lee TM, Amold FH. Engineered thermostable fungal cellulases exhibit efficient synergisticcellulose hydrolysis at elevated temperatures [J]. Biotechnol Bioeng, 2014,111(12):2390-2397
[23] Anthi CK, Evangelos T, Paul C. Cloning, expression, and characterization of a thermostable GH7 endoglucanase fromcapable ofhigh-consistency enzymatic liquefaction [J]. Appl Microbiol Biotechnol, 2014,98(1):231-242
[24] Kishita S, Ujji T, Ishikawa K. Heterologous expression of hyperthermophilic cellulases of archaeasp by fungus[J]. JInd Microbiol Biotechnol, 2015,42(1):137- 141
[25] 黄国昌,熊大维,顾斌涛.内切葡聚糖酶基因克隆和表达研究进展[J].江西科学,2016,34(1):24-28,51
[26] Guillfile PG, Bums R, Gu ZY,. Cloning and sequencing of acellobiohydrolase gene fromFP 108 [J]. Journal of the Minnesota Academy of Science, 1999,64(1):18-22
[27] Stursova M, Zifcakova L, Leigh MB,. Cellulose utilization inforest litter and soil: identification of bacterial and fungal decomposers [J]. FEMS Microbiology Ecology, 2012,80(3):735-746
[28] 吴柳,张政,卢业飞,等.哈茨木霉HP37-4纤维二糖水解酶Ⅰ基因的克隆及表达[J].西南农业学报,2013,26(5):1847-1851
[29] Priscila SD, Gisele NR, Mariane PZ,. The relation between xyr1 overexpression inand sugarcane bagasse saccharification performance [J]. Journal of Biotechnology, 2017,246(20):24-32
[30] 李健.三株耐低温纤维素降解菌的筛选及性能研究[D].东北:东北农业大学,2018
[31] Delabona PS, Lima DJ, Codima CA,Replacement of the carbon catabolite regulator (cre1) and fed-batch cultivation as strategies to enhance cellulase production in[J]. Bioresource Technology Reports, 2021,13:100634
[32] 刘亚力,刘路宁,张敬泽,等.生防哈茨木霉菌株产木聚糖酶的条件研究[J].浙江大学学报(农业与生命科学版),2009,35(2):141-146
[33] 张建新,宋宜乐,冯军厂,等.微生物β-甘露聚糖酶的研究进展[J].中国酿造,2019,38(4):7-10
[34] 陈兴.不同pH对哈茨木霉NJAU4742分解木质纤维素的影响[D].南京:南京农业大学,2019
[35] 张梅娟,钱朋智,董力青,等.一株哈茨木霉的鉴定及固态发酵产木聚糖酶条件研究[J].食品与发酵工业,2021,47(3):43-48
[36] 白娜.哈茨木霉WRF-2木质素降解酶系高产菌株培育及其对玉米秸秆生物降解研究[D].陕西:西北农林科技大学, 2010
[37] 杨静,蒋剑春,张宁,等.微生物降解木质素的研究进展[J].生物质化学工程,2021,55(3):62-70
[38] 董秀芹,袁红莉,高同国.木质素降解酶及相关基因研究进展[J].生物技术通报,2014(11):62-72
[39] 胡笑峰,张朵朵,周云横,等.一株木质素降解菌的鉴定及其降解特性[J].生物技术通报,2019,35(9):172-177
Research Progress of Lignocellulose Degradated by
SONG Yi-mei, LIU Jing-jing, GAO Cui-juan*
276000,
Most countries in the world have completed the industrial revolution since the 20th century. The massive consumption of non-renewable resources such as coal, oil, and natural gas cannot support the long-term rapid economic development. Non-renewable resources would not meet the needs of mankind. With the seeking of accelerated development of green and recycling economy, lignocellulose, which exists extensively and is rich in reserves, low-carbon, environmentally friendly, low-priced, and renewable, is regarded as the fourth largest energy source in the world. The degradation of biomass using industrial microorganisms is still considered a decisive stage for the production of environmentally friendly bio-chemiecals.is a filamentous probiotic fungus that can restrain pathogenic bacteria from plants and soil. It is found that the industrial microorganismis not only one of the most important biocontrol fungi, but also can be used as an enzyme-producing strain for the degradation of lignocellulose. This article reviews the studies ofin decomposing cellulose, hemicellulose and lignin respectively. It contributes to make full use of biomass lignocellulose byand produce high value-added chemicals, which lays foundation for the industrial application ofin the field of microbial technology.
; degradation;lignocellulose
TQ35
A
1000-2324(2021)05-0886-07
2021-02-12
2021-05-14
国家自然科学基金资助项目(31700074)
宋以梅(1998-),女,本科生,专业方向:环境微生物研究. E-mail:2971195549@qq.com
通讯作者:Author for correspondence. E-mail:gaocuijuan@lyu.edu.cn

