氟虫腈单克隆抗体的制备及其在牛乳检测 中的应用
张二敬,李玉静,李紫然,赵 丽,刘静静,张 静,赵宝华,,李春生,
(1.河北师范大学生命科学学院,河北 石家庄 050024;2.河北交通职业技术学院纪检监察处,河北 石家庄 050035;3.河北省科学院生物研究所,河北 石家庄 050081)
随着生活品质的提升,多种乳制品已经出现在日常饮食中,我国对于乳制品的农药残留检测也越来越重视。氟虫腈是牛乳中的一种农药残留,它是一种苯基吡唑类新型高活性杀虫剂[1],作用原理是阻碍昆虫γ-氨基丁酸控制的氯化物代谢[2]。通过此作用原理氟虫腈不但可以杀死鳞翅目、直翅目害虫和土壤中鞘翅目害虫的幼虫,也可以用于杀灭对菊酯类氨基甲酸类和环戊二烯类产生抗性的害虫[3],而且效果极佳[4]。氟虫腈通过饲料进入牛体内,牛产乳后进而残留于牛乳中。长期摄入氟虫腈对人体的肝脏带来严重不良影响[5]。氟虫腈经过水解及光解作用产生代谢产物氟虫腈砜、氟虫腈亚砜和氟甲腈[6]。目前乳制品中氟虫腈的检测方法有气相色谱法[7-10]、气相色谱-质谱法[11-12]、液相色谱法[13]和液相色谱-串联质谱法[14-16]。 这些方法由于样品处理复杂、操作繁琐,在检测上有一定的弊端。免疫分析技术已成功应用于多种农药及其代谢物的残留分析[17-21],它以抗原和抗体之间的特异性识别、可逆性结合为原理,因具有特异性强、灵敏度高、操作相对简单、检测速度快、成本低廉等诸多优点而备受瞩目,因此氟虫腈人工抗原的合成及其单克隆抗体的制备对于免疫反应显得尤为重要。具有高特异性抗体的制备依赖于半抗原分子的合成[22]。本研究利用氟虫腈分子的化学结构进行一系列反应,将氟虫腈连接到大分子蛋白上,从而合成人工完全抗原,然后利用合成的人工完全抗原制备单克隆抗体,合成的单克隆抗体用于牛乳中氟虫腈的检测。
1 材料与方法
1.1 材料与试剂
牛乳 蒙牛乳业(集团)股份有限公司,氟虫腈 上海市农药研究所;牛血清蛋白(bovine serum albumen,BSA)、卵清蛋白(ovalbumin,OVA) 北京索莱宝科技有限公司;HAT培养基添加剂(50×)Hybri-MaxTM、HT培养基添加剂(50×)Hybri-MaxTM、弗氏完全佐剂、弗氏不完全佐剂、碳化二亚胺(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)、 免疫球蛋白(immunoglobulin,Ig)亚型检测试剂盒 美国Sigma公司;胎牛血清 上海生物工程有限公司;辛酸、硫酸铵 国药集团化学试剂有限公司;BALB/c小鼠 河北医科大学实验动物中心;SP2/0细胞由本研究室保存。
1.2 仪器与设备
电子分析天平 瑞士Mettler Toledo公司;Multiskom GO酶标仪 美国Bio-Tek公司;MCO-15AC二氧化碳培养箱 日本三洋公司;ND-2000超微量分光光度计 美国Thermo公司;恒温干燥箱、HH-M4电热恒温水浴锅 上海精宏设备有限公司;漩涡混合器 上海医科大学仪器厂;倒置显微镜 日本Olympus公司;D-37520高速冷冻离心机 德国Beckman公司。
1.3 方法
1.3.1 人工完全抗原的合成
氟虫腈-BSA(F-BSA)、氟虫腈-OVA(F-OVA)人工完全抗原的制备:采用戊二醛法[23],称取氟虫腈标准品20 mg溶解到3 mLN,N-二甲基甲酰胺(N,Ndimethylformamide,DMF)中,加入90 μL体积分数10%的戊二醛溶液,室温下搅拌10 min,称为溶液A;分别称取BSA、OVA各50 mg,用10 mL 0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)溶解后加入10 mL硼酸盐缓冲液(pH 8.6),称为溶液B;冰浴条件下逐滴将溶液A滴加到溶液B中,搅拌过夜;次日透析即得F-BSA、F-OVA人工完全抗原。
氟虫腈类似物(FH)-BSA(FH-BSA)、FH-OVA人工完全抗原的制备:称取氟虫腈标准品0.3 g,用10 mL丙酮溶解,然后用1 mol/L NaOH调节pH值到12,室温下搅拌2 h,用电磁炉水浴加热4~5 h,室温冷却,取上清液用1 mol/L HCl调节pH值至5、有淡黄色沉淀析出,5 000 r/min离心20 min,弃上清收集沉淀,用1 mol/L NaOH和1 mol/L HCl洗涤2 次,淡黄色沉淀即为FH[23]。以FH为半抗原,采用EDC法[23-25]合成人工完全抗原:称取EDC 0.012 g,溶于500 μL DMF中,冰浴中加入0.05 g FH搅拌4~6 h,称为C液;分别取1 mL 5 mg/mL BSA和1 mL 5 mg/mL OVA称为D液,冰浴条件下将C液逐滴加入到D液中,搅拌过夜;次日透析即得FH-BSA、FH-OVA人工完全抗原。
1.3.2 人工完全抗原的鉴定
1.3.2.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis, SDS-PAGE)
依次将FH-OVA、F-OVA、OVA、蛋白Maker(10~180 kDa)、BSA、F-BSA、FH-BSA稀释至 1 mg/mL上样,Maker上样量5 μL,其余样品上样量15 μL,使用12%分离胶、3%浓缩胶,30 V电压电泳30 min后调至100 V电泳4 h。
1.3.2.2 紫外光谱扫描
使用紫外-可见分光光度计扫描,设置波长为250~400 nm,鉴定F-BSA、F-OVA的合成情况。
1.3.3 单克隆抗体的制备
选取3 只6~8 周龄的正常雌性BALB/c小鼠,每只小鼠用F-BSA人工完全抗原免疫,免疫剂量40 μg,每隔2 周免疫1 次,共免疫3 次,7 d后加强免疫1 次。小鼠眼球取血,用间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测小鼠血清抗体效价,选取最佳免疫小鼠,使用聚乙二醇法进行融合,经过3 次亚克隆稀释,筛选得到最佳的杂交瘤细胞株,腹腔注射小鼠,取腹水采用辛酸-硫酸铵沉淀的方法纯化IgG,-20 ℃保存。
1.3.4 单克隆抗体的检测
1.3.4.1 单克隆抗体质量浓度及效价测定
使用超微量分光光度计检测抗体质量浓度,采用间接ELISA法测定抗体效价。包被0.05 μg/mL F-OVA人工完全抗原,4 ℃过夜,依次加入制备的单克隆抗体,第1个孔稀释200 倍,后面依次在前一个孔的基础上稀释2 倍,酶标二抗1∶5 000稀释,37 ℃反应45 min,显色终止后在酶标仪450 nm波长处读取吸光度(A450nm)。以下涉及间接ELISA方法步骤均与本节相同。
1.3.4.2 单克隆抗体亚型测定
使用免疫球蛋白亚型检测试剂盒测定单克隆抗体的亚型。
1.3.4.3 单克隆抗体亲和常数(Ka)测定
采用间接ELISA法测定抗体的Ka,以抗体质量浓度的对数为横坐标,以A450nm为纵坐标,绘制S型曲线,计算单克隆抗体的Ka[26]。
1.3.4.4 单克隆抗体特异性测定
以氟虫腈作为对照,以氟甲腈、氟虫腈亚砜、氟虫腈砜为竞争抗原,测定交叉反应率,用竞争ELISA方法测得氟虫腈和其他3 种代谢物的半抑制质量浓度(semiinhibitory concentration,IC50),交叉反应率按下式计算。

1.3.4.5 单克隆抗体抑制曲线绘制
采用竞争ELISA方法,单克隆抗体按1∶64 000稀释,添加不同质量浓度(2.000、1.000、0.500、0.250、0.125 μg/L)氟虫腈标准溶液,测定A450nm。没有加入氟虫腈标准溶液的孔A450nm记为B0,添加不同质量浓度标准溶液的孔A450nm记为B,以不同标准溶液质量浓度的对数值为x轴,B/B0为y轴,建立抑制曲线。
1.3.5 加标回收率与精密度测定
准确量取1 mL牛乳,加入4 mL乙腈,漩涡混合2 min,4 000×g离心5 min,取上清液,重复提取1 次,将2 次上清液合并,用乙腈定容至10 mL;取2 mL 35 ℃水浴氮吹至干,然后加入2 mL 0.01 mol/L PBS复溶。牛乳中氟虫腈加标量分别设置为1、2、5 μg/L,每个加标量设6 个平行,采用ELISA法测定,计算加标回收率与精密度。
1.4 数据处理
绘图及数据处理软件为Origin和Microsoft Excel 2010。
2 结果与分析
2.1 SDS-PAGE结果
由图1可知,根据SDS-PAGE结果,F-BSA在BSA上方出现条带,表明抗原合成成功。FH-BSA的条带明显比BSA条带宽,表明抗原合成成功。F-OVA有明显的条带滞后于OVA,表明抗原合成成功,而FH-OVA条带与OVA条带接近,无法判断合成结果。
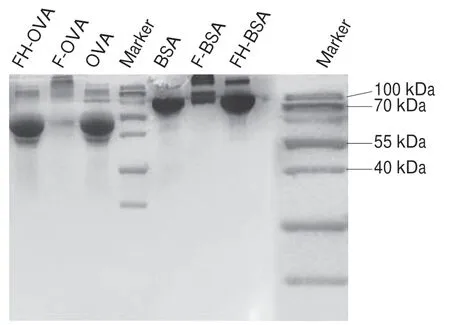
图1 人工合成抗原SDS-PAGE结果Fig. 1 SDS-PAGE patterns of synthetic antigens
选择F-BSA和F-OVA,采用紫外光谱扫描进一步鉴定二者的合成情况。
2.2 紫外光谱扫描结果
由图2可知,氟虫腈、BSA的最大吸收峰分别位于306.7、283.6 nm波长处,而BSA与氟虫腈偶联形成的F-BSA的最大吸收峰位于289.1 nm波长处,最大吸收峰发生偏移且介于二者之间,由此可知,合成抗原F-BSA偶联成功。氟虫腈、OVA的最大吸收峰分别位于306.7、285.2 nm波长处,而OVA与氟虫腈偶联形成的F-OVA的最大吸收峰位于287.6 nm波长处,由此可知,合成抗原F-OVA偶联成功。

图2 F-BSA和F-OVA紫外光谱扫描结果Fig. 2 UV absorption spectra of F-BSA and F-OVA
根据实验结果,后期选用F-BSA免疫小鼠,制备单克隆抗体。
2.3 小鼠血清效价测定结果
小鼠血清效价3 次平行测定结果分别为4.1×105、2.0×105、4.1×105。
2.4 单克隆抗体质量浓度及效价测定结果
融合后筛选出分泌单克隆抗体的3F6杂交瘤细胞株,诱生的腹水经辛酸-硫酸铵沉淀法纯化后即为单克隆抗体3F6,用超微量核酸蛋白测定仪测得单克隆抗体3F6质量浓度为8.5 mg/mL,间接ELISA测得效价为2.0×106。
2.5 单克隆抗体3F6亚型测定结果
由图3可知,杂交瘤细胞3F6分泌的单克隆抗体3F6与不同亚类的二抗显色结果不同,与IgG1二抗的显色度最高,与IgM的二抗有微弱的显色,而与IgG2a、IgG2b、IgG3和IgA的二抗几乎不显色,所以单克隆抗体3F6亚型为IgG1。
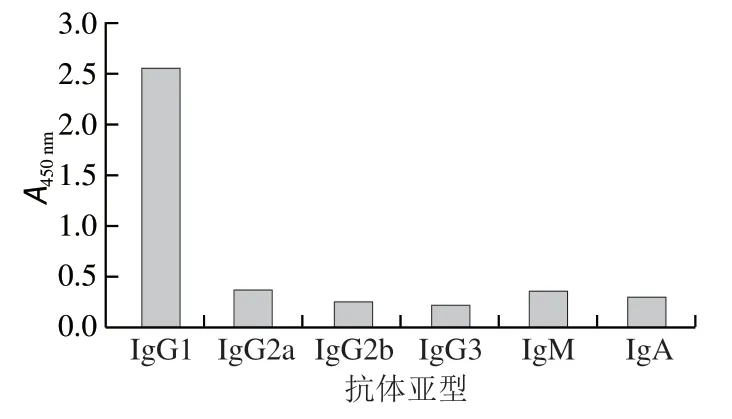
图3 单克隆抗体3F6亚型Fig. 3 Subtype composition of monoclonal antibody 3F6
2.6 单克隆抗体3F6 Ka测定结果
由图4可知,采用间接ELISA法测定单克隆抗体3F6的Ka,绘制S型曲线,根据Ka公式计算得Ka=4.6×1010L/mol。
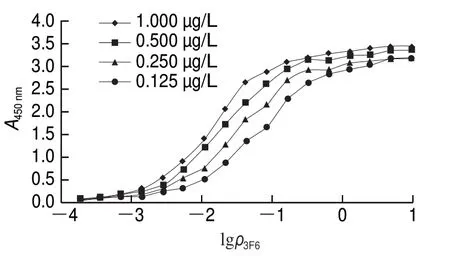
图4 单克隆抗体3F6的KaFig. 4 Ka of monoclonal antibody 3F6
2.7 单克隆抗体3F6特异性测定结果
以交叉反应率来表征抗体的特异性。由图5可知,以氟甲腈、氟虫腈亚砜、氟虫腈砜为竞争抗原,氟虫腈作为对照,采用ELISA方法测定,其交叉反应率分别为9.21%、21.46%、14.02%,说明制备的单克隆抗体3F6特异性良好。
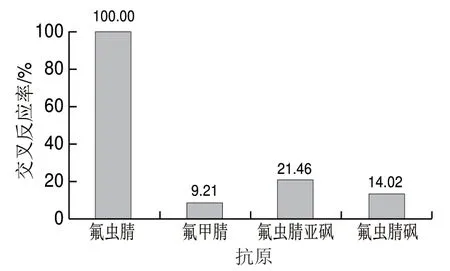
图5 交叉反应率测定结果Fig. 5 Cross-reaction rates
2.8 单克隆抗体3F6抑制率测定结果
由图6可知,在0.125~2.000 μg/L质量浓度范围内,线性关系良好(R2=0.994 1),单克隆抗体3F6的IC50为0.32 μg/L,对氟虫腈具有较高的敏感性。
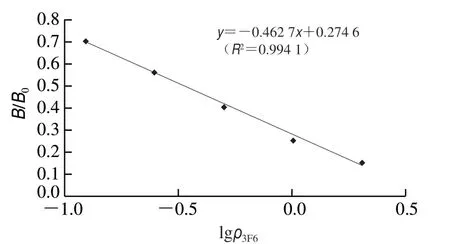
图6 单克隆抗体3F6对氟虫腈的抑制率Fig. 6 Inhibition rate of monoclonal antibody 3F6 on fipronil
2.9 加标回收率与精密度
由表1可知,批内与批间加标回收率为87.00%~118.00%,变异系数在15%以内,表明方法具有较高准确度和精密度。
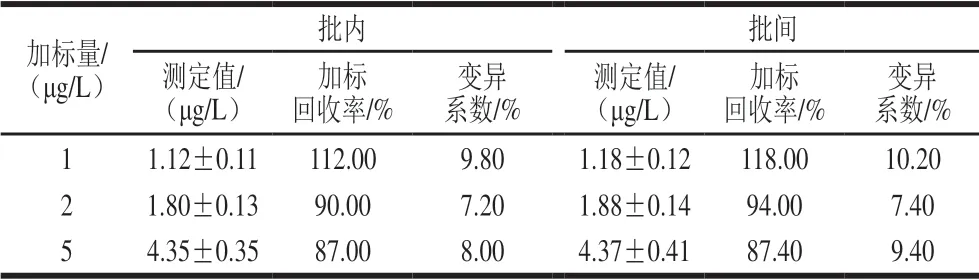
表1 样品加标回收率和变异系数(n=6)Table 1 Recoveries and coefficients of variation for spiked samples (n = 6)
3 结 论
根据氟虫腈的分子结构,用戊二醛法和EDC法合成氟虫腈人工完全抗原,对抗原进行SDS-PAGE鉴定,结果表明,F-BSA、FH-BSA抗原合成成功,F-OVA有明显的条带在OVA条带上方,表明抗原合成成功,而FH-OVA条带与OVA条带接近,无法判断合成结果。对氟虫腈人工完全抗原F-BSA、F-OVA进行紫外光谱鉴定,结果显示,BSA与氟虫腈偶联形成的F-BSA的最大吸收峰位于289.1 nm波长处,OVA与氟虫腈偶联形成的F-OVA的最大吸收峰位于287.6 nm波长处,抗原F-BSA、F-OVA偶联成功。
运用小鼠腹内诱生腹水的方法得到氟虫腈单克隆抗体3F6,其质量浓度为8.5 mg/mL,间接ELISA法测得效价为2.0×106,亚型检测试剂盒测得单克隆抗体3F6亚型为IgG1,间接ELISA法测得单克隆抗体3F6的Ka为4.6×1010L/mol,与氟甲腈、氟虫腈亚砜、氟虫腈砜的交叉反应率分别为9.21%、21.46%、14.02%。建立氟虫腈的抑制曲线,结果显示,在0.125~2.000 μg/L质量浓度范围内,线性关系良好(R2=0.994 1),IC50为0.32 μg/L,单克隆抗体3F6对氟虫腈具有较高的敏感性。
牛乳中氟虫腈加标量分别为1、2、5 μg/L时,每个加标量设6 个平行,批内与批间回收率为87.00%~118.00%,变异系数在15%以内,本研究方法具有较高准确度和精密度。

