海藻提取物对茶树抗寒性的影响研究
于 敏,范 斌,袁奇军,侯 剑,于淑华,韩晓阳*,黄晓琴*
1. 山东农业大学 园艺科学与工程学院/作物生物学国家重点实验室,山东 泰安 271000;2. 山东捷晶集团公司,山东 日照 276800;3. 日照市豫园春茶业有限责任公司,山东 日照 276813;4. 日照市岚山区茶技术推广服务中心,山东 日照 276807
茶树是多年生、木本、常绿植物,对寒冷的耐受性较低。在中国长江以北茶区,冬季和春季低温时间很长,暴露于低温胁迫下的茶树会导致氧化胁迫[1],这大大增加了活性氧(ROS)的产生。 低温和光照会增加茶树中ROS的水平[2]。ROS与脂质、蛋白质和DNA发生反应,导致细胞损伤并影响茶树的生长和生产[3]。
低温逆境下,采用由一种或多种物质组成的生物刺激剂可刺激植物的生长发育过程,从而提高对非生物胁迫的耐受性,提高植物生长和养分的利用效率[4]。海藻和海藻提取物(SWE)已被证明可用于生产各种类别的植物生长生物刺激剂[5-6]。海藻提取物包含许多生物活性物质,包括碳水化合物、脂质、糖、维生素、多酚、矿物质和各种植物激素,它们通常被用作植物生长促进剂[7-8]。海藻提取物可直接刺激植物生长并改善作物生长的环境条件,如促进有益土壤微生物的生长、诱导结瘤和提高对非生物胁迫(如干旱或盐碱度)的抵抗力[9-11]。海藻的种类和含量因种类不同而有所不同[12]。大约20%的海藻水提取物可改善豇豆的生长[13]。使用3%的海藻提取液可提高豇豆的茎长、叶数和产量[7]。SWE还可增强农作物对环境胁迫的耐受性,增加抗氧化剂含量[14-15]。海藻多糖约占海藻干重的40%,是资源利用的重要组成部分,这些糖类既是生命活动的主要能源,又是调节细胞渗透压的重要物质,可有效提高作物的生长速率和抵抗逆境增强的能力。甜菜碱可以提高叶绿素含量,当浓度较高时,调节细胞渗透压,其作为植物体内有机物和无机物的运输载体,参与植物代谢循环过程,能够明显增强逆境抵抗条件下植物对养分的吸收[16]。海藻酸盐促进植物生长和发育并激活植物防御反应。喷施海藻酸盐后,叶片的光合速率及还原糖和脯氨酸含量增加,叶片中的H2O2含量降低[17]。海藻提取物包含多糖、微量营养素和植物生长激素的复杂混合物,可增强植物对非生物胁迫的抗性[5]。
本试验研究将海藻提取液喷施茶树苗并进行低温处理,以探讨海藻提取液在低温胁迫下对茶树的影响机理,为深入研究茶树抗逆性提供理论支持,同时为减少低温逆境对茶树的危害具有实际的应用价值。
1 材料与方法
1.1 植物材料和试验设计
以一年生无性系福鼎大白茶盆栽茶苗(Camellia sinensis (L.) O. Kuntze)为试材,试验在山东农业大学(N-36°19'42'', E-117°11'35'')人工气候箱内进行。选取长势基本一致、无病虫害的一年生茶苗,定植于盆中,每盆3株。盆内栽培基质为草炭和蛭石,按1∶1的体积比混合。将茶苗首先在25℃适应2 d,然后在10℃适应7 d,再转入5℃进行低温处理40 d。试验设海藻提取物喷施组(SWE)(海藻提取物由山东洁晶集团提供)和清水组(Control)。SWE按4% v/v喷施,第一次喷施在茶苗转入5℃温度下开始,每7 d喷施一次,喷施于叶片正反面至滴水为准,并从第一次喷施开始进行试验。试验条件:光培养及暗培养各12 h,光照强度为3.3万lx,空气湿度为80%。
1.2 方法
1.2.1 红外光谱检测
将海藻提取物放入冷冻真空干燥机(EYELA,FDU-2200)内进行冷冻干燥。取1 mg冻干样品和200 mg KBr于玛瑙研钵中充分研磨均匀,置于模具中,在油压机上压成透明薄片,将样片放入傅里叶红外光谱仪中测试。波数范围4000 ~ 400 cm-1,扫描次数32,分辨率4 cm-1。
1.2.2 叶片组织观察
1.2.3 叶绿素及叶绿素荧光参数测定
利用便携式叶绿素分析仪(SPAD-502Plus,Konica Minolta Holdings,Inc.Japan)测定成熟叶片(顶芽下第三片叶片)中叶绿素含量。使用SPAD仪器在上午7:00到9:00进行测量。叶片边缘周围的六个SPAD读数的平均值用作最终值[21]。
利用FMS-2型脉冲调试荧光仪(Hanstrch,UK)测量叶绿素荧光参数。所有的测量都是在成熟叶(顶芽下第三片叶)上进行。测量之前,叶子适应黑暗至少30 min,以平静反应中心。在光照强度为 125 µmol·m-2·s-1和低测量光束下测量暗适应叶片的最小和最大荧光值。在自然光下测量初始、最大和发光荧光值。根据Li方法计算叶片的最大光系统II(PSII)效率(Fv/Fm)、非光化学荧光猝灭(NPQ)、光化学猝灭系数(qP)和相对PSII电子转移速率(ETR)[22]。
1.2.4 SOD、POD、CAT测定
鲜叶样(0.2 g)在含有0.1 mmEDTA和1%聚乙烯的5 mL冷磷酸盐缓冲液(50 mm,pH 7.8)中研磨。匀浆在11000 r·min-1、4℃下离心20 min,上清液检测SOD、POD、CAT活性。
用硝基蓝四唑(NBT)测定SOD活性[23]。试剂(酶)用量(mL)最终浓度(比色时间):50 mm磷酸盐缓冲液(pH 7.8)、13.0 mm蛋氨酸、10 μm硝基蓝四唑(NBT)、0.1 mM medta、0.1 mM核黄素和50 μL酶提取物,在560 nm处记录吸光度。SOD的活性单位是NBT光化学还原(U)的50%抑制[24]。
用愈创木酚法测定了POD的活性,并对其进行轻微修饰。将磷酸缓冲液(2 mL,50 mM,pH 7.8)、愈创木酚(0.8 mL,1%)和H2O2(0.8 mL,10 mM)放入试管中,试管置于25℃的水罐中保持3 min。将粗酶提取物(50µL)添加到试管中,立即记下时间,同时摇匀后立即倒入比色皿,于470 nm波长下比色,每隔1 min记录1次吸光度值,共记录4次。每分钟A470的0.01变化被认为是一个酶活性单位(U)[25]。
截至2014年年底,全国有效使用绿色食品标志企业总数达到8700家,产品21153个,达到历史新高。2014年上半年统计数据显示,绿色食品大米、水果和茶叶产量已分别占全国大米、水果和茶叶总产量的10.8%、6.8%和3.7%。全国共创建了635个绿色食品原料标准化生产基地,基地种植面积1.6亿亩。
用紫外分光光度法测定CAT的活性。将磷酸缓冲液(1.5 mL,50 mM,pH 7.8)、H2O2(0.3 mL,100 mM)和蒸馏水(1 mL)放入试管中,试管放置在保持在25℃的水槽中3 min。将粗酶提取物(100 µL)添加到试管中,并在240 nm下每1 min测量所得混合物的吸光度4次,以每分钟A240的变化表明酶活性单位(U)[26]。
1.2.5 qPCR
总RNA的提取采用植物RNA快速提取试剂盒(北京艾迪实验室生物技术有限公司)。使用琼脂糖电泳检测RNA的完整性,并使用超微分光光度计(Thermo NanoDrop 2000,America)分析总RNA的纯度。以RNA为模板,Oligodt18为引物,合成了第一链cDNA。根据GenBank数据库中的基因序列,利用引物5.0设计特异引物(表1),选择β-actin作为内参照基因。扩增反应在定量PCR系统(美国罗氏Lightcycler 96)上进行。荧光定量检测试剂为SYBR定量检测试剂盒(Takara)。用SYBR预混物Ex-Taq II(10 μL)、引物(0.6 μL)、cDNA 模板(1 μL)、dd H2O(8.4 μL)进行反应,反应步骤如下:预变性(95℃,30 s)、PCR反应(95℃,5 s;62℃,14 s;40个周期),溶解(95℃,5 s;60℃,60 s;95℃,15 s)每个反应重复三遍,并使用2-ΔΔ CT方法确定相对表达[27]。

表1 引物序列Table 1 Primer sequences used in this study
1.2.6 数据分析
统计分析使用spss 16进行。采用单因素方差分析和最小显著性差异检验比较两个处理的平均值。显著性水平设为p= 0.05。Origin 8.0用于制作图形。
2 结果与分析
2.1 海藻提取液的官能团
从图1可看出,图中波数为3348 cm-1宽峰为羟基-OH伸缩振动峰,3009 cm-1峰为= C-H伸缩振动峰,2923 cm-1和2853 cm-1峰分别归属于亚甲基或甲基C-H键对称伸缩振动峰与反对称伸缩振动峰,说明样品中含有蛋白质。1740 cm-1峰为羰基C=O伸缩振动峰,1603 cm-1峰为-OH面内弯曲振动,说明样品中有不饱和脂肪酸存在。1378 cm-1峰为C-H键弯曲振动,1168 cm-1和1059 cm-1峰为C-O-C伸缩振动峰,说明样品中存在甾体与糖类物质。718 cm-1峰为长烃基链的面外摇摆。通过傅里叶红外光谱分析可知,海藻提取物中可能存在蛋白质、不饱和脂肪酸、甾体及糖类等物质。
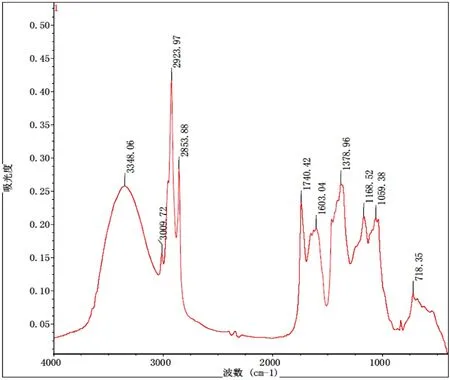
图1 傅里叶变换红外(FTIR)光谱检测海藻提取物官能团结果Figure 1 Results of functional groups in seaweed extracts detected by Fourier transform infrared (FTIR) spectroscopy
2.2 海藻提取液对茶树叶片组织发育的影响
茶树的抗寒性与茶树叶片解剖结构密切相关,抗寒性强的茶树品种栅栏组织的厚度大、细胞层数多、栅海比值高[28]。喷施海藻提取液后茶树叶片厚度、栅栏组织和海绵组织厚度均显著大于对照(p< 0.01),比对照分别增加63.84%、18.72%和8.86%(表2、图2),同时海藻提取物处理P/S和Y值均显著大于对照(p< 0.01);表明低温条件下喷施海藻提取液后促进了叶片、栅栏组织和海绵组织厚度的增加,特别是显著扩大了叶片内物质积累空间,较好地促进养分物质的积累,对提高茶树叶片的抗冷性具有较好的促进作用。

表2 茶鲜叶组织结构Table 2 Tissue structure of fresh tea leaves

图2 低温胁迫下茶叶的组织形态Figure 2 Tissue morphology of tea leaves under low temperature stress
2.3 茶鲜叶中叶绿素含量和叶绿素荧光
与对照相比,喷施海藻提取液20 d和40 d后茶树叶片中叶绿素含量分别显著提高68.85%和97.88%(p< 0.01)(表3)。低温诱导40 d后,海藻提取液处理组茶树叶片的叶绿素含量基本保持不变整体呈现深绿色,而对照组叶片呈黄绿色(图3)。结果表明在低温胁迫下海藻提取液能较长时间保持茶树叶片中叶绿素含量及其稳定性,减缓叶绿素的降解过程。

表3 低温胁迫下茶叶的叶绿素含量和叶绿素荧光参数Table 3 Chlorophyll content and chlorophyll fluorescence parameters of tea leaves under low temperature stress
Fv/Fm比值为PSⅡ的原初光能转化学效率,在低温条件下,比值越小光抑制越重。从表3可看出,随着低温胁迫的延长,茶树叶片中Fv/Fm比值下降,说明低温胁迫降低了茶苗PSⅡ的原初光能转化效率,使茶树PSⅡ反应中心受到伤害。喷施海藻提取物处理后叶片Fv/Fm比值稳定在32.74 ~ 35.42,而对照则下降到17.90~ 19.39。可见,海藻提取物能减轻低温对叶片带来的光抑制破坏,提高PSⅡ的原初光能转化学效率。
荧光猝灭是叶绿体耗散能量的一种途径,分为光化学猝灭qP和非光化学猝灭NPQ两种。由表3可知,随着低温逆境程度的加剧,qP均呈现下降趋势,喷施海藻提取物处理叶片qP显著大于对照(20 d,p< 0.05;40 d,p< 0.05),且qP下降幅度小于对照。表明在低温胁迫下喷施海藻提取物后能提高茶树叶片中PSII 的电子传递活性,从而增强茶树叶片光合碳同化能力,促进有机质的积累。同时,低温胁迫20 d后茶树叶片NPQ下降,但海藻提取物处理NPQ显著大于对照,表明海藻提取液能够增强叶片的光保护能力,避免过剩的光能对叶片组织产生破坏;但随着处理40 d后,光系统遭到了一定程度的破坏,导致NPQ数值下降幅度较大;但与对照相比,海藻提取物处理NPQ的下降幅度小于对照,表明虽然叶片组织产生了破坏但仍能对光合系统起到保护作用。
ETR是反映实际光强条件下的植物表观电子传递效率,其值下降意味着从QA到QB的电子传递受阻,温度越低,ETR下降越大。表3结果表明,低温胁迫下海藻提取物处理ETR均显著大于对照(p< 0.01)。相对于正常温度下(25℃),低温胁迫20 d和40 d海藻提取物ETR降幅分别为4.10和9.54,而对照下降幅度则分别为7.82和16.48,海藻提取物ETR下降幅度显著小于对照(清水)。表明低温胁迫后茶树叶片的表观电子传递效率受到抑制,而海藻提取液能较大程度上缓解表观电子传递效率的下降,从而促进光合作用的进行。
2.4 抗氧化酶活性
海藻提取物能够显著提高茶苗叶片CAT、SOD和POD酶活性(表4)。处理20 d时海藻提取物组CAT、SOD、POD酶活性比对照分别提高7.32%、14.87%和17.24%(p< 0.01);处理40 d时海藻提取物组CAT、SOD、POD酶活性比对照分别提高6.33%、16.87%和12.23%(p< 0.01)。结果表明在低温胁迫下海藻提取物能刺激茶苗体内抗氧化酶活性增强,以减少低温胁迫产生的超氧化物自由基的伤害。

表4 低温胁迫下茶叶的抗氧化酶活性Table 4 Antioxidant enzyme activities of tea under low temperature stress
2.5 海藻提取液对茶树基因表达量的影响
低温胁迫过程中,植物主要通过合成渗透调节物质和低温保护蛋白质来增强植株的抗低温能力。图4结果可看出,喷施海藻提取物20 d后茶树叶片β淀粉酶CsBAMs基因家族(CsBAM1、CsBAM3)、冷诱导基因(CsCBF3)、麦芽糖转葡萄糖基酶基因 (CsDPE2)、脂肪酸去饱和酶调控基因(CsFAD2)、MYB/MYC类转录因子(CsICE)、AP2/ER家族转录因子(CsRAV)、棉子糖合成酶基因(CsRS2)、蔗糖转运蛋白基因(CsSUT1)相对丰度与对照没有差异,但在处理40 d后,其相对丰度显著上调(p< 0.01)。同时,海藻提取物组液泡膜单糖转运蛋白基因(CsTMT1)和水通道蛋白基因(CsTIP1:1)的相对丰度在处理20 d和40 d均显著大于对照。而脂肪酸去饱和酶调控基因CsFAD6在海藻提取物处理20 d后基因丰度显著降低(p< 0.01),但随着低温的延长,处理40 d后基因丰度显著上调(p< 0.05)。
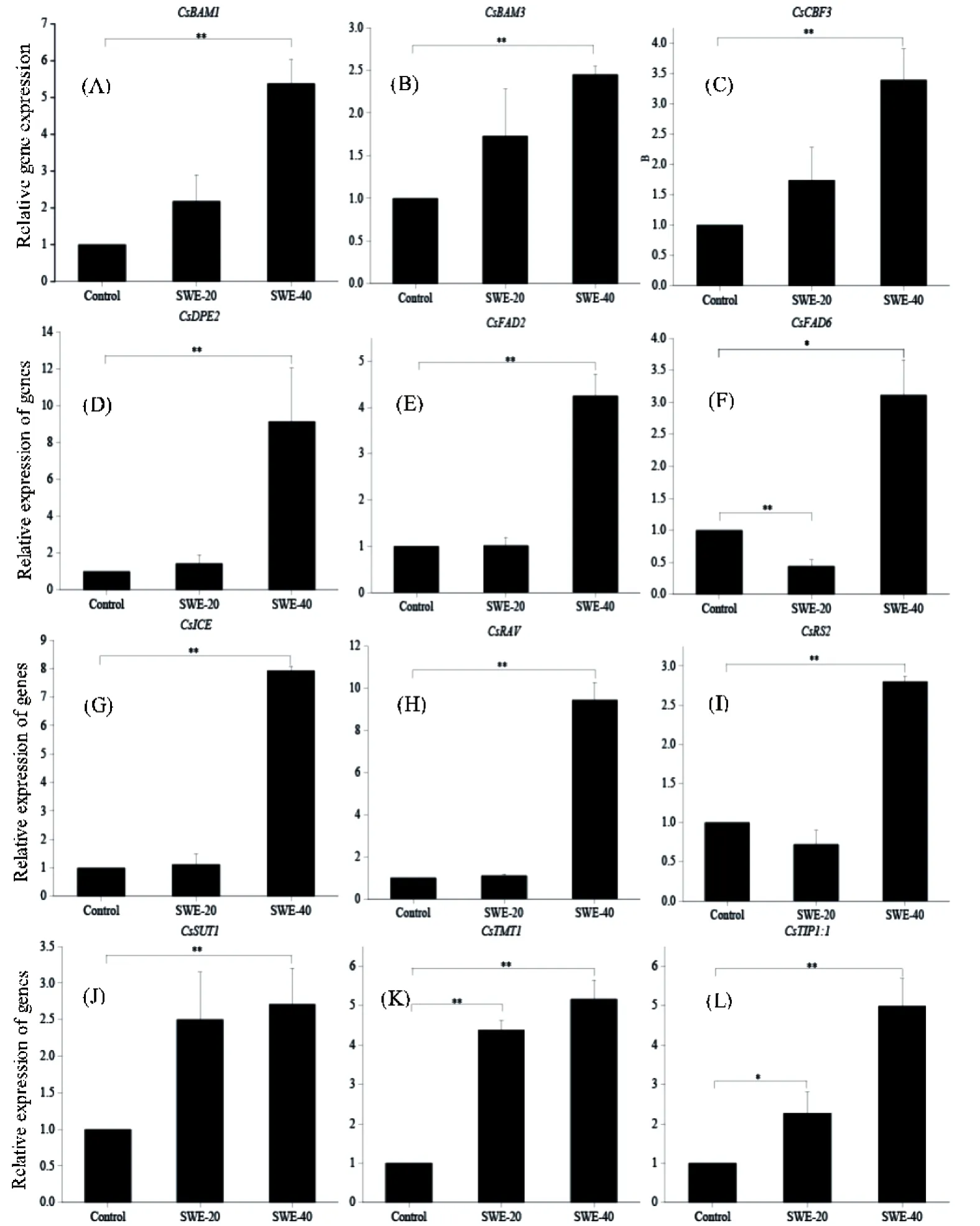
图4 低温胁迫下茶树叶片基因的定量表达Figure 4 Quantitative expression of genes in tea leaves under low-temperature stress
3 讨论与结论
3.1 讨论
本文通过傅里叶红外光谱分析发现海藻提取物中可能存在蛋白质、不饱和脂肪酸、甾体和糖类等物质,这与之前其他海藻物种研究结果相似[29,13]。海藻提取物中的物质对增强植物抗性可以起到积极的促进作用。本试验结果表明,喷施海藻提取液后促进了叶片及叶片的栅栏组织和海绵组织厚度的增加,抗冻指数增强;同时叶片叶绿素降解缓慢[30],叶绿素荧光参数Fv/Fm、qP、NPQ、ETR显著大于对照(表3)。Fv/Fm、qP的增加有利于PSII反应中心开放程度的提高以及天线捕光效率的增加,用于光合电子传递的量子产量增多,使ΦPSII在低温胁迫环境中升高;同时NPQ 和ETR升高不仅增加光能热耗散量,还增强了PSII电子传递活性,从而提高了光能转化学效率,减轻了低温对叶片带来的光抑制破坏。
当植物面临氧化胁迫时,SOD能够迅速地将·O2-转化为H2O2和H2O,紧接着CAT及POD将SOD等催化产生的H2O2和·OH转化成H2O和O2,各种酶之间相互协调减少较多的H2O2和·OH,进而避免植物体受到活性氧(ROS)的伤害[31]。本试验结果显示,在喷施海藻提取物后,叶片中SOD、POD和CAT活性比对照显著升高,且随着处理时间延长升高趋势愈加明显,这与Vyas研究结果相似,表明外源喷施海藻提取物可有效激活低温胁迫下茶树幼苗的酶促防御系统,增强抗氧化酶活性,进而快速清除体内大量的活性氧,减轻膜损伤,最终达到提高茶树抗低温能力,有效提高茶树的抗寒性[3]。
糖代谢与植物的低温胁迫响应密切相关,胞内可溶性糖含量直接影响植物抗寒能力的强弱[32-33]。茶树可通过调控体内淀粉-糖之间的转化以增强对低温胁迫的抵抗能力。β-淀粉酶基因CsBAM1和CsBAM3是一种低温诱导基因,通过水解淀粉提高可溶性糖含量,从而提高植物的抗寒能力。海藻提取物喷施茶树叶片40 d后茶树体内CsBAM1和CsBAM3均被显著地诱导表达,特别是CsBAM1的表达上调5倍以上。低温胁迫下,BAM基因的上调能够促进淀粉水解,提高细胞中麦芽糖含量,麦芽糖含量的升高对低温胁迫下植物光合电子传递链的正常作用具有重要作用,能够维持低温胁迫下光合系统Ⅱ(PSⅡ)的稳定,而本试验海藻提取物处理后的茶树叶片叶绿素荧光参数显著高于对照,减轻了低温对光系统的破坏。此外,麦芽糖转葡萄糖基酶基因CsDPE2在胞质中能够催化α-1,4-D-葡聚糖片段,将麦芽糖转化成葡萄糖,在淀粉水解中也具有重要作用。本试验海藻提取物组的CsDPE2相对表达量提高了9.14倍,表明麦芽糖在低温胁迫中被运出质体,并在DPE2的作用下将麦芽糖转化成葡萄糖,大大提高了胞质中可溶性糖的含量。在可溶性糖中一些多聚糖是植物抗逆响应中重要的渗透调节剂和抗氧化剂,如棉子糖[34-35]。研究显示,棉籽糖在植物冻融过程中能维持光系统 II(PSII)的稳定性,从而缓解低温胁迫对植物造成的严重伤害[36-37]。本试验中海藻提取物处理后茶树叶片棉子糖合成酶基因CsRS2显著上升,这与岳川的研究结果一致[38];在低温胁迫下,可溶性糖在抗寒中的作用与糖转运蛋白的运输作用密切相关[39]。本试验中茶树蔗糖转运蛋白基因CsSUT1在喷施海藻提取物40 d时显著上调,而液泡单糖转运蛋白基因CsTMT1在喷施海藻提取物20 d和40 d时均呈现显著上调。两个糖转运蛋白基因的高表达,有利于促进可溶性糖在叶绿体和液泡中的分配,参与抵御低温[40-42]。
水通道蛋白(aquaporin,AQP)是生物体内广泛存在的一种膜内在蛋白,广泛参与植物的抗逆响应。本试验对CsTIP1∶1进行定量分析发现,随着低温处理时间延长,CsTIP1∶1相对丰度均显著高于对照,处理40 d时海藻提取物处理是对照的5.16倍(p< 0.01)。由于CsTIP1∶1的Ar/R滤器为HIAV,该基因具备转运过氧化氢的功能[43],因此,该基因在叶片中高水平的表达有利于降低过氧化氢积累, 减轻低温胁迫对膜系统的伤害;同时,本试验对不饱和脂肪酸形成的关键因子CsFAD2和 CsFAD6进行分析发现,CsFAD2在海藻提取物处理20 d时与对照无差异,而CsFAD6却显著下调(p<0.01),但在处理40 d后两个基因均显著上调,这种情况的出现有可能是因为在喷施海藻提取物之前茶苗已经进行了低温锻炼,膜酯结构已产生变化,CsFAD2和 CsFAD6活性降低。但随着低温胁迫程度的加重,为了进一步提高抗性,CsFAD2和CsFAD6基因表达量升高。
茶树中存在一些冷诱导基因,例如恢复/脱水反应元件结合因子基因(CsCBF3)。喷洒SWE 40 d后,SWE组CsCBF3的相对表达上调了对照组的3.5倍(p< 0.01,图4C)。拟南芥中CsCBF3的表达显示出对寒冷胁迫的耐受性增强和光合作用得到改善,而在寒冷条件下的损害更少[44]。此外,调节CBF冷诱导(CsICE)的主要调节因子之一显示出与CsCBF3类似的变化(图4G)。可见,低温条件下CsICE的上调表达利于ICE在低温下结合到CBF的启动子序列上诱导CBF的表达,以此来增强植物的抗寒能力[45]。茶树中另外一个与低温胁迫有关的转录因子RAV(Relate to ABI3/VIP1)类转录因子在低温处理后表达量上调,处理12 h表达量达到最大,提高了5.8倍。本试验喷施海藻提取物后CsRAV表达与Chen相似,但CsRAV相对丰度是对照的9.45倍,表明海藻提取物可能会进一步刺激CsRAV的表达[46]。
3.2 结论
海藻提取物可能含有蛋白质、不饱和脂肪酸、甾体和糖类等物质。低温条件下,喷施海藻提取物能促进茶树增加叶片及栅栏组织和海绵组织厚度,抗寒指数增大;叶片中叶绿素降解减缓,叶绿素荧光参数Fv/Fm、qP、NPQ和ETR显著大于对照(清水),减轻低温对叶片带来的光抑制破坏。同时,刺激茶树体内抗氧化酶活性增强,减少低温胁迫产生的伤害。喷施海藻提取物后涉及糖代谢、脂肪酸代谢、转运蛋白以及冷诱导相关基因均显著上调表达。喷施海藻提取液提高了茶树的抗低温能力,减少了低温胁迫对茶树苗的伤害。

