基于网络药理学结合细胞和分子实验探究地榆皂苷Ⅱ抗鼻咽癌的潜在靶点和作用机制*
郭兴喆,白先愚,杨萌哲,成南南,徐 宁,周守常,覃柳洁,黄建春,焦爱军△
(广西医科大学 1.生命科学研究院;2.生物化学与分子生物学教研室;3.药学院,南宁 530021)
鼻咽癌是一种好发于鼻咽侧壁和顶部、在我国南方地区发病率较高的恶性肿瘤之一[1],在全世界范围内,超过半数的鼻咽癌病例都是发生在中国[2]。我国南部地区平均发病率约为3/10 000[3-4]。在鼻咽癌的治疗中,远处转移和局部浸润是治疗难处之所在[5],需要使用放疗化疗相联合的综合治疗策略[6]。现阶段,需研发新的化疗辅助药物,以降低治疗期间的不良反应[7]。
近几年来,国家政策大力扶持中医药事业,但目前多以复方研究为主,因成分复杂,机制较难探索,限制了其临床应用及推广[8]。因此,中药单体的研发无疑为抗肿瘤中药提供了新的出路。大量文献表明,中药单体在抗癌作用上有显著的表现,很大程度上填补了传统中医药复方的短板。郭良芬等[9]的研究显示,采用中药单体治疗鼻咽癌,能显著减轻放化疗的急性毒副反应等不良反应,提高患者生存质量。因此,探寻潜在的抗癌中药,对改善临床疗效和提高患者生存质量具有重大意义。
地榆皂苷Ⅱ是一种三萜皂苷类化合物,化学式为C35H56O8,分子量为604.82,外文名称为Ziyuglycoside Ⅱ,提纯于中药地榆。中药地榆记载于著作《神农本草经》,具有收缩脉管、抗真菌、活血化瘀等作用,在临床上用于烫伤,炎症等疾病的治疗[10]。有文献表明,在乳腺癌细胞MDA-MB-435及胃癌细胞BGC-823中,地榆皂苷Ⅱ可以通过激活线粒体凋亡通路,抑制癌细胞的增殖,促进细胞凋亡,从而达到抗癌目的[11-12]。在MDA-MB-231 和MCF-7 乳腺癌细胞株中,地榆皂苷Ⅱ能通过上调活性氧(ROS),引起细胞周期阻滞,并通过激活JNK及其相关下游凋亡通路,诱导细胞凋亡[13]。以上研究表明,地榆皂苷Ⅱ是良好的抗癌中药单体,但目前在抗鼻咽癌的效果和作用机制上尚未见报道。因此,本研究运用网络药理学的分析方法来预测地榆皂苷Ⅱ对鼻咽癌的潜在靶点及相关通路信息,再通过细胞和分子实验验证,从而为临床研究和应用提供理论依据。
1 材料与方法
1.1 网络药理学分析预测
1.1.1 鼻咽癌靶点筛选
通过Pubchem 数据库(http://pubchem.ncbi.nlm.nih.gov/)搜索关键词“Ziyuglycoside Ⅱ”得到其3D机构,再导入Swisstarget 平台(http://www.swisstargetprediction.ch/),可得到相关预测靶点。再通过GeneCards 数据库(http://www.genecards.org/)搜索关键词“鼻咽癌”,得到其相关靶点。通过韦恩图绘制在线平台(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制鼻咽癌与Ziyuglycoside Ⅱ的靶点交集图。
1.1.2 PPI(protein-protein interaction)的网络可视化构建及分析
通过String数据库(https://string-db.org/)将韦恩图取交集得到的基因数据输入到String 数据库,通过相关绘图软件绘制PPI网络图。
1.1.3 GO功能富集分析和KEGG pathway通路
通过David 数据库(https://david.ncifcrf.gov/)对鼻咽癌与Ziyuglycoside Ⅱ靶点交集进行京都基因与基因组百科全书(Kyotoencyclopedia of genes and genomes,KEGG)通路富集分析和基因本体(gene ontology,GO)功能富集分析,得到相关靶点功能和通路分析。
1.1.4 化合物—靶点—通路网络图
收集地榆皂苷Ⅱ抗鼻咽癌的交集靶点和KEGG通路富集分析结果,并导入Cytoscape 3.7.2 软件构建制作“化合物—疾病—靶点—通路”关系网络图。
1.2 实验验证
1.2.1 CCK-8 法验证地榆皂苷Ⅱ对鼻咽癌细胞增殖的抑制作用
采用CCK-8 法测定地榆皂苷Ⅱ对5-8F 细胞增殖抑制作用,取状态较好处于对数生长期的5-8F细胞,用含0.25%EDTA的胰酶消化,重悬为单细胞悬液,按照5 000/孔的细胞密度接种于96孔培养板中,在5%CO2的恒温培养箱中贴壁12 h,小心地吸出培养液,分别加入含地榆皂苷Ⅱ的培养基100 μL,浓度设为4 umol/L,每组设3 个复孔。在5%CO2的恒温培养箱中分别培养24 h、48 h、72 h 后,吸出含地榆皂苷Ⅱ的培养基,用PBS清洗2遍,按照CCK-8使用说明书,每孔加入100 μL RPMI-1640 培养基和10 μL CCK-8,于5% CO2的恒温培养箱中孵育80 min。用酶标仪检测在450 nm波长下各孔的光密度(A),计算地榆皂苷Ⅱ对细胞的抑制率并绘制细胞抑制率曲线。实验重复3次。
细胞生存率=(A 地榆皂苷Ⅱ-A 空白)/(A 对照-A 空白)
1.2.2 Western blotting检测蛋白表达
取处于对数生长期的5-8F细胞,将细胞密度调整为5×105/mL 接种于6 孔板,体积为每孔1.5 mL,置于培养箱内培养24 h,4 umol/L 浓度药物处理细胞结束后,收集各组细胞,用PBS 缓冲液清洗3 次,再加入细胞裂解液裂解细胞30 min,之后用超声粉碎细胞;再将细胞液放置于低温离心机离心15 min,转移上清液于新的EP 管中,并用BCA 蛋白试剂盒测定具体蛋白浓度。一定量的蛋白样品与上样缓冲液按比例混合后煮沸5 min,SDS-PAGE电泳150 V恒压70 min,WB湿转(0.45 μm的PVDF膜)270 mA恒流65 h,5%脱脂奶粉室温封闭1 h,TBST漂洗3次后分别加入相应一抗(1∶1 000)4 ℃孵育过夜,TBST漂洗3 次,室温二抗(1∶5 000)反应1 h。用凝胶成像分析系统分析电泳条带,内参作为对照,计算各处理组目的蛋白的相对表达情况。
1.3 统计学方法
采用SPSS 22.0 统计软件进行数据分析,计量资料以均数±标准差()表示,两样本均数比较采用t检验,多组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学机制预测
2.1.1 地榆皂苷Ⅱ潜在靶点预测
通过PubChem分子库获得地榆皂苷Ⅱ的3D结构,见图1。将3D 结构导入至Swisstarget 平台中筛得地榆皂苷Ⅱ靶点,按照Probability排序,选取前10个基因名称和靶点,见表1。
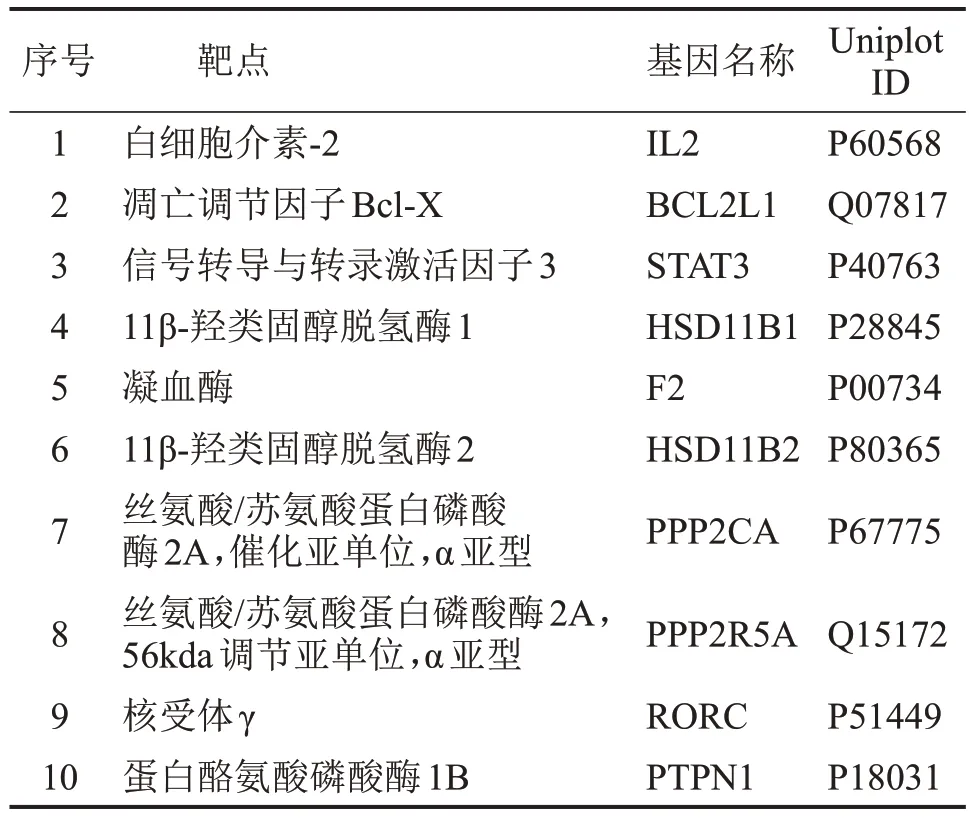
表1 地榆皂苷Ⅱ排名前10的潜在靶点

图1 地榆皂苷Ⅱ的3D结构
2.1.2 地榆皂苷Ⅱ与鼻咽癌相关的共同靶点
从GeneCards数据库中获得与鼻咽癌相关的基因靶点共有1 942个。100个药物靶点基因与1 942个鼻咽癌相关基因筛选出共同交集靶点基因38个,为地榆皂苷Ⅱ抗鼻咽癌的潜在靶点基因,见图2。

图2 地榆皂苷Ⅱ抗鼻咽癌的潜在靶点
2.1.3 地榆皂苷Ⅱ与鼻咽癌相关靶点的PPI网络
PPI网络为复杂疾病构建多种蛋白质的多因素功能的可视化图,因此,构建了地榆皂苷Ⅱ与鼻咽癌相关靶点的PPI 网络图。将38 个交集靶点导入STRING 数据库,获得地榆皂苷Ⅱ-鼻咽癌靶点PPI网络图,见图3。

图3 地榆皂苷Ⅱ抗鼻咽癌PPI网络图
2.1.4 GO功能富集注释
将疾病和药物交集的38 个共同靶点通过DAVID数据库进行GO功能富集分析,根据P≤0.01,共筛选出233 个GO 条目。按照P值升序排列结果前10条显著富集的条目,见图4。结果表明,涉及内肽酶活性、相同蛋白质结合等分子功能;涉及多项生物调控机制,包括凋亡过程的负调控、蛋白质水解、RNA聚合酶Ⅱ启动子转录的正调控、内皮细胞增殖的正调控等生物过程;涉及核质、细胞质、线粒体等细胞组成。推测地榆皂苷Ⅱ治疗鼻咽癌可能与内肽酶活性、激酶活性、金属内肽酶活性、RNA聚合酶Ⅱ启动子转录的正调控、蛋白质磷酸化的正调控等生物过程。

图4 地榆皂苷Ⅱ抗鼻咽癌GO功能富集分析
2.1.5 KEGG通路富集分析
通过DAVID数据库进行KEGG通路富集分析,共富集得到77条通路。根据P值排序,筛选出与鼻咽癌相关度最高的前19 条通路,见表2。富集结果显示在癌症信号通路(Pathways in cancer)、PI3KAkt 信号通路(PI3K-Akt signaling pathway)等通路上富集较多。
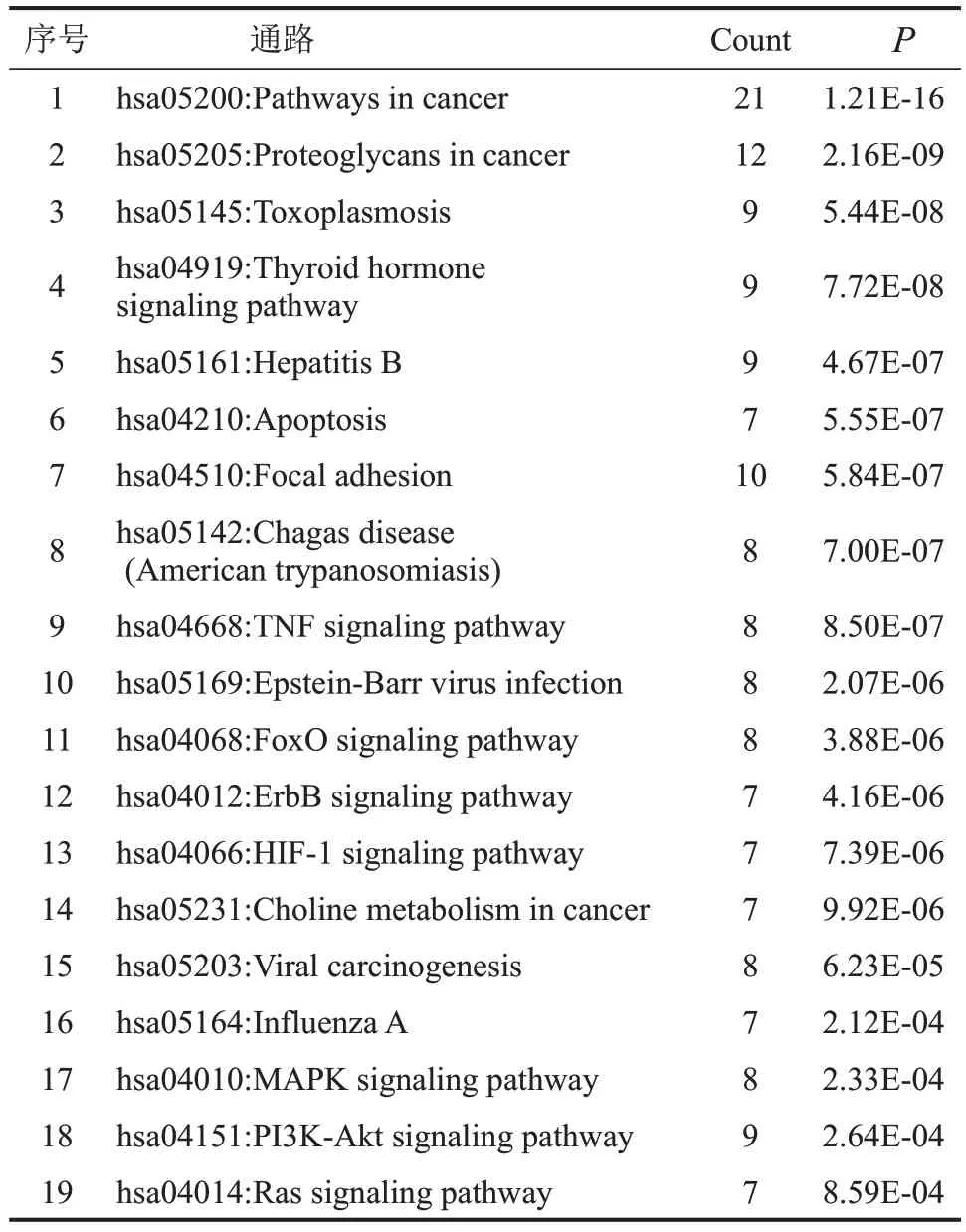
表2 地榆皂苷Ⅱ抗鼻咽癌KEGG富集结果
2.1.6 构建地榆皂苷Ⅱ抗鼻咽癌的“药物—靶点—疾病—通路”网络模型
通过构建“药物—靶点—疾病—通路”网络模型图,可直观展示地榆皂苷Ⅱ与鼻咽癌交集靶点及通路之间的相互作用关系及关联程度,见图5。图中左侧38 个黄色节点代表地榆皂苷Ⅱ抗鼻咽癌交集的靶点,根据节点的度值按顺时针从大到小的梯度进行排列,右侧19个绿色节点则对应了KEGG富集结果中的19条通路,节点间的连线显示了通路和靶点间的相互作用关系,涉及的关键基因包括:AKT1、AKT2、MAPK10、PRKCA、GRB2、JUN、STAT3、MAPK14等。

图5 “药物—靶点—疾病—通路”网络图
2.2 实验验证
2.2.1 CCK8细胞毒性实验
结果如图6所示,与对照组相比较,随着地榆皂苷Ⅱ浓度的升高及作用时间的延长,其对5-8F细胞增殖抑制率明显升高,作用时长为24 h、48 h、72 h的半抑制浓度(IC50)分别为34.47 μmol/L、33.68 μmol/L、19.89 μmol/L。

图6 地榆皂苷Ⅱ对鼻咽癌5-8F细胞增殖的影响
2.2.2 Western blotting 实验检测地榆皂苷Ⅱ对PI3K和AKT蛋白表达的影响
Western blotting 实验检测结果显示,与对照组相比较,100 μmol/L 地榆皂苷Ⅱ实验组的AKT 和PI3K蛋白表达量显著低于空白对照组(P<0.01),见图7。
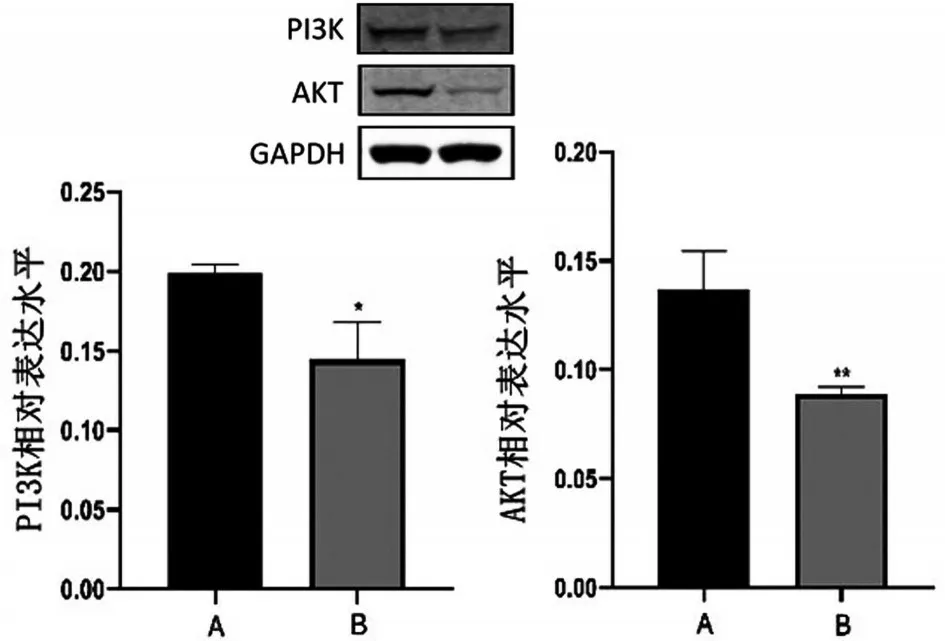
图7 地榆皂苷Ⅱ对5-8F细胞PI3K/AKT信号通路蛋白的影响
3 讨论
鼻咽癌是一种起病隐逸、前期症状不明显、较难诊断和确诊的疾病,虽然放疗能大大提高患者生存率,但其带来的副反应也深深地折磨着患者,临床数据显示,多数患者在化疗后出现口舌干燥、口腔溃疡、吞咽困难、脑脊髓损伤等诸多副反应[14]。因此,这些治疗方式具有一定的局限性。
基于中药单体在肿瘤治疗中突出的疗效,近些年来对于中药单体治疗肿瘤的研究显著增加[15],寻找能有效治疗肿瘤的中药单体,成为目前的研究热点和未来的发展方向。王振龙等[16]相关研究表示,中药单体地榆皂苷Ⅱ可激活细胞凋亡途径来抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡,吴泽承等[17]也通过相关实验验证了地榆皂苷Ⅱ可有效抑制人舌鳞癌细胞CAL27细胞株的增殖。
本研究分析了地榆皂苷Ⅱ“药物—靶点—疾病—通路”网络模型,结果显示,AKT1、AKT2、MAPK10、PRKCA、GRB2 等度值较高,是地榆皂苷Ⅱ治疗鼻咽癌的关键潜在靶点基因。再结合KEGG通路富集分析,结果显示,在相关信号通路中,PI3KAKT 信号通路是地榆皂苷Ⅱ作用于鼻咽癌度值最高的关键通路。在PI3K-AKT 途径当中,PIP3 的3位磷酸基团可同时招募AKT 和PDK1 蛋白到细胞膜上,使PDK1 蛋白将AKT 蛋白上308 号位的苏氨酸(T308)磷酸化,致使AKT 蛋白部分活化,从而被活化的AKT 进一步调控激活下游通路。郭金兰等[18]的研究表明,miR-17-5p 可通过下调PIK3R1 基因从而靶向激活PI3K/AKT信号通路抑制皮肤鳞状细胞癌细胞凋亡,促进细胞增殖,说明PI3K/AKT信号通路对癌细胞的增殖和凋亡有重要影响;朱文洁等[19]的研究则表明MiR-1268b 可以靶向下调ERBB2-PI3K-Akt 通路从而抑制乳腺癌化疗的耐药性,从另一个角度证实了可通过下调PI3K/AKT 信号通路相关关键蛋白的表达,达到干预癌细胞的增殖,促进癌细胞凋亡;而朱振华等[20]则发现KIF20A与细胞周期、凋亡等功能密切相关,通过在脑胶质瘤中下调KIF20A高表达后,PI3K/AKT信号通路被明显抑制,从而引起细胞周期阻滞和细胞凋亡。
本研究通过网络药理学预测结合细胞实验、分子实验等对地榆皂苷Ⅱ治疗鼻咽癌进行了多维度多层次的研究和比较分析,预测了地榆皂苷Ⅱ对鼻咽癌的作用通路并验证了其作用机制,本研究为未来鼻咽癌的临床治疗及实验研究提供了参考依据。

