解淀粉芽孢杆菌YP6中碱性磷酸酯酶AP2的生物信息学分析及酶学性质
孟迪,江威,郝之奎,廖祥儒*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.商丘师范学院 生物与食品学院,河南 商丘 476000;3.台州职业技术学院 应用生物技术研究所,浙江 台州 318000)
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是第一批通过美国食品和药物管理局安全认证的菌株,也是国内微生物肥料使用的免检菌株[1]。解淀粉芽孢杆菌属革兰阳性芽孢杆菌,具有抗逆性强,能够分泌功能多样的代谢产物,如淀粉酶、蛋白酶、磷酸酯酶、脂肽类抗菌物质以及一些具有免疫、抗氧化作用的活性物质等,广泛地应用于农业、食品、环境、医药等领域[2-4]。
碱性磷酸酯酶属于水解酶类,能够催化含磷酯键的化合物水解,同时释放出磷酸基团及相应的配基。此外,碱性磷酸酯酶也是一种非特异性酶,广泛存在于几乎所有的生物体内[5]。目前已知的原核生物碱性磷酸酯酶可分为3个家族,即PhoA家族、PhoD家族和PhoX家族,其中海洋和土壤细菌中含有的PhoD酶比另外两类酶更为丰富[6],尽管如此,PhoD家族的酶却是这3大家族中表征最不清晰的。PhoD家族的典型代表是来源于枯草芽孢杆菌(Bacillus subtilis)的PhoD酶,而且该酶在Ca2+存在的条件下才具有活性[7];另外一种已表征的PhoD家族成员是来源于枯草芽孢杆菌新型PhoD酶,该酶结构中含有与1个Fe3+和2个Ca2+结合的活性位点[8];第3种已表征的PhoD酶是来源于褐色链霉菌(Streptomyces chromofuscus)的分泌磷脂酶D,该酶不仅包含有1个铁原子和亚化学计量的锰,它还需要Ca2+激活[9]。此外,PhoD酶是独立于PhoA或PhoX家族的酶,该酶与真核紫色酸性磷酸酶(其金属离子结合的活性位点:1个Fe3+和1个二价金属离子,如 Fe2+、Mn2+或 Zn2+)有较高的相似性[8]。碱性磷酸酯酶尤其是PhoD家族的酶因其具有普遍存在性,使其成为一种很好的生物标记,广泛地应用在农业[10-11]、环境[11]、食品[12]、医药[6]等领域;另外,越来越多的PhoD酶作为特异性转运系统辅助生产β-半乳糖苷酶[13]、植酸酶[14]等;因此发掘新的PhoD酶不仅有助于扩充PhoD家族成员,而且为进一步研究其生物学功能提供参考。
本研究前期筛选出的菌株解淀粉芽孢杆菌YP6不仅具有促进植物生长的能力[15-16],还能够高效降解多种有机磷农药[17-18];而且已完成该菌株的全基因组测序,获得的GenBank登录号为CP032146[15]。通过分析该菌的全基因组发现,该菌基因组中仅含有3个注释为碱性磷酸酯酶的基因,分别编码属于Flg和原噬菌体、PhoD和PhoA家族的酶(分别命名为AP1、AP2和AP3)。前期已对AP3的生物学功能进行了详细的研究[17]。尽管AP1被注释为碱性磷酸酯酶,但该酶主要作用于鞭毛特异性肽聚糖的水解和前噬菌体尾部的形成。因此,本研究仅对编码AP2的基因进行生物信息学分析,以其为模板进行克隆表达和酶学性质的研究,为AP2的功能研究以及进一步地开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
解淀粉芽孢杆菌YP6:江南大学生物催化与转化生物学实验室筛选并保藏于中国典型培养物保藏中心(保藏号:CCTCC NO:M 2018875);大肠杆菌(Escherichia coli)JM109 感受态细胞、大肠杆菌 BL21(DE3)感受态细胞:江南大学生物催化与转化生物学实验室保藏;氨苄青霉素钠(ampicillin,AMP)、异丙基硫代-β-D-半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG)、细菌基因组提取试剂盒、DNA纯化试剂盒、质粒提取试剂盒、胶回收试剂盒:上海生工生物工程有限公司;聚合酶链式反应(polymerase chain reaction,PCR)反应试剂盒、表达载体pColdII、T4 DNA连接酶、限制性内切酶(EcoR I和Sal I)和磷酸苯二钠(disodium phenyl phosphate,DPP):宝生物工程(大连)有限公司;对硝基磷酸苯二钠(p-Nitrophenyl phosphate,pNPP):美国Sigma公司;以上试剂均为分析纯。
1.2 仪器与设备
2720型PCR仪:美国应用生物系统公司;TGL-16M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;JY92-IIN高压细胞破碎仪:宁波新芝生物科技有限公司;DYY-8C电泳仪:北京六一仪器厂;Smart View Pro 1100凝胶成像仪:美国Major Science公司;AKTA avant蛋白纯化系统:美国通用公司;U-3310紫外分光光度计:日本日立公司;Synergy H4多功能酶标仪:美国伯腾仪器有限公司;HH-6数显恒温水浴锅:常州中诚仪器制造有限公司;IS129FD-V1 pH计:上海仪迈仪器科技有限公司。
1.3 试验方法
1.3.1 培养基
LB培养基:蛋白胨 10.0 g/L,酵母粉5.0 g/L,NaCl 10.0 g/L,pH 7.0~7.2。
含氨苄的LB培养基:Amp终浓度为100 mg/L。
配制以上固体培养基需额外添加2%的琼脂。上述培养基均在121℃灭菌20 min。
1.3.2 生物信息学分析
1.3.2.1 AP2编码基因序列分析
使用 ORF finder(http://www.ncbi.nlm.nih.gov/orffinder/)分析编码AP2的基因序列信息。
1.3.2.2 一级结构和二级结构预测
一级结构及理化性质预测使用在线服务器Ex-PASyProtParam Server(http://web.expasy.org/protparam/);二级结构预测使用NPS@在线服务器(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_go r4.html);蛋白信号肽使用 SignalP(http://www.cbs.dtu.dk/services/SignalP/)在线预测。
1.3.2.3 多序列比对分析
使用 NCBI数据库(http://www.blast.ncbi.nlm.nih.gov/)对AP2的氨基酸序列进行比对,下载部分相似性高的序列,然后通过软件CLUSTALW进行多序列比对,并将比对结果用在线服务器ESPript(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)着色。所用分析序列均来自GenBank数据库(除AP2外)。
1.3.2.4 保守结构域分析
使用NCBI上的Conserved Domain Search Service,CD Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对蛋白保守结构域进行查询。
1.3.2.5 建树分析
使用软件MEGA6.0构建系统进化树。
1.3.3 目的基因的克隆表达与蛋白纯化
1.3.3.1 AP2编码基因引物设计
本研究以解淀粉芽孢杆菌YP6全基因组中编码AP2编码的基因序列为模板来设计引物:AP2-F(5′-CCGGAATTCATGACACATGACGGCCGTT-3′)和 AP2-R(5′-ACGCGTCGACTTATTGTGAGATTTTGGCC CGTTTC-3′),由苏州金唯智生物科技有限公司合成;其中引物下划线部分分别对应EcoR I和Sal I酶切位点。
1.3.3.2 目标基因的克隆表达及蛋白纯化
参照张言周[19]研究中的克隆表达及蛋白纯化方法进行操作。
目标基因的克隆表达:用于基因克隆的宿主菌为E.coli JM109,诱导表达的宿主菌为 E.coli BL21(DE3);诱导表达的对照为空载BL21-pColdⅡ(Bp);粗酶液使用对硝基苯基磷酸二钠(p-nitrophenolphosphate,pNPP)比色法[20]进行酶活检测,并用12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)进行验证。
蛋白纯化:亲和层析镍柱选用5 mLHisTrap HP,结合液为0.5 mol/L NaCl和含5 mmol/L咪唑的Na2HPO4-NaH2PO4溶液;洗脱液与结合液类似,但将咪唑的浓度变为含500 mmol/L咪唑的Na2HPO4-NaH2PO4溶液。
蛋白脱盐:收集的洗脱液经脱盐柱(5 mL HiTrap TM)脱盐,缓冲液为20 mmol/L Na2HPO4-NaH2PO4溶液。
重悬菌体,配制结合液、洗脱液以及脱盐过程所用的缓冲液均为20 mmol/L Na2HPO4-NaH2PO4溶液,pH7.4。
1.3.3.3 酶学性质分析
从pH值、温度、稳定性、金属离子及抑制剂等方面对AP2的酶学性质进行研究,此外,还对其Km和kcat值进行测定。具体操作如下:30℃条件下,测定不同pH值(3.0~12.0)对酶活性的影响,其中相对酶活以最大酶活的百分比表示。将反应液于4℃~80℃下,测定不同温度对酶活的影响,并计算相对酶活。将酶液分别置于不同pH值和温度下1 h,测定重组酶在最适温度和pH值条件下的稳定性,其中初始酶活设置为100%。选取 10 种金属离子 Ca2+、Mg2+、Mn2+、Ba2+、Cu2+、Zn2+、Fe2+、Co2+、Fe3+和 Ni2+,在最适条件下测定酶活力,以不添加金属离子为对照,计算相对酶活。选取4种常见物质(EDTA-2Na、L-丝氨酸、L-组氨酸和L-半胱氨酸)在最适条件下测定酶活力,以不添加上述物质为对照,计算相对酶活。上述试验均以pNPP为底物。此外,在最适温度和pH值下,酶液与不同浓度的底物(pNPP和DPP)反应,采用Linewear-Burk双倒数作图法,分别求出AP2水解pNPP和DPP的动力学常数Km和kcat。
2 结果与分析
2.1 编码AP2酶的基因序列分析
最大开放阅读框(open reading frame,ORF)分析结果显示AP2酶的编码基因大小为1 752 bp,且以ATG为起始密码子,TAA为终止密码子。该序列已提交至NCBI数据库,GenBank登录号为KY403890.1。
2.2 AP2氨基酸序列系统发育树
使用MEGA6.0对AP2与其它来源的碱性磷酸酯酶的氨基酸序列构建系统发育树,结果见图1。
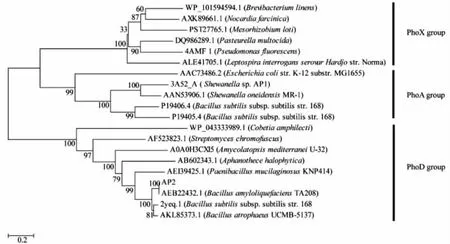
图1 AP2氨基酸序列的系统发育树Fig.1 Phylogenetic trees of the amino acid sequence of AP2
由图1可知,AP2聚类到碱性磷酸酯酶PhoD家族,且与解淀粉芽孢杆菌来源的碱性磷酸酯酶(登录号:AEB22432.1)序列相似度最高。
2.3 AP2蛋白一级结构的预测
AP2蛋白一级结构在线预测结果如表1所示。由表1可知,AP2的pI值为8.62,属碱性蛋白,且蛋白结构较稳定、亲水性高。

表1 AP2蛋白一级结构预测统计Table 1 Prediction and statistics of primary and secondary structure of AP2
2.4 AP2蛋白二级结构的预测
AP2蛋白二级结构在线预测结果如表2所示。

表2 AP2蛋白二级结构预测统计Table 2 Prediction and statistics of secondary structure of AP2
由表2可知,AP2蛋白二级结构中只含有α-螺旋(36.88%)、β-折叠(15.95%)和无规则卷曲(47.17%)。此外,利用在线分析工具Signal IP5.0对AP2蛋白序列的信号肽进行了预测,结果如图2所示。
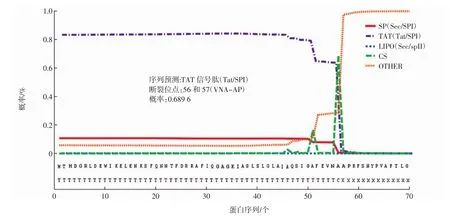
图2 AP2蛋白的信号肽预测结果Fig.2 Signal peptide prediction of AP2
由图2可知,AP2蛋白二级结构中存在Tat/SPI信号肽,且信号肽的剪切位点位于第56和57号氨基酸(VNA-AP)之间。
2.5 AP2保守结构域分析和多序列比对
AP2蛋白氨基酸序列的保守结构域查询结果如图3所示。

图3 AP2与其它来源的PhoD酶氨基酸序列比对分析Fig.3 Amino acid sequence alignment of AP2 and other PhoDs
由图3可知,AP2蛋白序列中只含有碱性磷酸酯酶PhoD超家族(位于22位~540位氨基酸残基),该结果与图1进化树中显示的结果一致。进一步将AP2与两种已表征的PhoD酶 [分别为来源于Bacillus subtilis subsp.subtilis str.168和色褐链霉菌(Streptomyces chromofuscus)]的氨基酸序列进行比对(图 3b),发现AP2中含有与Bacillus subtilis subsp.subtilis str.168来源的PhoD酶(PDB:2yeq.1)完全一致的金属离子结合位点;而与色褐链霉菌来源的PhoD酶(AF523823.1)相比,除AP2中272位与CaB结合的氨基酸残基不同外,其余的金属结合位点均相同。
2.6 编码AP2基因的分子克隆及异源表达
将编码AP2蛋白的基因ap2连接到载体pColdII上,得到的重组质粒pColdII-ap2。将重组质粒pColdII-ap2转化E.coli JM109感受态细胞,之后挑取阳性克隆进行培养、质粒抽提以及双酶切验证,双酶切结果如图4所示。将验证正确的重组质粒pColdII-ap2转化E.coli BL21(DE3)感受态细胞,然后挑取阳性转化子进行单菌落PCR验证,结果见图5。

图4 重组质粒pColdII-ap2双酶切结果Fig.4 Double digestion results of recombinant plasmid pColdII-ap2
图5 重组菌E.coli BL21(DE3)-pColdII-ap2的菌落PCR鉴定结果Fig.5 Results of PCR identification of recombinant E.coli BL21(DE3)-pColdII-ap2
由图4、图5可知,进一步序列测定表明序列正确,表明 E.coli BL21(DE3)-pColdII-ap2 构建成功。
对重组菌 E.coli BL21(DE3)-pColdII-ap2 诱导表达获得的粗酶液、纯化脱盐后的纯酶液进行SDSPAGE电泳检测,结果如图6所示。

图6 重组蛋白AP2的SDS-PAGE分析Fig.6 SDS-PAGE analysis of recombinant AP2
由图6可知,重组酶成功表达,而且重组AP2的蛋白质大小与推定的分子量大小(66 kDa)相当。
2.7 AP2蛋白的酶学性质研究
对AP2在不同温度、pH值、金属离子以及抑制剂下的酶活进行了测定,结果如图7所示。
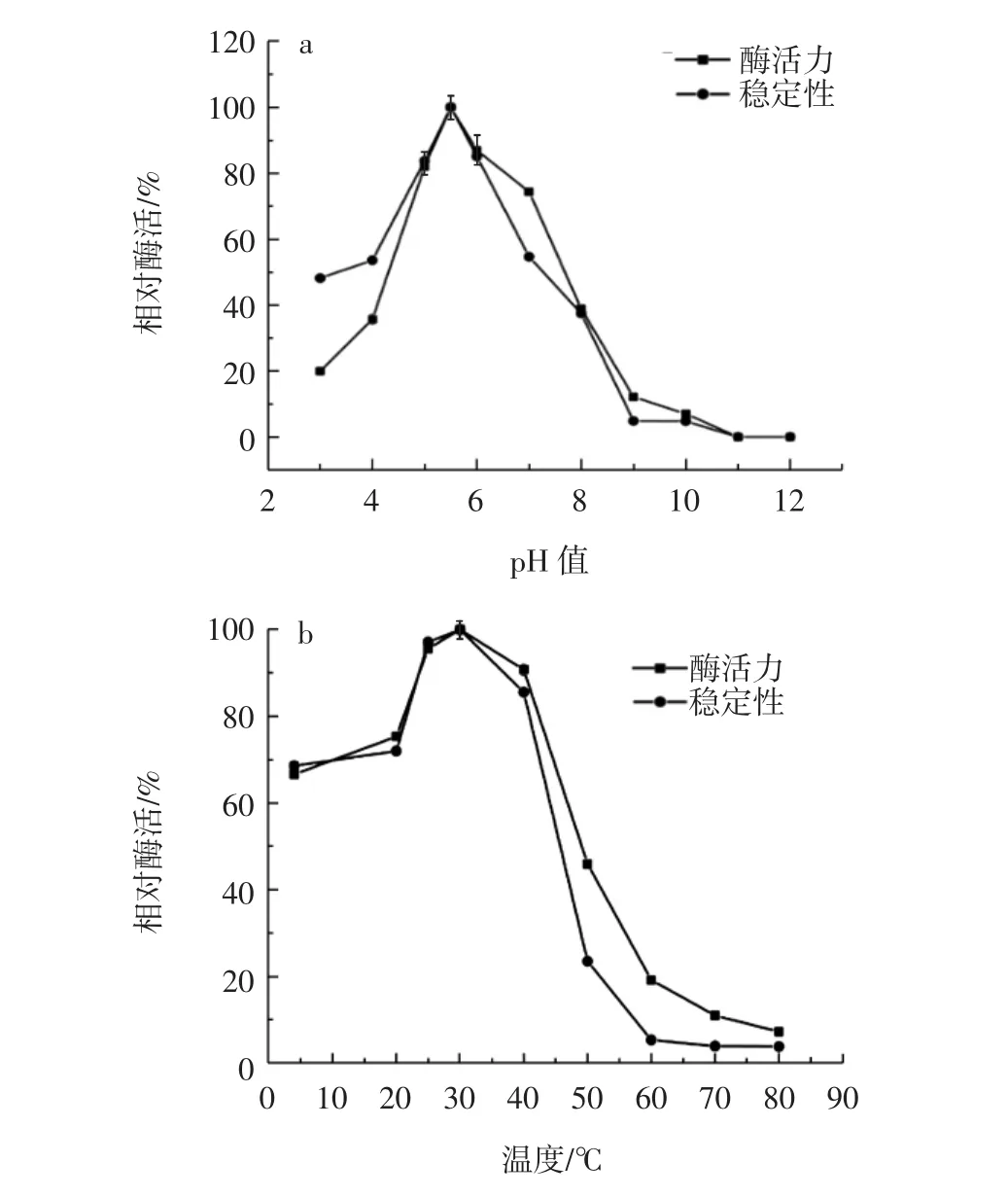

图7 pH值、温度、金属离子以及抑制剂对重组酶AP2活性的影响Fig.7 Effects of pH,temperature,metal irons and inhibitors on the activity of recombinant AP2
由图7a可知,AP2的最适pH值为5.5,而且在pH 4.0~7.0范围内具有50%以上的酶活。由图7b可知,AP2的最适反应温度为30℃;在低温下,AP2保持着较高的酶活;而当温度高于40℃,其酶活性急剧下降;当温度在70℃~80℃的条件下,AP2的酶活几乎检测不到。由图 7c可知,在金属离子浓度(0.1、0.5、1.0、2.0、5.0、10.0 mmol/L) 变化过程中,Mn2+、Ba2+和 Co2+始终对AP2有激活作用,Mg2+对AP2有激活作用不明显,Fe2+和Fe3+始终对AP2有抑制作用,其它金属离子(Ca2+、Cu2+、Zn2+、Ni2+)在浓度变化过程中对AP2既有激活作用也有抑制作用。由图7d可知,不同浓度(0.1、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 mmol/L) 的 EDTA-2Na、L-组氨酸、L-丝氨酸和L-半胱氨酸均能抑制AP2的活性,其中EDTA-2Na和L-半胱氨酸的抑制作用更为显著。分别测定了AP2对底物DPP和pNPP的动力学常数,结果见表3。
由表3可知,AP2对底物DPP的动力学常数(kcat和kcat/Km)分别为4.0×105s和1.1×105L/(mmol·s),分别高于其对底物 pNPP 的 kcat值(2.3×105s)和 kcat/Km值[8.8×102L/(mmol·s)];而 AP2 对底物 DPP 的 Km值(3.8mmol/L)低于其对底物pNPP的Km值(260.4 mmol/L),表明AP2对底物DPP的催化效率和亲和性均高于对底物pNPP。

表3 AP2蛋白的酶促动力学参数Table 3 The kinetic parameters of recombinant AP2
3 讨论与结论
以解淀粉芽孢杆菌YP6基因组中编码PhoD酶(AP2)的基因(KY403890.1)为模板,对其进行生物信息学分析、异源表达和酶学性质的研究。发现AP2是一种结构稳定、亲水性高、有信号肽且属于PhoD家族的酶;重组AP2酶的最适反应温度和pH值分别为30℃和5.5;AP2的活性受金属离子和抑制剂的影响较大,其中 Mn2+、Ba2+和 Co2+对 AP2 有激活作用,而Fe2+、Fe3+、EDTA-2Na、L-组氨酸、L-丝氨酸和 L-半胱氨酸对AP2有抑制作用;AP2对底物DPP的催化效率和亲和性均高于其对底物pNPP的催化效率和亲和性。
PhoD酶是一类重要的碱性磷酸酯酶[6]。通过对AP2氨基酸序列的生物信息学分析,发现AP2聚类到碱性磷酸酯酶的PhoD家族,并且具有PhoD家族功能结构域以及与已表征的PhoD酶相同或相似的金属离子结合位点。然而与其它碱性磷酸酯酶(包括已报道的PhoD酶)的最适pH(8.0~10.3)相比,AP2的最适pH为5.5;研究表明,PhoD酶与真核紫色酸性磷酸酶最相似[8],因此,可推测AP2与其它的已报道的PhoD酶不同,与它们相比,AP2的生物学活性更接近于真核紫色酸性磷酸酶。
通常很多酶需要金属离子来维持或提高自身稳定性,或者通过金属离子与除活性位点外的其它氨基酸附着点相结合来提高自身的活力[21],因此外源金属离子的添加会在一定程度上激活或抑制酶的活性。PhoD家族是一类金属依赖型碱性磷酸酯酶[8]。通过对AP2与已表征的PhoD酶的多序列比对,发现这类酶需要铁离子和钙离子配合活性中心,然而金属离子对酶活性影响的实验中却发现在金属离子浓度变化的过程中,Fe2+和Fe3+始终对AP2有抑制作用,Ca2+在浓度变化过程中对AP2既有激活作用也有抑制作用。

