PPAR-γ在三硝基苯磺酸诱导的肠纤维化模型小鼠结肠中的动态表达特点
成家飞,徐 艺,顾培青,朱 磊,曹婷婷,张 露,李 萍,孙 心,冯 皖,沈 洪
(南京中医药大学附属医院,江苏 南京 210000)
肠纤维化是炎症性肠病的严重并发症之一,超过40%的克罗恩病患者和约5%的溃疡性结肠炎患者会发生肠纤维化[1]。目前,相对于炎症性肠病肠道炎症方面研究的突飞猛进,抗炎治疗取得的长足进步,抗肠纤维化治疗进展缓慢。中医认为炎症性肠病多因湿热之邪壅滞肠道,与气血相搏结,肠络受损,气凝血滞,血瘀阻络,发为腹泻、腹痛,甚至肠瘘,其病机关键是湿热瘀阻。从病情发展看,多经历“由实而虚”“由气入血及络”的动态变化。炎症性肠病肠纤维化的基本病理改变是细胞外基质(ECM)尤其是胶原的过度沉积,与络病学说中湿热阻络类似,故可将其归属中医“络病”范畴。中医药已成为治疗炎症性肠病的重要方法之一,对防治炎症性肠病肠纤维化有独特的优势,但其作用靶点尚不十分清楚。过氧化物酶体增殖物激活受体(PPARs)系配体激活的核转录因子超家族的一员,在脂类代谢、免疫调节及炎症反应等过程中起着十分重要的作用[2]。PPAR-γ是PPARs亚型之一,在许多器官中具有抗炎和抗纤维化作用[3-4],但是其在肠纤维化中的确切作用尚不清楚,在肠纤维化进程中的动态变化亦没有报道。故本研究采用三硝基苯磺酸(TNBS)建立小鼠肠纤维化模型,观察PPAR-γ在肠纤维化过程中的动态变化,并分析其与胶原表达的相关性,为阐明PPAR-γ在肠纤维化中的作用以及中医药干预炎症性肠病肠纤维化的靶点提供一些实验依据。
1 实验材料与方法
1.1实验动物 雄性BALB/c小鼠90只,SPF级,体重20~24 g,动物合格证编号:SCXK(沪)2017-0005。饲养环境:温度20~26 ℃,相对湿度为40%~70%。
1.2试剂 5%TNBS(Sigma公司),HE染液套装(Servicebio公司),Masson染液套装(Servicebio公司),Ⅰ型胶原α2(COL1A2)抗体(Abcam公司),PPAR-γ抗体(正能生物公司),RNA引物(上海擎熙生物科技有限公司)。
1.3仪器与设备 荧光定量PCR仪(ABI,7300),正置荧光显微镜(OLYMPUS,BX51),电泳仪(Bio-rad, Basic), 全自动化学发光图像分析系统(天能,Tanon-4600SF),台式高速冷冻型微量离心机(DragonLab,D3024R),超微量分光光度计(Thermo,NanoDrop2000)。
1.4实验方法 将90只BALB/c小鼠随机分为对照组和造模1周组、造模2周组、造模3周组、造模4周组、造模5周组、造模6周组、造模7周组、造模8周组,每组10只。造模各组小鼠参考Lawrance等[5]的研究进行造模:禁食,异氟烷麻醉,从肛门插入医用聚乙烯管至距肛缘3 cm,每周1次灌入不同剂量的TNBS乙醇溶液(第1周和第2周均为0.5 mg,第3周和第4周均为0.75 mg,第5周和第6周均为1.0 mg),保持肛门高位3 min,保证TNBS乙醇溶液不会立刻从肛门流出。对照组小鼠给予等体积的0.9%氯化钠溶液灌肠,其余过程均相同。
1.5检测指标及方法
1.5.1结肠长度及重量 对照组于灌肠8周、造模各组于造模相应时间点,采用10%水合氯醛腹腔注射麻醉小鼠后处死,取肛门至回盲的肠段,测量长度并称重。
1.5.2结肠组织学形态 取各组小鼠结肠病变明显处肠管,4%多聚甲醛固定,常规石蜡包埋,用于HE染色、Masson染色,电子显微镜下观察结肠组织学形态。
1.5.3总胶原含量 采用化学比色法检测:取液氮冷冻的结肠组织约30 mg,加入300 μL的胃蛋白酶冰醋酸溶液,4 ℃孵育过夜;3 000×g离心10 min后取上清液100 μL;加入1 mL Sircol染料,获得胶原-染料复合物;13 000×g离心10 min;加入750 μL洗涤液;13 000×g离心10 min;加入染料释放剂,将复合物中的染料释放出来;取200 μL样品,用分光光度计测定在556 nm处的吸光度。。
1.5.4结肠组织中PPAR-γ、COL1A2蛋白表达检测 采用Western blot法检测:取适量结肠组织,提取蛋白并定量,蛋白上样15 μg/孔;5% SDS-PAGE电泳分离,电泳条件为80 V 20 min,120 V跑至胶底附近;300 mA转膜60 min,将蛋白转印至PVDF膜;5%BSA封闭2 h,TBST洗3次,每次10 min;孵育一抗(抗体浓度1∶1 000),4 ℃过夜;回收一抗,TBST洗3次,每次10 min;孵育HRP结合二抗(抗体浓度1∶2 000),室温1 h;回收二抗,TBST洗3次,每次10 min;ECL试剂盒显色,成像系统下成像,Image J软件分析灰度值。
1.5.5结肠组织中PPAR-γ和COL1A2 mRNA表达检测 采用RT-PCR法检测:取适量结肠组织,提取总RNA,参照反转录试剂盒说明书反转录为cDNA,以甘油酸-3-磷酸脱氢酶(GAPDH)为内参照,进行PCR扩增,引物序列:内参GAPDH上游为5’-GGTGTGAACCACGAGAAATATGAC-3’,下游为5’-TCATGAGCCCTTCCACAATG-3’;PPAR-γ上游为5’-GGAAGACCACTCGCATTCCTT-3’,下游为5’-GTAATCAGCAACCATTGGGTCA-3’;COL1A2上游为5’-GGTGAGCCTGGTCAAACGG-3’,下游为5’-ACTGTGTCCTTTCACGCCTTT-3’。结果分析采用ΔΔCT法,ΔCt=Ct目的基因-Ct内参,ΔΔCt=ΔCt处理组-ΔCt对照组,相对定量法(RQ)处理组=2-ΔΔCt,其中对照组RQ值设为1。以GAPDH为内参,依据2-ΔΔCt法计算各mRNA的相对表达量。
2 结 果
2.1各组小鼠结肠长度、结肠重量比较 与对照组比较,造模6周组、造模7周组、造模8周组小鼠的结肠长度均明显缩短(P均<0.05),造模7周组、造模8周组小鼠的结肠重量均明显增加(P均<0.05)。见表1。
表1 对照组和肠纤维化造模各组小鼠结肠长度及结肠重量比较
2.2各组小鼠结肠组织病理学表现 HE染色和Masson染色发现,造模5周组、造模6周组、造模7周组、造模8周组小鼠肠壁可见明显的炎症细胞浸润、腺体破坏、腺管扭曲、杯状细胞减少及胶原纤维增生。见图1及图2。
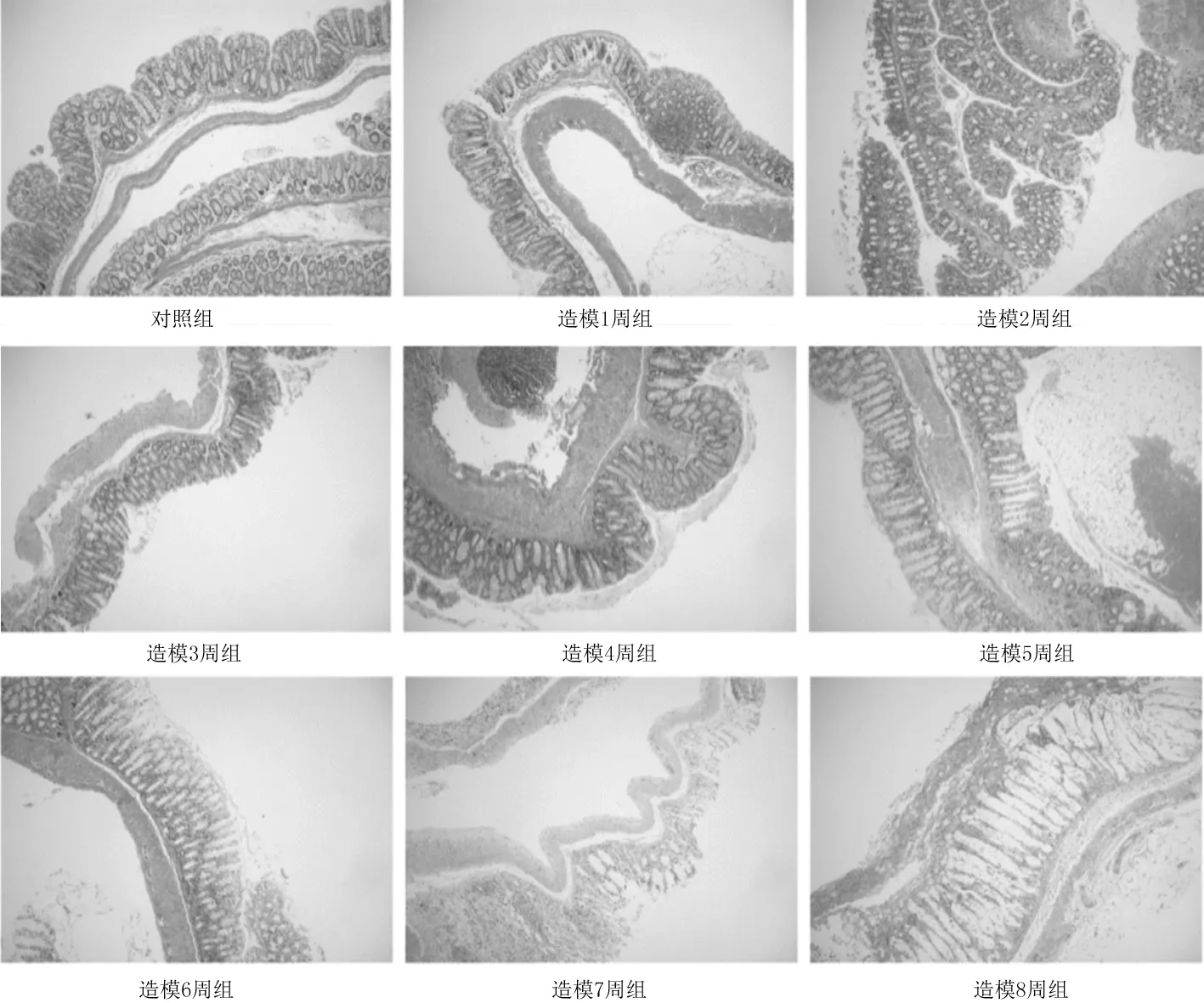
图1 对照组和肠纤维化造模各组小鼠结肠组织HE染色表现(×50)
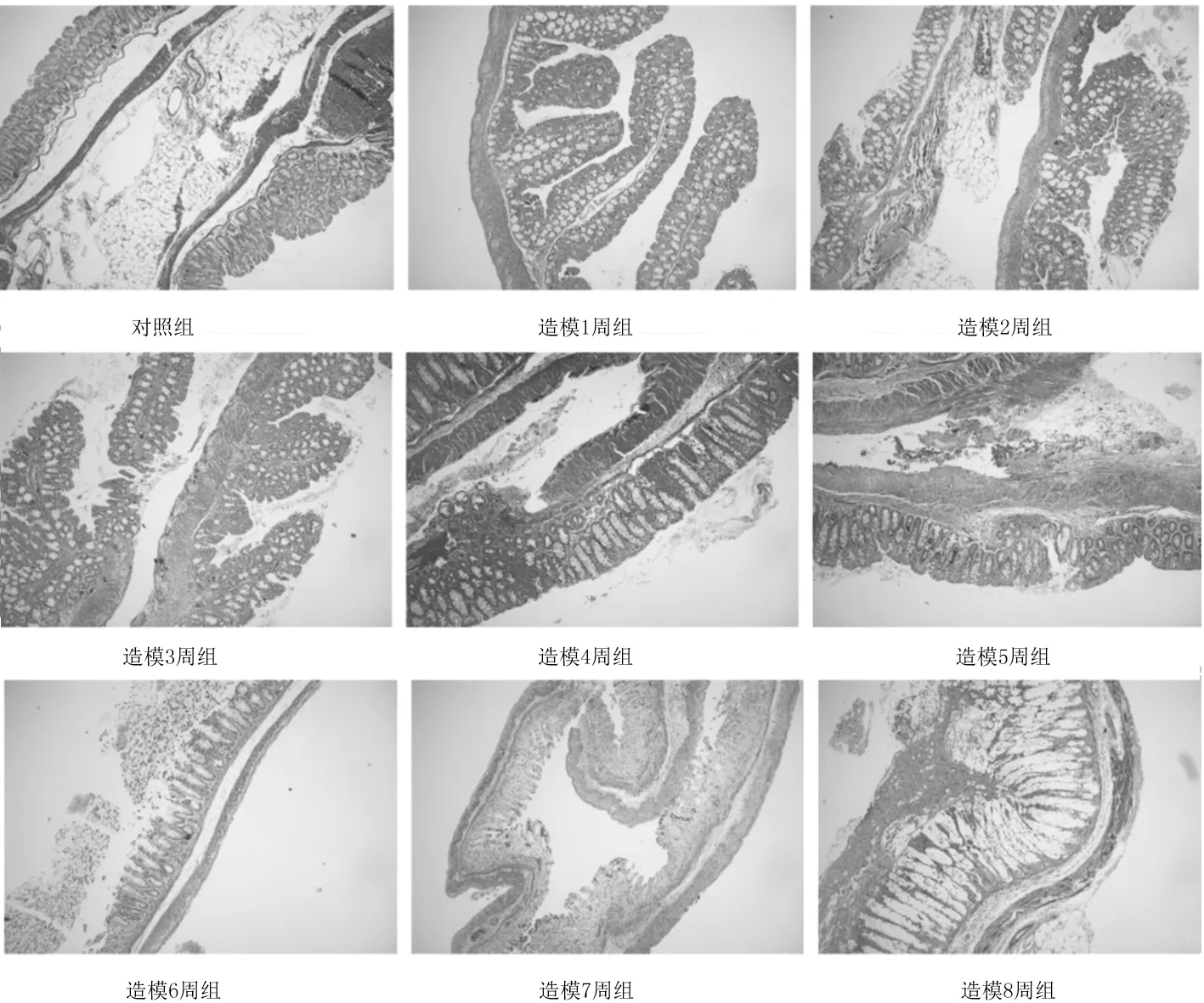
图2 对照组和肠纤维化造模各组小鼠结肠组织Masson染色表现(×50)
2.3各组小鼠结肠组织中总胶原含量比较 对照组小鼠结肠组织中总胶原含量为(6.82±0.35)μg/mg,造模1周组、造模2周组、造模3周组、造模4周组、造模5周组、造模6周组、造模7周组、造模8周组分别为(6.92±0.29)μg/mg、(6.95±0.27)μg/mg、(7.13±0.37)μg/mg、(7.52±0.42)μg/mg、(8.30±0.26)μg/mg、(9.31±0.38)μg/mg、(9.88±0.59)μg/mg、(10.47±0.50)μg/mg,造模5周组、造模6周组、造模7周组、造模8周组均明显高于对照组(P均<0.05)。
2.4各组小鼠结肠组织中PPAR-γ和COL1A2蛋白表达情况 造模各组小鼠结肠组织中PPAR-γ蛋白表达量均明显低于对照组(P均<0.05),COL1A2蛋白表达量均明显高于对照组(P均<0.05),且分别呈递减和递增趋势。见图3。

图3 对照组和肠纤维化造模各组小鼠结肠组织中PPAR-γ和COL1A2蛋白表达情况
2.5各组小鼠结肠组织中PPAR-γ和COL1A2 mRNA表达情况 造模1周组和造模2周组小鼠结肠组织中PPAR-γ和COL1A2 mRNA表达量与对照组比较差异均无统计学意义(P均>0.05);其余造模各组PPAR-γ mRNA表达量均明显低于对照组(P均<0.05),COL1A2 mRNA表达量均明显高于对照组(P均<0.05),且分别呈递减和递增趋势。见图4。

图4 对照组和肠纤维化造模各组小鼠结肠组织中PPAR-γ和COL1A2 mRNA表达情况
2.6结肠组织中PPAR-γ和COL1A2表达的相关性 造模后小鼠结肠组织中PPAR-γ和COL1A2蛋白及mRNA的表达均呈负相关(r=-0.949,P<0.05;r=-0.870,P<0.05)。见图5及图6。
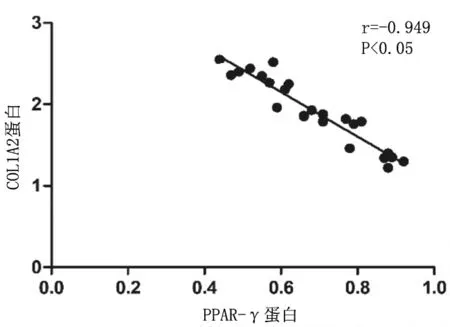
图5 肠纤维化造模各组小鼠结肠组织中PPAR-γ和COL1A2蛋白表达的相关性
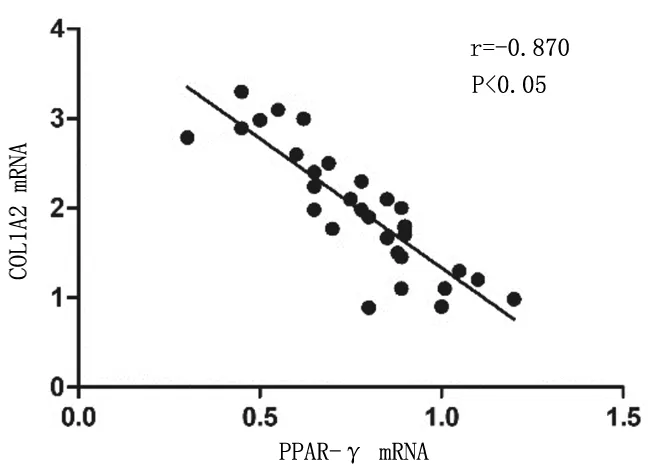
图6 肠纤维化造模各组小鼠结肠组织中PPAR-γ和COL1A2 mRNA表达的相关性
3 讨 论
炎症性肠病包括溃疡性结肠炎和克罗恩病,我国炎症性肠病的发病率近年来呈明显上升趋势[6]。克罗恩病的纤维化累及肠壁全层,统计发现约75%的克罗恩病患者在病程中至少接受一次手术,近半数是因为肠纤维化导致的肠狭窄和肠梗阻[7-8]。与克罗恩病相比,溃疡性结肠炎的纤维化常局限于黏膜及黏膜下层,虽一般不引起肠道狭窄,但会引起结肠短缩、肠壁僵硬。炎症性肠病肠纤维化的发生机制尚未完全阐明,对纤维性狭窄主要依赖内镜和手术治疗[9],缺乏有效的、耐受性好的抗纤维化药物,故明确肠纤维化的机制、寻找有效的治疗靶点是目前研究的重点。
动物模型对于研究炎症性肠病肠纤维化十分重要。本实验采用TNBS小鼠模型,该模型操作简单,经济实用,重复性好,病变持续时间长,体现疾病急性向慢性转化的过程,是一种经典的动物模型[10]。TNBS的剂量、给药频次、给药方式及给药时间参考Lawrance等[5]的研究,该方法自2003年问世以来,已被多位学者用于研究肠纤维化的发病机制或各种药物对肠纤维化的疗效[11-12]。本实验结果显示,从造模5周组开始,小鼠肠壁可见胶原纤维增生,结肠组织中总胶原含量增高;从造模6周组开始,小鼠的结肠长度明显缩短;造模7周组、造模8周组小鼠的结肠重量明显增加。这与既往相关研究结果一致。
PPARs是一种新型的核激素受体超家族,是调控众多基因表达所必需的核受体。PPARs包括3种亚型:PPAR-α、PPAR-γ和PPAR-β/δ,它们具有不同的组织分布和功能。其中PPAR-γ是研究最广泛的亚型,其广泛分布于包括肠道在内的多个组织器官,参与调控脂质代谢、炎症反应、细胞增殖和纤维化[13]。PPAR-γ的过表达可防止组织纤维化,而PPAR-γ的缺失则会增加纤维化[14]。多个实验发现PPAR-γ激动剂可减轻心、肝、肾等器官的纤维化,PPAR-γ拮抗剂则能抵抗这种抗纤维化作用[15-17]。针对肠道,PPAR-γ激动剂亦表现出抗纤维化效应[18-19]。本课题组既往研究发现,TNBS单次灌肠造模3d后,大鼠结肠组织中PPAR-γ的表达受抑制,14d时其表达逐渐恢复[20]。Yang等[21]和Fu等[22]的研究也发现TNBS造模3d后PPAR-γ表达下调。本研究采用TNBS多次灌肠建立小鼠肠纤维化模型,结果发现随造模时间延长,结肠组织中PPAR-γ表达逐渐减少,与既往研究结果不一致的可能原因是TNBS给药的次数和观察的时间点不一样,既往的研究多观察PPAR-γ在急性炎症期的表达情况,而非在慢性纤维化进程中的动态表达情况。
肠纤维化主要表现为肠道ECM的过度沉积,胶原是ECM的主要成分,它有多个亚型,Ⅰ型胶原是最主要的亚型。本实验结果发现,随造模时间延长,结肠组织中COL1A2表达逐渐增加,相关性分析显示PPAR-γ和COL1A2的表达呈负相关,提示PPAR-γ可能通过影响胶原的表达而参与肠纤维化进程。
综上所述,TNBS灌肠诱导小鼠纤维化模型中,造模5周后出现明显病变,结肠组织中总胶原含量增加,PPAR-γ随造模时间延长而表达逐渐受抑制,且PPAR-γ与COL1A2的表达呈负相关,PPAR-γ在肠纤维化进程中可能起重要作用。
利益冲突:所有作者均声明不存在利益冲突。

