羌活离体再生体系的建立
涂永燕, 肖小君, 邹嘉慧, 李 强, 罗陈勇, 王 辉*
(1.内江师范学院 生命科学学院, 四川 内江 641100; 2.四川千草生物技术股份有限公司, 四川 内江 641100)
0 引言
羌活(Notopterygiumincisum),俗称黑药、大头羌、蚕羌、退风使者、川羌等,是伞形科(Umbelliferae) 芹亚科(Genus apium) 美味芹族 (Delectamentum familia apium )羌活属(genusNotopterygium)多年生草本植物,是我国的特有属,有6个种(宽叶羌活、羌活、羽苞羌活、澜沧羌活、细叶羌活和卵叶羌活)[1-2].药用羌活为羌活或宽叶羌活的干燥根茎,是一种常用中药材,主产于甘肃、四川、云南、青海等地[3].羌活的化学成分复杂,主要含香豆素类化合物、挥发油、有机酸等有效化学成分[4],其味辛,性温,被列为辛温解表药,具有散寒祛风、祛湿止痛之功效,临床用于感冒风寒、头痛身疼、风寒湿痹、风水浮肿、痈疽疮毒等症[4-5].研究结果表明:羌活中的主要化学成分之一紫花前胡苷具有改善大脑学习记忆障碍的功能,有望发展成为预防和治疗健忘症的新药物[6].随着市场需要量的不断上升和价格上涨,在经济利益的驱动下,人们对野生羌活的过度采挖,使羌活生境受到严重破坏,野生羌活资源蕴藏量不断下降[7].因此,加强对羌活资源保护和人工快速繁殖应用研究就成为一个亟待解决的紧迫话题.
羌活由于种子具有休眠特性,发芽率较低,目前的研究主要集中在羌活的种类[1]、化学成分[4]、药理作用[7]和种子繁殖[8]等方面.如张恩和等[9]研究表明,羌活种子先通过流水冲洗后,再采用赤霉素或赤霉素与细胞分裂素混合处理种子,可提前萌发,提高发芽率.对于羌活组织培养方面的研究目前相对较少,如何诗虹等[10]研究不同植物激素对羌活愈伤组织形成、不定芽分化和生根形成完整植株的影响,筛选出最佳培养基配方.本文以羌活种子为材料,探究其无菌萌发的处理条件;并以萌发的无菌苗为外植体,探究不同激素配比对无菌幼苗增殖和生根的影响,以建立羌活离体再生体系,为羌活的快速繁殖和资源可持续利用提供技术支撑.
1 材料与方法
1.1 试验材料
1.1.1 材料
羌活种子,采自四川省阿坝州松潘县.
1.1.2 药品
试验所用NAA药品为化学纯,含量≥98.0%,成都科龙化工试剂厂生产;6-BA、KT、赤霉素为分析纯药品,含量≥98.0%,成都科龙化工试剂厂生产;IBA为分析纯药品,含量>98.0%,成都科龙化工试剂厂生产.
1.2 试验方法
1.2.1 不同处理方式对羌活种子萌芽的影响
选取成熟饱满的羌活种子作为试验材料,先用流水冲洗30min,晾干后,装入含有珍珠岩的尼龙网袋中,放置在25℃左右的实验室内储存.取120粒饱满成熟的种子各4份,去皮,分别编号,如表1所示.

表1 羌活种子的不同处理方式
将上述处理的种子先用镊子取出,置于吸水纸上,待种子晾干后转入超净工作台,用体积分数为75%的酒精消毒20 s后无菌水润洗3次,再用0.1%的升汞溶液消毒8~10 min,最后用无菌水润洗5~6次后进行接种,处理过程中,不断摇动烧杯.将消毒好的羌活种子接种在MS+KT0.5 mg/L+NAA0.5 mg/L+AC1 g/L+蔗糖30 g/L+琼脂条7 g/L的培养基上,每个编号接种20瓶,每瓶接种6粒.接种完成后将培养瓶置于光照培养箱中,其培养条件:温度20℃,湿度(70±5)%,光照周期8 h/16 h,光照强度为2000 lx.
接种完成后,3~5 d观察羌活种子污染状况,之后每隔半个月查看羌活种子萌芽状况.30 d后观察并统计数据,计算萌芽率和污染率.
萌芽率=(萌发种子数/接种总数)×100%; 污染率=(污染种子数/接种总数)×100%.
1.2.2 不同浓度的激素对羌活试管苗增殖的影响
将1.2.1试验中发芽的种子转接到配方为MS+6-BA2.0 mg/L+NAA0.2 mg/L+AC1 g/L+蔗糖30 g/L+琼脂条7 g/L的培养基上,待萌发的幼苗长到3 cm~4 cm左右.选取长势一致的羌活种子萌发幼苗,完全随机试验设计,利用无菌操作技术将其接种在表2中的培养基,每个配方接种5瓶,每瓶5株试管苗,重复3次.将接种好的试管苗放置在温度为(25±2)℃,光照周期14 h/10 h,光照强度为2000 lx的培养条件下培养30 d.
试验配方:以MS+蔗糖30 g/L+琼脂条7 g/L为基本培养基,添加激素浓度见表2.
培养期间每隔7 d观察羌活试管苗的生长状况,30 d后观察并记录数据,计算羌活试管苗的增殖率.
增殖率=[(增殖后总植株数-接种总数)/接种总数] ×100 %.
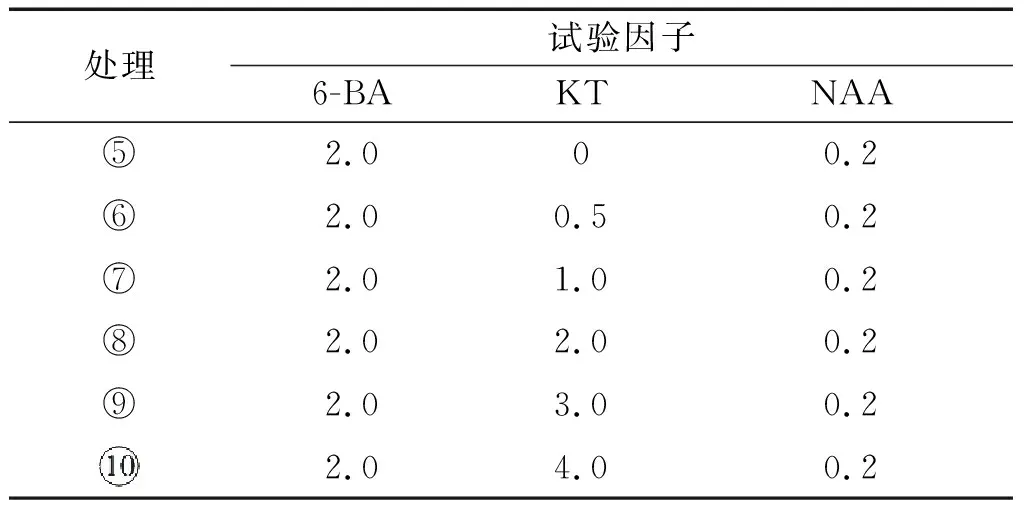
表2 羌活试管苗增殖培养基配方 单位:mg/L
1.2.3 不同处理方式及不同培养基配方对羌活增殖苗生根的影响
试验配方:以1/2 MS +蔗糖40 g/L+琼脂条7 g/L 为基本培养基,添加激素浓度和不同处理方式见表3.

表3 生根培养基配方 单位:mg/L
用1.2.2获得的羌活增殖苗为试材,选取茎粗壮、叶片颜色浓绿的增殖苗,完全随机试验设计,在超净工作台上,将2~3单株增殖苗为一丛,去掉黄化的叶片和纤细的茎秆,分别转入上述培养基中.其中和处理需先将试管苗在无菌的100 mg/L的NAA溶液中浸泡10 min,再接种至对应的培养基中.每处理接种5瓶,每瓶3丛试管苗,重复3次.将接种好的试管苗放置在温度为(25±2)℃,光照周期14 h/10 h,光照强度为2000 lx的培养条件下培养30 d.培养期间每7 d观察羌活试管苗的生根状况,30 d后观察并记录数据,统计羌活试管苗生根情况(试管苗根有4条,长为1.5 cm时,视为生根).
生根率=(生根的试管苗数/接种的试管苗数) ×100%.
所有实验数据采用Excel软件进行处理,用SPSS 17.0进行方差分析,用Duncan新复极差法检验差异显著性.
1.2.4 驯化移栽
选取20瓶根系生长良好的羌活试管苗为试材,置于组培架上,在光照强度2000 lx,温度为(22±3)℃,每天补光10 h环境下炼苗10 d[11].移栽时,用镊子轻轻将羌活试管苗从培养瓶中取出,去除黄叶,清水轻轻冲洗苗上粘有的培养基,再用800倍多菌灵溶液浸泡2~3 min后,按株行距6 cm×6 cm栽种到以园土+营养土+珍珠岩(2∶1∶1)混合的高温灭菌过的基质中[12],浇透水后,覆上保鲜膜.
培养期间,每天揭开育苗盘保鲜膜1.5 h,每隔5 d,用洒水壶补1次水,30 d天后观察羌活幼苗的生长情况.
2 结果与分析
2.1 不同处理方式对羌活种子萌芽的影响
接种培养后观察,在接种10 d以后,少量种子膨大,出现白色芽点,长0.5 cm~1 cm,为种子的胚根 (见图1a).表4显示:种子不经任何处理,直接接种到培养基上,萌发率较低,为5.00%;种子经过室内干藏,用500 mg/L赤霉素浸泡有利于提高种子的萌发率,其中④处理方式比③处理方式更有利于种子的萌发,萌芽率可达17.50%.本试验结果表明室内干藏后的羌活种子,经0~4℃的清水中浸泡24 h,再用500 mg/L赤霉素浸泡24 h的处理后,有利于种子的萌发,且试管苗在培养基中生长健壮、叶色浓绿.
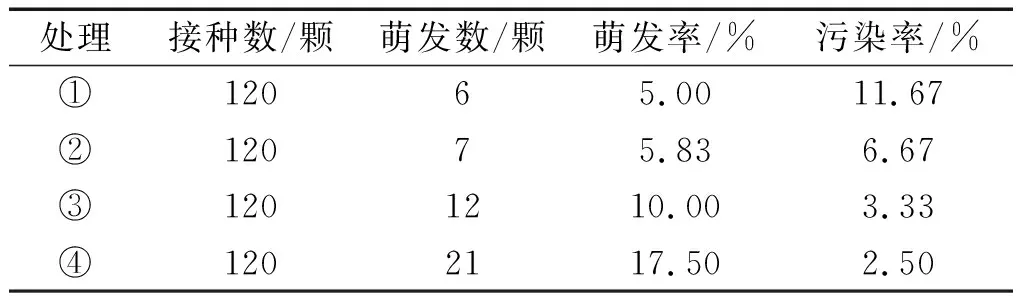
表4 不同处理方式对羌活种子萌芽的影响

图1 羌活种子萌发及生长情况
2.2 不同浓度的激素对羌活试管苗增殖的影响
表5显示:添加不同浓度的KT对羌活试管苗增殖有显著效果.与对照相比,随KT浓度的增加,羌活试管苗增殖数呈先上升后降低的趋势.在KT浓度为1.0 mg/L时增殖后株数达最大值,增殖率为280.00%,羌活试管苗芽丛密集、叶色浓绿、幼苗粗壮、长势强(见图2c).随着KT浓度上升,试管苗死亡率逐渐增加,增殖率下降,表现为叶片黄化,试管苗萎蔫.在KT浓度为4.0 mg/L时,试管苗叶片老化,开始出现死亡,死亡率为24.00%(见图2f).当KT浓度为0.5 mg/L时,增殖率为248.00%,但与KT1.0 mg/L相比,增殖苗茎干细弱,叶色嫩绿,不利于后期生根研究.综上所述,改变KT浓度对羌活试管苗增殖有一定影响,综合增殖率、死亡率和生长状况考虑,较适宜的增殖培养基配方为MS +6-BA2.0 mg/L+KT1.0 mg/L+NAA0.2 mg/L +琼脂条7 g/L+蔗糖30 g/L.

表5 不同浓度的激素对羌活试管苗增殖的影响

图2 羌活试管苗增殖情况
2.3 不同处理方式及不同培养基配方对羌活增殖苗生根的影响
综合考虑,经无菌100 mg/L NAA溶液浸泡的试管苗接种到1/2MS+NAA0.5 mg/L的培养基中进行生根培养,效果较佳.
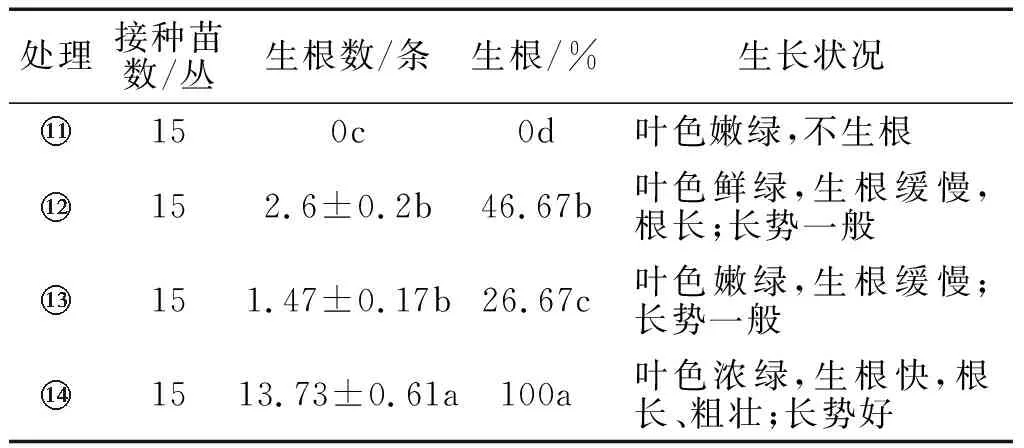
表6 不同处理方式及不同培养基配方对羌活 试管苗生根的影响
2.4 驯化移栽
由图4可知,羌活试管苗经驯化处理,移栽到以园土+营养土+珍珠岩(2∶1∶1)混合的高温灭菌过的基质中 ,培养30 d后,羌活幼苗能存活,且生长状况良好.

图3 羌活试管苗的生根情况 注:a、b、c、d分别表示在号、号、号、号培养基中培养30 d的生根情况.

图4 羌活试管苗移栽生长情况 注:a羌活试管苗移栽5 d的生长情况;b羌活试管苗移栽30 d后生长情况.
3 讨论
自然环境下野生羌活以有性繁殖为主,由于种子具有双重性休眠特性,导致自然繁殖率极低,萌芽率仅为0.52%[13].影响种子萌发的外界条件中,温度是关键因子[9],因此,种子萌发前,经低温处理,再恒温处理,可有效打破种子休眠[14].此外,用赤霉素浸泡种子可替代低温而打破休眠[15],这主要是因为赤霉素改变了羌活种子内的激素比例,有利于休眠状态下的种子胚恢复发育,当种胚长度充满整个胚腔时,种皮裂开,种子萌发[9].在处理羌活种子试验中,应当舍弃漂浮在清水面上的种子,挑选饱满、大粒的种子为材料.接种时,种子凸面背对培养基,凹面接触培养基,这与羌活种子形态结构有关(羌活种子为双悬果,扁椭圆形,表面棕褐色,背面有纵棱 3—4 条,常延伸成淡棕色的翅,腹面微凹,中央常存一细线状悬果柄,与果实顶端相连),胚细小,埋生于种仁基部[16].
继代转接试管苗时,应用镊子和解剖刀将增殖苗的叶子和黄化部位切除,保留生长点和2 cm~3 cm长的茎,不要损伤生长点,否则后期培养芽很快死亡.在羌活试管苗增殖培养试验中,增殖培养的最佳时间为30~35 d,培养时间过长,易造成试管苗出现黄化现象.在工业化大量育苗中,若想使羌活试管苗无限次继代下去,应及时更新复壮材料,维持良好芽苗的稳定增殖生长[17].
在羌活试管苗生根培养中,培养瓶中培养基量为70 mL~80 mL,定植类型及密度为每丛2—3株,每瓶3丛时生根效果较佳.本试验结果表明:羌活试管苗根部经过NAA浸泡,有利于其生根.这主要是因为NAA不仅有利于根原基的诱导,而且能促进不定根的发育和生长[18].同时,也可能是由于NAA 解除了基因的抑制,提高mRNA的合成,从而促进多种酶的合成,诱导根原基的发端[19].
4 结论
研究结果表明添加一定配比的6-BA、KT、NAA三种激素有利于羌活试管苗增殖分化.因羌活是喜阴植物,强光、高温会抑制其生长,所以驯化移栽时要创建一个湿度较高、避免强光直射的环境.在研究过程中发现,不同季节对羌活试管苗的污染有较明显的影响,夏季污染率高,秋冬季污染率极低,工业化扩繁羌活试管苗的最佳时间为秋季,驯化移栽时间应选择在春季进行.

