具有酰胺键和不对称邻位侧基修饰的聚酰亚胺合成
马金文,何秀娟,张帮翠,杨艳华
(昆明学院 化学化工学院,云南 昆明 650214)
含有环状酰亚胺基团的聚酰亚胺具有良好的热稳定性、柔韧性、成膜性、高透光性以及低介电常数等优异性能,已成为最具应用前景的工程塑料之一.目前,该材料在航空航天、机械、化工等领域均有广泛应用.随着有机电子学的发展及聚合物存储材料的研究深入,芳香型聚酰亚胺已被逐渐用作存储器件的活性材料和柔性器件的基底材料[1].
然而,芳香型聚酰亚胺的分子链呈刚性结构,导致其具有难熔融性、难溶解性和难加工性,限制了聚酰亚胺的实际应用.为了提高聚酰亚胺的溶解性和可加工性,通常在分子结构中进行结构修饰,例如,引入空间体积较大的基团、柔性链接部分、芳香杂环和不对称基团修饰分子结构等[2-3].因此,本文采用引入柔性酰胺键部分和修饰邻位侧基的方法,合成具有不对称结构的聚酰亚胺分子,以期为聚酰亚胺的应用推广提供参考.
1 实验部分
1.1 试剂和仪器
所有有机化合物均购于阿拉丁试剂(上海)有限公司;有机试剂均购于南京化学试剂股份有限公司,试剂均为试剂纯.
使用青岛市基亿达硅胶厂200-300目的柱层硅胶提纯物质;采用Bruker Avance II-400型核磁共振仪在25 ℃下测试有机化合物和聚酰亚胺的1H NMR和13C NMR;RY-1G熔点仪测试有机化合物熔点.
1.2 实验步骤
1.2.1 硝基化合物的合成
3,5-二硝基-N-苯甲酰基苯胺(硝基化合物1)和邻溴苄溴来自前期的研究工作[4-5],合成过程不再赘述.
硝基化合物2的合成:室温条件下,在 250 mL 装有磁力搅拌子的三口反应瓶中,依次加入硝基化合物1(2.24 g,7.8 mmol)、邻溴苄溴(1.94 g,7.8 mmol)、碳酸钾(5.38 g,39.0 mmol)和N,N-二甲基甲酰胺(60 mL),在60 ℃条件下搅拌5 h.反应结束后加入150 mL蒸馏水搅拌10 min,抽滤,将滤饼置于150 mL装有磁力搅拌子和乙醇(60 mL)的三口烧瓶中,在50 ℃条件下搅拌 30 min.冷却至室温,抽滤,真空干燥箱50 ℃条件下干燥7 h,得硝基化合物2(C30H14BrN3O3)(3.2 g,90%).1H NMR(400 MHz,DMSO-d6,δ):8.72(s,1H,ArH),8.54(s,2H,ArH),7.65(d,1H,J=8.0 Hz,ArH),7.60(d,1H,J=8.0 Hz,ArH),7.39(d,1H,J=8.0 Hz,ArH),7.35(d,2H,J=8.0 Hz,ArH),7.25(q,3H,J=8.0 Hz,ArH),7.16(t,1H,J=8.0 Hz,ArH),5.22(s,2H,-CH2-).
1.2.2 氨基化合物的合成
氨基化合物3的合成:25 ℃条件下,依次将硝基化合物2(3.6 g,7.8 mmol)、乙醇(40 mL)和蒸馏水(20 mL)加入150 mL装有磁力搅拌子的三口反应瓶中,当温度上升至60 ℃时,加入乙酸(6 mL)和铁粉(3.48 g,62.4 mmol),60 ℃条件下搅拌5 h.冷却到室温,抽滤,滤液用氨水中和至pH呈碱性,过滤去除不溶物,旋转蒸发仪旋除溶剂,使用溶剂比例为V(乙酸乙酯)∶V(正己烷)=1∶3的混合液为淋洗剂,柱层层析法提纯得氨基化合物3(C30H18BrN3O)(2.4 g,80%),熔点165 ℃.1H NMR(400 MHz,DMSO-d6,δ):7.60(d,1H,J=8.0 Hz,ArH),7.39(t,2H,J=4.0 Hz,ArH),7.22(t,3H,J=8.0 Hz,ArH),7.11(d,1H,J=8.0 Hz,ArH),7.07(d,2H,J=8.0 Hz,ArH),5.80(d,2H,J=4.0 Hz,ArH),5.71(t,1H,J=4.0 Hz,ArH),5.04(s,2H,-CH2-),4.72(s,4H,-NH2).13C NMR(101 MHz,DMSO-d6,δ):171.62,149.06,143.67,137.50,136.85,133.07,129.54,129.32,129.23,128.28,127.20,126.66,122.83,103.46,101.26,53.54.
氨基化合物4a的合成:N2条件下,依次将氨基化合物3(0.300 g,0.757 mmol)、苯基硼酸(0.110 0 g,0.901 6 mmol)、四(三苯基膦钯)(0.008 7 g,0.007 57 mmol)、碳酸钾(0.21 g,1.52 mmol)、甲苯(20 mL)和蒸馏水(10 mL)加入50 mL装有磁力搅拌子的三口反应瓶中,在 100 ℃ 条件下搅拌8 h.反应液冷却到室温,抽滤,滤液用甲苯萃取(3×10 mL),收集有机层,旋转蒸发仪旋除溶剂,使用溶剂比例为V(二氯甲烷)∶V(正己烷)=1∶3 的混合液为淋洗剂,柱层层析法提纯得氨基化合物4a(C26H23N3O)(0.278 g, 93%),熔点93 ℃.1H NMR(400 MHz,DMSO-d6,δ):7.53(d,1H,J=8.0 Hz,ArH),7.42~7.35(m,4H,ArH),7.33(t,1H,J=8.0 Hz,ArH),7.16(dd,5H,J=8.0 Hz,J=4.0 Hz,ArH),7.07(t,1H,J=8.0 Hz,ArH),6.86(d,2H,J=8.0 Hz,ArH),5.74(d,2H,J=4.0 Hz,ArH),5.68(s,1H,ArH),4.92(s,2H,-CH2-),4.70(s,4H,-NH2).13C NMR (101 MHz,DMSO-d6,δ):171.63,149.02,143.87,141.41,140.58,137.75,135.51,130.24,129.38,129.10,128.70,128.05,127.61,127.58,127.37,127.09,126.43,103.40,101.14,50.94.
其余氨基化合物的合成条件与氨基化合物4a的完全相同,只是将苯基硼酸换成等物质的量的邻甲基苯基硼酸、3,4-二甲基苯基硼酸、3,5-二甲氧基苯基硼酸和4-(1-萘基)苯基硼酸,合成路线如图1所示,此处不再赘述.
化合物4b(C27H25N3O)(0.26 g,84%),熔点 91 ℃.1H NMR(400 MHz,DMSO-d6,δ):7.55(d,1H,J=8.0 Hz,ArH),7.43(t,1H,J=8.0 Hz,ArH),7.32~7.24(m,3H,ArH),7.20~7.13(m,3H,ArH),7.09(d,1H,J=8.0 Hz,ArH),7.05(d,1H,J=8.0 Hz,ArH),6.87(dd,3H,J=8.0 Hz,J=4.0 Hz,ArH),5.76(t,2H,J=8.0 Hz, ArH),5.69(d,1H,J=4.0 Hz,ArH),4.71(s,4H,-NH2),4.64(s,2H,-CH2-),1.82(s,3H,-CH3).13C NMR(101 MHz,DMSO-d6,δ):171.21,148.56,143.45,140.15,139.55,137.22,135.31,135.20,129.84,129.26,129.05,128.67,127.53,126.76,126.68,126.61,126.01,125.60,102.89,100.67,50.52,19.40.
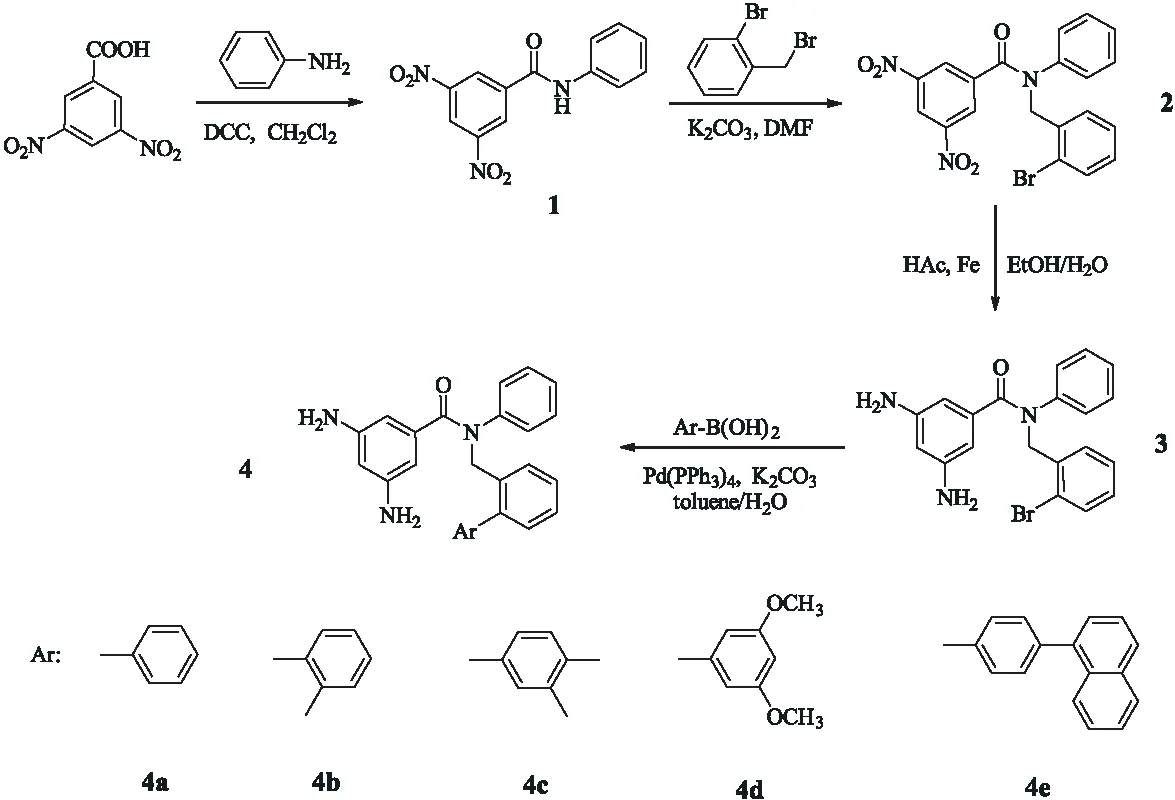
图1 二胺单体的合成路线
化合物4c(C28H27N3O)(0.25 g,78%),熔点 99 ℃.1H NMR(400 MHz,DMSO-d6,δ):7.51(d,1H,J=8.0 Hz,ArH),7.40(t,1H,J=8.0 Hz,ArH),7.30(t,1H,J=8.0 Hz,ArH),7.16(t,4H,J=8.0 Hz,ArH),7.09(d,1H,J=8.0 Hz,ArH),6.87(d,4H,J=8.0 Hz,ArH),5.74(s,2H,ArH),5.68(s,1H,ArH),4.92(s,2H,-CH2-),4.71(s,4H,-NH2),2.24(s,3H,-CH3),2.21(s,3H,-CH3).13C NMR(101 MHz,DMSO-d6,δ):171.67,149.00,143.88,141.48,138.06,137.79,136.46,135.49,130.45,130.25,129.75,129.10,127.78,127.50,127.26,127.20,126.70,126.46,103.40,101.13,50.96,19.86,19.54.
化合物4d(C28H27N3O3)(0.29 g,84%),熔点96 ℃.1H NMR(400 MHz,DMSO-d6,δ):7.52(d,1H,J=4.0 Hz,ArH),7.42(t,1H,J=8.0 Hz,ArH),7.31(t,1H,J=8.0 Hz,ArH),7.17(dd,3H,J=8.0 Hz,J=4.0 Hz,ArH),7.07(t,1H,J=8.0 Hz,ArH),6.90(d,2H,J=8.0 Hz,ArH),6.48(s,1H,ArH),6.27(s,2H,ArH),5.75(s,2H,ArH),5.70(s,1H,ArH),4.97(s,2H,-CH2-),4.70(s,4H,-NH2),3.72(s,6H,-OCH3).13C NMR(101 MHz,DMSO-d6,δ):171.13,160.07,148.42,143.31,142.09,140.85,137.26,134.98,129.38,128.47,127.52,127.04,126.68,126.58,125.85,106.97,102.94,100.68,99.18,55.13,50.25.
化合物4e(C36H29N3O)(0.34 g,86%),熔点127 ℃.1H NMR(400 MHz,DMSO-d6,δ):8.29(s,1H,ArH),8.04(t,2H,J=8.0 Hz,ArH),7.97(d,1H,J=8.0 Hz,ArH),7.92(d,1H,J=8.0 Hz,ArH),7.86(d,2H,J=8.0 Hz,ArH),7.58~7.51(m,3H,ArH),7.45(t,1H,J=8.0 Hz,ArH),7.37(t,1H,J=8.0 Hz,ArH),7.31(d,2H,J=8.0 Hz,ArH),7.25(d,1H,J=8.0 Hz,ArH),7.17(t,2H,J=8.0 Hz,ArH),7.09(t,1H,J=8.0 Hz,ArH),6.92(d,2H,J=8.0 Hz,ArH),5.76(d,2H,J=4.0 Hz,ArH),5.69(t,1H,J=4.0 Hz,ArH),5.02(s,2H,-CH2-),4.70(s,4H,-NH2).13C NMR(101 MHz,DMSO-d6,δ):171.19,148.54,143.45,140.45,139.35,138.66,137.28,136.98,135.15,133.35,132.28,129.80,129.64,128.66,128.52,128.23,127.68,127.50,127.18,126.98,126.80,126.65,126.43,126.17,125.99,125.26,125.00,102.93,100.67,50.63.
1.2.3 聚酰亚胺的合成
聚酰亚胺3-BTDA的合成:在N2条件下,依次将化合物3(0.198 g,0.5 mmol)、3,3’,4,4’-二苯酮四羧酸二酐(BTDA)(0.161 g,0.5 mmol)和除水 N,N-二甲基乙酰胺(5 mL)加入50 mL装有磁力搅拌子的三口烧瓶中,25 ℃下搅拌24 h.依次加入除水N,N-二甲基乙酰胺(3 mL)、吡啶(0.5 mL)和醋酸酐(0.5 mL)后,将反应温度升温至100 ℃.反应8 h后冷却至室温,将反应液滴加至装有50 mL甲醇的 100 mL 烧杯中,搅拌5 min后抽滤,滤饼依次用蒸馏水(20 mL)和甲醇(20 mL)冲洗后100 ℃真空干燥 7 h 得聚酰亚胺 3-BTDA((C37H20BrN3O6)n).1H NMR(400 MHz,DMSO-d6,δ):8.24(d,6H,J=32.0 Hz,ArH),7.64(d,4H,J=28.0 Hz,ArH),7.45(s,1H,ArH),7.34(s,1H,ArH),7.18(s,6H,ArH),5.16(s,2H,-CH2-).
其余聚酰亚胺的合成条件与聚酰亚胺3-BTDA完全相同,只是将化合物3换成等物质的量的化合物4a、4b、4c、4d和4e,将BTDA换成等物质的量的3,3’,4,4’-联苯二酐(BPDA),合成路线如图2所示,此处不再赘述.
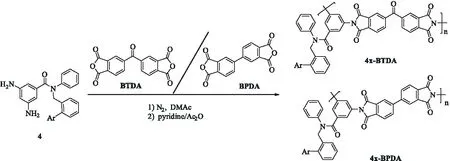
图2 聚酰亚胺的合成路线
聚酰亚胺3-BPDA((C36H20BrN3O5)n).1H NMR(400 MHz,DMSO-d6,δ):8.43(d,4H,J=20.0 Hz,ArH),8.08(s,2H,ArH),7.63(s,4H,ArH),7.48(s,1H,ArH),7.35(s,1H,ArH),7.20(s,6H,ArH),5.18(s,2H,-CH2-).
聚酰亚胺4a-BTDA((C43H25N3O6)n).1H NMR(400 MHz,DMSO-d6,δ):8.22(d,6H,J=32.0 Hz,ArH),7.58(d,4H,J=24.0 Hz,ArH),7.35(d,5H,J=4.0 Hz,ArH),7.13(s,6H,ArH),6.95(d,2H,J=4.0 Hz,ArH),5.05(s,2H,-CH2-).
聚酰亚胺4a-BPDA((C42H25N3O5)n).1H NMR(400 MHz,DMSO-d6,δ):8.41(d,7H,J=136.0 Hz,ArH),7.59(d,4H,J=28.0 Hz,ArH),7.37(t,12H,J=80.0 Hz,ArH),5.07(s,2H,-CH2-).
聚酰亚胺4b-BTDA((C44H27N3O6)n).1H NMR(400 MHz,DMSO-d6,δ):8.23(d,6H,J=36.0 Hz,ArH),7.62~7.55(m,4H,ArH),7.39(d,1H,J=8.0 Hz,ArH),7.29~7.15(m,8H,ArH),7.03(d,1H,J=8.0 Hz,ArH),6.96(d,1H,J=4.0 Hz,ArH),6.80(d,1H,J=4.0 Hz,ArH),4.77(s,2H,-CH2-),1.80(s,3H,-CH3).
聚酰亚胺4b-BPDA((C43H27N3O5)n).1H NMR(400 MHz,DMSO-d6,δ):8.43(d,4H,J=20.0 Hz,ArH),8.08(s,2H,ArH),7.64(d,4H,J=36.0 Hz,ArH),7.41~7.18(m,8H,ArH),7.05~6.82(m,4H,ArH),4.79(s,2H,-CH2-),1.83(s,3H,-CH3).
聚酰亚胺4c-BTDA((C45H29N3O6)n).1H NMR(400 MHz,DMSO-d6,δ):8.23(d,6H,J=36.0 Hz,ArH),7.58(d,4H,J=24.0 Hz,ArH),7.36(d,2H,J=32.0 Hz,ArH),7.14(d,5H,J=16.0 Hz,ArH),6.95(s,2H,ArH),6.82(s,2H,ArH),5.05(s,2H,-CH2-),2.18(s,6H,J=8.0 Hz,-CH3).
聚酰亚胺4c-BPDA((C44H29N3O5)n).1H NMR(400 MHz,DMSO-d6,δ):8.42~8.05(m,6H,ArH),7.65~7.52(m,4H,ArH),7.39(t,1H,J=8.0 Hz,ArH),7.31(t,1H,J=8.0 Hz,ArH),7.19~7.12(m,5H,ArH),6.99~6.84(m,4H,ArH),5.07(d,2H,J=16.0 Hz,-CH2-),2.25(t,6H,J=12.0 Hz,-CH3).
聚酰亚胺4d-BTDA((C45H29N3O8)n).1H NMR(400 MHz,DMSO-d6,δ):8.22(d,6H,J=32.0 Hz,ArH),7.58~7.50(m,4H,ArH),7.35(d,2H,J=28.0 Hz,ArH),7.15(s,4H,ArH),6.97(d,2H,J=4.0 Hz,ArH),6.41(s,1H,ArH),6.26(s,2H,ArH),5.09(s,2H,-CH2-),3.66(s,6H,-OCH3).
聚酰亚胺4d-BPDA((C44H29N3O7)n).1H NMR(400 MHz,DMSO-d6,δ):8.41~8.36(m,4H,ArH),8.08(s,2H,ArH),7.58(d,4H,J=32.0 Hz, ArH),7.37(d,2H,J=28.0 Hz,ArH),7.17(s,4H,ArH),6.99(s,2H,ArH),6.44(s,1H,ArH),6.28(s,2H,ArH),5.11(s,2H,-CH2-),3.69(s,6H,-OCH3).
聚酰亚胺4e-BTDA((C53H31N3O6)n).1H NMR(400 MHz,DMSO-d6,δ):8.17(d,7H,J=48.0 Hz,ArH),7.88(d,6H,J=28.0 Hz,ArH),7.53~7.36(m,10H,ArH),7.23~7.00(m,6H,ArH),5.22(s,2H,-CH2-).
聚酰亚胺4e-BPDA((C52H31N3O5)n).1H NMR(400 MHz,DMSO-d6,δ):8.29(d,5H,J=80.0 Hz,ArH),8.00~7.84(m,9H,ArH),7.54(d,9H,J=80.0 Hz,ArH),7.24~7.04(m,6H,ArH),5.26(s,2H,-CH2-).
2 结果与讨论
采用化学酰亚胺法制备具有不对称结构的聚酰亚胺分子,柔性的酰亚胺链接部分不会断裂,并通过核磁图谱表征聚酰亚胺及其二胺单体.化合物3经Suzuki 偶联反应后,-CH2-和-NH2的化学位移都发生改变,聚酰亚胺及二胺单体的核磁氢谱特征峰化学位移值如表1所示.经苯基、邻甲基苯基、3,4-二甲基苯基、3,5-二甲氧基苯基和4-(1-萘基)苯基修饰后得到的化合物4a、4b、4c、4d和4e的-CH2-化学位移值分别为4.92、4.64、4.92、4.97和5.02,相比较于化合物3的-CH2-化学位移值5.04,δ较小,都向高场方向移动.同时化合物4a、4b、4c、4d和4e的-NH2化学位移值分别为4.70、4.71、4.71、4.70和4.70,相比较于化合物3的-NH2化学位移值4.72,δ较小, 也都向高场方向移动.说明经芳基基团修饰的聚酰亚胺,影响了芳环的各向异性,导致-CH2-和-NH2处于屏蔽区,化学位移值都向高场移动.

表1 合成的聚酰亚胺及二胺单体结构式与核磁氢谱特征峰化学位移值

续表1
经化学酰亚胺法合成聚酰亚胺后,聚酰亚胺4a-BTDA、聚酰亚胺4b-BTDA、聚酰亚胺4c-BTDA和聚酰亚胺4d-BTDA的-CH2-化学位移值分别为5.05、4.77、5.05和5.09,相比较于化合物3-BTDA的-CH2-化学位移值5.16,δ较小,都向高场方向移动.同时聚酰亚胺4a-BPDA、聚酰亚胺4b-BPDA、聚酰亚胺4c-BPDA和聚酰亚胺4d-BPDA的 -CH2- 化学位移值分别为5.07、4.79、5.07和5.11,相比较于化合物3-BPDA的-NH2化学位移值5.18,δ较小,也都向高场方向移动,这与二胺单体中芳基各向异性对化学位移值的影响一致.邻位-CH3对芳环的屏蔽效应最大,导致含有邻位 -CH3的聚酰亚胺4b-BTDA和聚酰亚胺4b-BPDA中的-CH2-化学位移值δ最小.但是含有4-(1-萘基)苯基修饰和聚酰亚胺4e-BTDA和聚酰亚胺4e-BPDA的-CH2-化学位移值δ较大,相比较于其他聚酰亚胺都向低场方向移动,说明4-(1-萘基)苯基增加了π电子环电流产生的感应磁场,-CH2-位于去屏蔽区,导致化学位移值处于低场[6].
总之,相比较于含有BTDA部分的聚酰亚胺,含有BPDA部分的聚酰亚胺的-CH2-化学位移值都向低场方向移动,δ较大,说明在此类合成的聚酰亚胺中,BPDA部分的吸电子能力特性比BTDA部分强,导致物质的氢谱化学位移值向低场方向移动.
3 小结
综上所述,本研究合成了具有不对称酰胺键邻位侧基修饰的聚酰亚胺,由于Suzuki偶联反应引入的芳基基团对聚酰亚胺分子芳环的各向异性效应,以及二酐单体不同的电荷特性等因素,致使合成的聚酰亚胺的特征峰在核磁氢谱中化学位移存在差异.此外,本研可为聚酰亚胺材料的制备提供参考.

