二斑叶螨为害前后抗、感木薯转录组分析及水杨酸、茉莉酸途径差异表达基因验证
窦宏双 梁晓 陈青 伍春玲 刘迎 范东哲 吴岩



摘 要:本研究通過比较二斑叶螨为害前后抗、感螨木薯品种转录组差异,筛选差异表达基因,并采用qPCR验证水杨酸、茉莉酸信号途径基因的差异表达。转录组分析结果表明,与螨害前相比,螨害1、8 d后,抗螨木薯品种C1115的差异表达基因为589、587个,感螨木薯品种BRA900的差异表达基因为1271、930个,C1115相对于BRA900的差异表达基因分别为383、251个。GO和KEGG富集分析发现这些差异表达基因主要显著集中在次生代谢物质合成、苯丙烷生物合成、类黄酮生物合成和氧化还原反应等过程。qPCR验证结果显示,二斑叶螨为害后,抗螨参照标准木薯品种C1115的水杨酸信号途径基因PAL2、4CL3、WRKY7和NPR3的表达量较为害前呈现先显著提高后降低的趋势,而感螨参照标准木薯品种BRA900中上述4个基因的表达始终维持在显著高于为害前的水平。受螨害后抗螨木薯C1115中茉莉酸信号途径基因JAR1、LOX2和OPR11的表达量也较为害前显著提高,而感螨木薯BRA900中这3个基因的表达量则降低至显著低于螨害前的水平,qPCR验证结果和转录组分析结果相一致。本研究结果表明,抗螨木薯品种C1115受螨害后能够同时激活水杨酸、茉莉酸信号途径以抵御二斑叶螨为害,为深入阐明木薯抗螨分子机理,选育和创制抗螨木薯品种提供了理论参考依据。
关键词:二斑叶螨;抗、感木薯品种;转录组分析;水杨酸信号途径;茉莉酸信号途径
中图分类号:S533 文献标识码:A
Abstract: To the best of our knowledge, there is no report on transcriptome difference while resistant and susceptible cassava cultivars were infested by pests. In this study, by comparing the transcriptome differences of resistant and sus-ceptible cassava cultivars before and after Tetranychus urticae infestation, we screened the differentially expressed genes, and verified the differential expression of salicylic acid and jasmonic acid pathway genes through qPCR. The results of transcriptome analysis showed that there were 589 and 587 differentially expressed genes in mite-resistant cassava cultivar C1115, 1271 and 930 differentially expressed genes in mite-susceptible cassava cultivar BRA900, and 383 and 251 differentially expressed genes between C1115 and BRA900 respectively. In addition, the Go and KEGG enrichment analysis showed that the differentially expressed genes were significantly enriched in the secondary metabolite biosynthesis, phenylpropane biosynthesis, flavonoid biosynthesis and redox related reactions. qPCR verification indicated that after infested by T. urticae for 1 d and 8 d, the transcriptions of salicylic acid signaling pathway genes such as PAL2, 4CL3, WRKY7 and NPR3 in the standard mite-resistant cassava cultivar C1115 were first significantly increased and then decreased, while the expression level of the four genes in the standard mite-resistant cassava cultivar BRA900 was significantly higher than those before infestation. Besides, the transcription of jasmonic acid signal pathway genes like JAR1, LOX2 and OPR11 in C1115 was also significantly higher than those before infestation, while the transcription of the three genes in BRA900 was significantly lower than those before infestation. The results speculated that mite-resistant cassava cultivar C1115 could activate salicylic acid and jasmonic acid signaling pathways to defend T. urticae infestation. This study would lay a theoretical foundation for further elucidating the molecular mechanism of cassava resistance to mite, and for breeding and creating mite-resistant cassava cultivars.
Keywords: Tetranychus urticae; mite-resistant and mite-susceptible cassava cultivars; transcriptome analysis; salicylic acid signaling pathways; jasmonic acid signaling pathways
DOI: 10.3969/j.issn.1000-2561.2021.11.013
木薯(Manihot esculenta Crantz)是全球9亿多人的主粮,同时也是重要的饲料作物、工业原料作物和生物能源[1]。木薯作为“先锋作物”,在我国农业外交和对外科技援助中发挥着举足轻重的作用。我国生产的木薯绝大部分用于制备乙醇,在玉米等粮食作物作为乙醇生产原料供给不足导致燃料乙醇产业遇到瓶颈的形势下,发展“非粮”燃料乙醇已成为世界燃料乙醇技术的发展趋势[2]。2018年8月22日国务院常务会议明确提出坚持加快建设木薯燃料乙醇的项目,木薯产业发展一直受到国家各级管理部门的高度重视[3]。二斑叶螨(Tetranychus urticae Koch)是世界危险性害螨,其寄主多达50科200余种[4-5]。二斑叶螨是为害木薯最严重的四大有害生物之一,严重暴发成灾主要集中在木薯种植后6~8个月左右,此时的木薯地已封行,化学药剂防治困难[6-7]。
培育与利用抗虫品种是国内外公认的最经济、最有效、最简便的一项带有方向性的害虫防治途径[8-9],而阐明作物的抗虫性机理能够为选育抗虫品种提供理论依据。作物抗虫性是多个基因、酶、蛋白和代谢物共同参与调控的结果,具有典型的数量遗传防御效应特征[10],因此,作物抗虫性的形成原因及可能的调控网络机制需要通过多维度、多因素、多级联关系进行考量,而转录组测序分析是开展作物抗虫性机理研究的强有力工具,已广泛应用于多种作物抗虫基因的筛选、挖掘和功能验证。
水杨酸和茉莉酸介导的防御信号途径在作物抗虫性形成过程中发挥着重要作用,在植物受到害虫为害时能激活体内相应的防御基因表达,可以诱导植物产生影响昆虫消化的防御蛋白或对昆虫有毒害作用的次生代谢物质的直接防御[11-13],也可以诱导产生植物释放对昆虫有趋避作用或吸引天敌的挥发物的间接防御[14-15]。当前关于水杨酸和茉莉酸信号途径在拟南芥[16]、烟草[17]等模式植物,水稻[18]、小麦[19]、棉花[20]等大宗经济作物抗虫性的作用机制研究已有较多报道。
当前尚未见害虫为害后抗、感木薯品种转录组差异分析相关报道。因此,本研究通过比较二斑叶螨为害后抗、感螨木薯品种转录组差异,筛选水杨酸、茉莉酸差异表达基因,并通过qPCR验证这两个信号途径关键基因的差异表达,以期初步阐明木薯抗螨性机理,为抗螨木薯品种选育和分子设计育种提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试木薯 本研究选择遗传稳定、健康无病虫的抗螨参照标准木薯品种C1115和感螨参照标准木薯品种BRA900作为供试木薯[3]。C1115和BRA900均由农业农村部国家木薯种质资源圃提供。
1.1.2 供试虫源 二斑叶螨为本实验室以感螨参照标准木薯品种BRA900植株长期继代饲养的室内试验种群。饲养温度为(26±1) ℃,相对湿度为80%。
1.1.3 供试试剂 多糖多酚植物总RNA提取试剂盒购自于天根生化科技(北京)有限公司,cDNA合成试剂盒、去基因组DNA试剂盒购自宝日医生物技术(北京)有限公司,qPCR试剂盒购自于铂尚生物技术(上海)有限公司。琼脂糖、乙醇、氯仿等均为国产分析纯试剂。
1.2 方法
1.2.1 二斑叶螨接种和取样 二斑叶螨接种和取样参照实验室前期建立的方法进行[21],为保证试验材料的一致性和方法的准确性。选取温室种植3个月、长势一致、无病虫的C1115和BRA900健康植株,发育一致的二斑叶螨雌成螨按50头/叶分别接种于抗、感木薯植株中下部3张叶片背面,再用浸润甘油的棉絮包裹住木薯叶柄基部以防止二斑叶螨在叶片间迁移。分别在二斑叶螨接种为害前(0 d,对照)、接种为害后1、8 d采集叶片用于水杨酸、茉莉酸含量测定及RNA提取。每品种设3个重复,每重复取中下部3张叶片(1个重复3张叶片)。
1.2.2 二斑叶螨为害后转录组差异分析 采用1.2.1的方法进行二斑叶螨的接种和木薯叶片取样。取样后的木薯叶片马上放入液氮中粉碎研磨,并取不同处理各0.5 g样品委托北京诺禾致源科技股份有限公司进行转录组数据测定。去除原始数据的接头序列和低质量reads得到clean data。计算Phred数值大于30的碱基占总体碱基的百分比Q30,当这2个数值均大于90%时表示测序的质量良好,能够满足建库的要求。将clean data与木薯参考基因(http://www.cassava-genome.cn/ index.jsp)进行序列比对,获得mapped data。对样品组中的基因表达量进行差异表达、GO(Gene Ontology)功能注释和KEGG(https://www.kegg.jp/ kegg/pathway.html)通路富集分析。在差异表达基因筛选方面,从差异倍数和显著水平2个水平进行评估,阈值设定一般为|log2(Fold Change)|>1且qvalue<0.005。差异基因GO富集分析方面,选择直观反映生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)富集的GO條目上差异基因的个数分布情况,最终挑选富集最显著的30个GO条目作图展示。KEGG富集程度通过rich factor、Q value和富集到此通路上的基因个数来衡量。其中rich factor指差异表达的基因中位于该pathway条目的基因数目与所有有注释基因中位于该pathway条目的基因总数的比值。rich factor越大,表示富集的程度越大。Q value是做过多重假设检验校正之后的P value,Q value的取值范围为[0,1],越接近于零,表示富集越显著,最终挑选富集最显著的20条pathway条目作图展示。
1.2.3 差异表达基因的qRT-PCR验证 以1.2.2转录组分析中筛选出的差异表达的水杨酸、茉莉酸信号途径基因为样本,并结合文献报道,进一步筛选具有指示和标记作用的水杨酸和茉莉酸途径关键差异表达基因进行qPCR验证。采用1.2.1的方法进行二斑叶螨的接种和取样。采用天根公司(TIANGEN)多糖多酚植物总RNA提取试剂盒提取螨害前后的木薯叶片RNA,用Nanodrop和1%琼脂糖凝胶电泳检测RNA的完整性。取去除gDNA后的RNA样品1.0 μg用于cDNA的合成。cDNA样品经无核酸酶水5倍稀释后作为qRT-PCR的模板,分别以木薯Metub为内参基因,相关基因的引物信息如表1所示。qPCR反应条件为:95 ℃预温育1 min后,以40个循环完成如下程序:95 ℃变性15 s,56 ℃退火30 s,72 ℃延伸20 s。分别以来源于未经二斑叶螨为害的木薯叶片cDNA为对照,螨害后的木薯水杨酸、茉莉酸途径基因表达量变化情况以为害前的相对倍数表示,根据Livak等[22]的2-ΔΔCT方法计算而得,每个处理均设置3个重复。
1.3 数据处理
采用SPSS软件进行数据分析,多组数据的显著性差异分析采用One-Way ANOVA-Fisher中的LSD方法,所有数据均为3个生物学重复的平均值,显著性水平为α=0.05。
2 结果与分析
2.1 二斑叶螨为害后转录组差异分析
2.1.1 转录组数据质量评估 由表2可看出,6个处理的18个木薯样品的转录组测序数据总共得到6.93 G的clean data。质量分析结果显示,18个木薯样品Q30碱基百分比分别均超过90.00%,表明18个木薯转录组测序结果的数量与质量都己合格,可进行下一步分析。
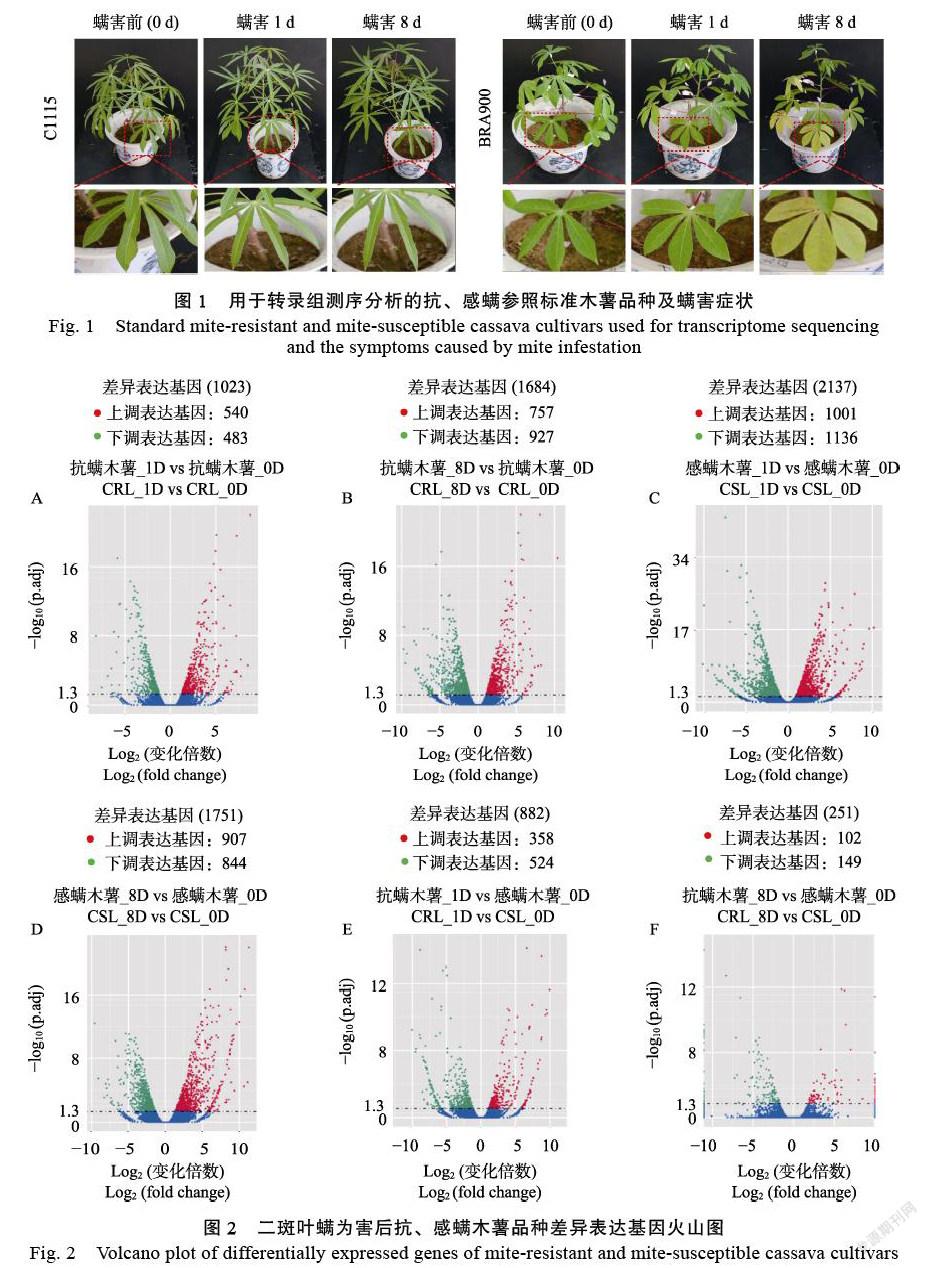
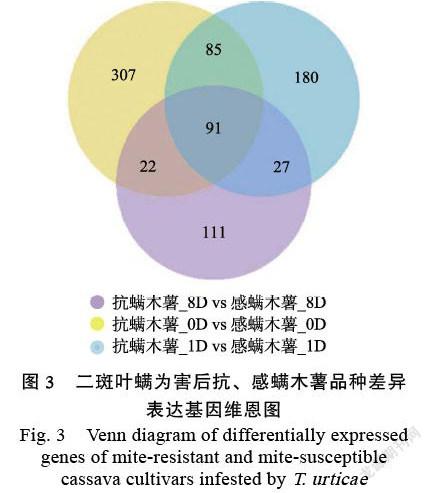
2.1.2 差异表达分析 用于转录组分析的抗、感螨参照标准木薯品种受螨害1、8 d后的症状如图1所示,随螨害时间的延长,感螨参照标准木薯品种BRA900叶片枯黄褪绿的症状越发明显,而抗螨参照标准木薯品种C1115叶片无显著螨害症状。图2结果表明,与为害前(0 d)相比,受二斑叶螨为害1 d后,抗螨木薯C1115共有1023个基因差异表达,其中540个基因上调表达,483个基因下调表达(图2A);为害8 d后共有1684个基因差异表达,其中757个基因上调表达,927个基因下调表达(图2B);与为害前(0 d)相比,受二斑叶螨为害1 d后,感螨木薯BRA900共有2137个基因差异表达,其中1001个基因上调表达,1136个基因下调表达(图2C);为害8 d后共有1751个基因差异表达,其中907个基因上调表达,844个基因下调表达(图2D)。进一步对抗感木薯品种间的转录组差异表达基因分析表明,受二斑叶螨为害1 d后,抗螨木薯相较于感螨木薯品种共有882个基因差异表达,其中358个基因上调表达,524个基因下调表达(图2E);受二斑叶螨为害8 d后,抗螨木薯相较于感螨木薯品种共有251个基因差异表达,其中102个基因上调表达,149个基因下调表达(图2F)。二斑叶螨为害前(0 d)、为害1、8 d后,共同差异表达的基因有91个,其中48個上调表达,43个下调表达(图3)。
2.1.3 差异表达基因的GO及KEGG富集分析 图4结果表明,对于不同样本间的比较,GO的功能注释均集中在生物学过程(biological process)和分子功能(molecular function)这两大类。其中受二斑叶螨为害1、8 d后,抗、感螨木薯品种间在生物学过程中富集差异基因个数最多的均为氧化还原过程(oxidation-reduction process)、单有机体代谢过程(single-organism metabolic process)(1 d)、代谢过程(metabolic process)和碳水化合物代谢过程(carbohydrate metabolic process)(8 d),而为害1、8 d后在分子功能方面富集差异基因个数最多的为氧化还原酶活性(oxidoreductase activity)和催化活性(catalytic activity)。KEGG富集分析方面(图5),抗、感螨木薯品种差异表达基因分别富集到125条和132条,选取的显著富集的20个条目中,与作物抗虫性关系最密切的通路有次生代谢物质生物合成(biosynthesis of secondary metabolites)、苯丙烷生物合成(phenylpropanoid biosynthesis)、类黄酮生物合成(flavonoid biosynthesis)。
2.2 抗、感螨木薯品种被二斑叶螨为害后差异表达基因的qPCR验证
2.2.1 用于qPCR验证的水杨酸、茉莉酸信号途径基因的筛选 在通过转录组分析获得的二斑叶螨为害后木薯水杨酸、茉莉酸信号途径差异表达基因的基础上,进一步参考前人研究已经明确的具有指示和标记作用的2个信号途径关键基因,最终筛选了木薯水杨酸信号途径基因PAL2、4CL3、WRKY7、NPR3和茉莉酸信号途径JAR1、LOX2和OPR11作为qPCR验证的基因(表2)。
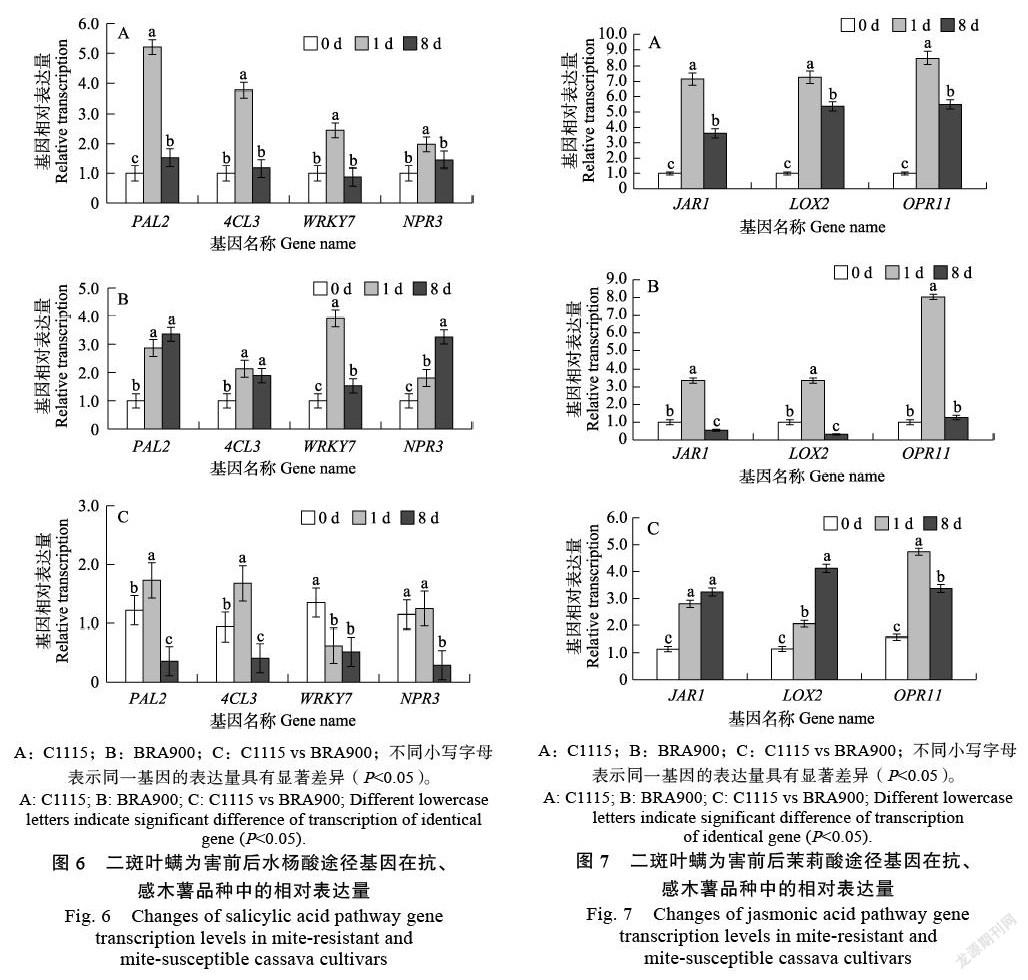
2.2.2 二斑叶螨为害后水杨酸信号途径差异表达基因qPCR验证 图6A结果表明,抗螨参照标准木薯品种C1115水杨酸信号途径基因PAL2、4CL3、WRKY7和NPR3的表达量表现出随螨害时间延长而显著降低的趋势,其中螨害1 d后表达量达到峰值,4个基因表达量分别为螨害前(0 d)的5.11、3.74、2.40、1.92倍。而感螨参照标准木薯品种BRA900上述4个基因的表达量在螨害后均维持在显著高于螨害前的水平(P<0.05)(图6B)。在同一螨害时间内,相对于BRA900,C1115中PAL2、4CL3和NPR3基因的表达量在螨害1 d时显著上调,而在螨害8 d时显著下调(图6C),这与转录组分析的基因差异表达结果具有一致性。
2.2.3 二斑叶螨为害后茉莉酸信号途径差异表达基因qPCR验证 图7A结果表明,抗、感螨参照标准木薯品种被二斑叶螨为害后,茉莉酸信号途径基因的表达量变化趋势并不完全一致。抗螨木薯C1115受螨害后,茉莉酸信号途径基因JAR1、LOX2和OPR11的表达量与螨害前相比均显著提
高(P<0.05),表达量的最高值均出现在螨害后1 d,分别达到了螨害前的7.16、7.28、8.50倍,随螨害时间的延长,表达量均表现出下降的趋势。而感螨木薯BRA900受螨害后,上述3个基因的表达量也随着螨害时间的延长逐渐降低,并且螨害8 d后JAR1和LOX2的表达量显著降低至低于螨害前的水平(P<0.05)(图7B)。此外,螨害前,抗螨品种C1115中JAR1、LOX2和OPR11的表达量仅分别为感螨品种BRA900的1.15倍、1.14倍和1.57倍,而受螨害1 d和8 d后,上述3个基因在C1115中的表达量均显著高于BRA900(P<0.05)(图7C)。上述茉莉酸信号途径基因qPCR验证的结果与转录组分析的差异表达情况基本一致。
3 讨论
转录组分析结果表明,与未受螨害之前相比,随着螨害时间的延长,抗螨木薯品种C1115的差异表达基因数基本保持不变,而感螨木薯品种BRA900的差异表达基因数则显著下降,并且抗螨木薯相对于感螨木薯的差异表达基因也呈现出随螨害时间延长而显著下降的趋势。推断抗螨木薯品种在螨害期间能够稳定激活自身的防御反应,而感螨木薯品种因螨害后植株严重受损,体内的多个生化反应可能停止或被抑制。这在烟粉虱为害抗感棉花品种[30]、枕叶盲蝽为害抗感水牛草品种[31]的转录组分析中也能观察到与本研究相类似的结果。差异表达基因的GO和KEGG富集分析结果表明,差异表达基因主要富集在次生代谢物质合成、苯丙烷生物合成、类黄酮生物合成和氧化还原相关反应方面,而这些生物学过程又与作物抗虫性息息相关,尤其是苯丙烷合成通路的激活是启动水杨酸信号途径的关键[32],而植物内源茉莉酸亦能够激活类黄酮生物合成途径[33]。因此本研究转录组分析的结果可以总体上大致反映抗、感螨木薯品种抗性差异的分子基础。
水杨酸和茉莉酸途径是植物抵御害虫、病原菌和病毒等有害生物入侵过程中研究最广泛的2条防御信号途径。因此,本研究从转录组分析获得的差异表达基因中选择了具有代表性的指示和标记基因PAL2、4CL3、WRKY7、NPR3(水杨酸途径)和JAR1、LOX2、OPR11(茉莉酸途径)做进一步的qPCR验证。结果表明,上述基因在转录组分析中的差异表达情况和qPCR验证的结果基本一致,并且qPCR分析结果还显示2个途径基因的表达量变化取食并不一致。许多研究表明,双子叶植物中JA和SA防御信号途径既有相互拮抗[34-35],也存在相互协同[36-37],这2个信号途径之间表现出何种相互作用模式和害虫和作物的种类有关。一些研究表明刺吸式昆虫为害后可诱导水杨酸信号途径的激活,而抑制茉莉酸信号途径。如烟粉虱为害利马豆和拟南芥后,植物内源水杨酸含量及其调控的防御基因的表达量均增加,同时抑制内源茉莉酸含量及其调控的防御基因的表达[38]。B型烟粉虱能够诱导拟南芥的水杨酸途径基因并抑制茉莉酸途径基因的表达[39]。烟粉虱为害番茄后,主要诱导水杨酸防御反应,同时抑制茉莉酸防御反应,如何瑜晨[34]研究测定了茉莉酸信号路径上LOX-D基因的表达情况,结果表明,LOX-D在烟粉虱为害12 h时其表达量显著增加,但随着为害时间延长,其表达量逐渐降低,并恢复到对照水平。也有研究表明,刺吸式害虫为害能同时激活植物的水杨酸和茉莉酸途径。如姚新建[40]研究发现抗性小麦品系35-E4和敏感品系35-A20被禾谷缢管蚜为害后,其水杨酸和茉莉酸信号转导途径中相关基因(PAL、LOX、NPR)的表达量均显著提高,但是表达模式存在差异,抗性品系35-E4中相关基因的表达量高于敏感品系35-A20。张羽宇等[41]研究发现西花蓟马为害能显著诱导菜豆植株茉莉酸和水杨酸信号转导途径相关防御酶基因LOX,PAL和PR-2的表达,并在菜豆植株不同部位葉片产生系统抗性。赵丽艳[42]研究发现,蚜虫为害既激活了水杨酸信号途径基因如PAL、4CL的表达,也激活了茉莉酸信号途径基因LOX的表达。上述研究表明不同刺吸式口器害虫为害不同寄主植物后,SA和JA介导的防御反应却显著不同。本研究结果表明,二斑叶螨为害后抗螨木薯C1115和感螨木薯BRA900后水杨酸信号途径基因PAL2、4CL3、WRKY7和NPR3均能够被显著诱导,而抗、感木薯中,茉莉酸信号途径基因JAR1、LOX2和OPR11的表达量在为害早期(1 d)均较为害前显著提高。然而随着为害时间的延长,上述3个基因的表达量虽然在抗螨木薯C1115中逐渐降低,但依然维持在显著高于螨害前的水平,而在感螨木薯BRA900中这3个基因的表达量降低至显著低于螨害前的水平,一方面说明二斑叶螨可能采取了和烟粉虱相同的为害策略,即通过诱导水杨酸途径,抑制茉莉酸途径达到为害感螨木薯的目的,而抗螨木薯的茉莉酸途径均能被诱导产生防御反应免于受害。
本研究从转录组分析、水杨酸、茉莉酸途径关键差异表达基因的qPCR验证角度初步解析了抗、感木薯品种存在抗性差异的可能原因,但仅从基因表达层面仍不能充分阐明木薯的抗螨性机理,后续研究可采用多组学联合分析的深入探讨基因-蛋白-代谢物的共表达调控网络,挖掘并验证关键抗虫基因的功能,以期系统全面阐明木薯品种的抗螨性机理。
参考文献
[1] 欧文军, 韦卓文, 梁海波, 等. 推动中非木薯科技合作 服务国家“一带一路”战略[J]. 中国热带农业, 2016(4): 9-12.
[2] 王 霞, 陈迪嘉, 叶广英, 等. 我国非粮作物燃料乙醇技术与产业发展现状[J]. 新能源进展, 2014, 2(2): 89-93.
[3] Chen Q, Liang X, Wu C L, et al. Density threshold-based acaricide application for the two-spotted spider mite Tetra-nychus urticae on cassava: from laboratory to the field [J]. Pest Management Science, 2019, 75(10): 2634- 2641.
[4] 匡海源. 農螨学[M]. 北京: 农业出版社, 1986.
[5] 程立生. 应重视二斑叶螨在我国的传播危害[J]. 植物保护, 1999, 25(4): 57-58.
[6] 张 钧. 国外木薯害虫研究概况[J]. 热带作物研究, 1982, 2(4): 81-87.
[7] 陈 青, 梁 晓, 伍春玲, 等. 木薯抗螨种质资源挖掘与创新利用研究进展[C]//2019年全国热带作物学术年会论文集. 西安, 2019: 337.
[8] Painter R H. Insect resistance in crop plants[J]. 1951, 72(6): 481.
[9] 钦俊德, 王琛柱. 论昆虫与植物的相互作用和进化的关系[J]. 昆虫学报, 2001, 44(3): 360-365.
[10] Stotz H U, Pittendrigh B R, Kroymann J, et al. Induced plant defense responses against chewing insects. ethylene signaling reduces resistance of Arabidopsis against Egyptian cotton worm but not diamondback moth[J]. 2000, 124(3): 1007-1018.
[11] Sabelis M W, Janssen A, Kant M R. The enemy of my ene-my is my ally[J]. Science, 2001, 291(5511): 2104-2105.
[12] Liechti R. The jasmonate pathway[J]. Science, 2002, 296 (5573): 1649-1650.
[13] 尹 姣, 陈巨莲, 曹雅忠, 等. 茉莉酸诱导小麦抗病虫性初步研究[J]. 植物保护, 2005(4): 36-38.
[14] 吕要斌, 刘树生. 外源茉莉酸诱导植物反应对菜蛾绒茧蜂寄生选择行为的影响[J]. 昆虫学报, 2004, 47(2): 206-212.
[15] 冯远娇, 王建武, 骆世明. 外源茉莉酸处理地下部对玉米化学防御反应影响的时间和浓度效应[J]. 应用生态学报, 2009, 20(8): 1883-1890.
[16] Phuong L T, Fitrianti A N, Luan M T, et al. Antagonism between SA- and JA-signaling conditioned by saccharin in Arabidopsis thaliana renders resistance to a specific patho-gen[J]. Journal of General Plant Pathology, 2020, 86(2): 86-99.
[17] Xu H X, Qian L X, Wang X W, et al. A salivary effector enables whitefly to feed on host plants by eliciting salicylic acid-signaling pathway[J]. PNAS, 2019, 116(2): 490-495.
[18] Yonny M E, Ballesteros-Gómez A, Toscano Adamo M L, et al. Supramolecular solvent-based high-throughput sample treatment for monitoring phytohormones in plant tissues[J]. Talanta, 2020, 219: 121249.
[19] El-Wakeil N E, Volkmar C, Sallam A A. Jasmonic acid induces resistance to economically important insect pests in winter wheat[J]. Pest Management Science, 2010, 66(5): 549-554.
[20] Guo Q, Zhao L, Fan X Q, et al. Transcription factor GarWRKY5 is involved in salt stress response in diploid cotton species (Gossypium aridum L.)[J]. International Journal of Molecular Sciences, 2019, 20(21): 5244.
[21] Lu F P, Liang X, Lu H, et al. Overproduction of superoxide dismutase and catalase confers cassava resistance to Tetra-nychus cinnabarinus[J]. Scientific Reports, 2017, 7(1): 1-13.
[22] Livak K J, Schmittgen T D. Analysis of relative gene ex-pression data using real-time quantitative PCR and the 2–ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
[23] 温 娟, 郅军锐, 吕召云, 等. 二斑叶螨为害对番茄叶片主要营养物质和防御酶活性的影响[J]. 环境昆虫学报, 2017, 39(1): 172-180.
[24] 任倩倩. 抗、感茶树品种对茶小绿叶蝉取食诱导的防御反应[D]. 福州: 福建农林大学, 2020.
[25] Kim K C, Fan B F, Chen Z X. Pathogen-induced Arabidop-sis WRKY7 is a transcriptional repressor and enhances plant susceptibility to Pseudomonas syringae[J]. Plant Physiology, 2006, 142(3): 1180-1192.
[26] Ding Y L, Sun T J, Ao K, et al. Opposite roles of salicylic acid receptors NPR1 and NPR3/NPR4 in transcriptional reg-ulation of plant immunity[J]. Cell, 2018, 173(6): 1454- 1467.
[27] Staswick P E, Tiryaki I, Rowe M L. Jasmonate response locus JAR1 and several related Arabidopsis genes encode enzymes of the firefly luciferase superfamily that show ac-tivity on jasmonic, salicylic, and indole-3-acetic acids in an assay for adenylation[J]. Plant Cell, 2002, 14(6): 1405-1415.
[28] 呂 敏, 苏建坤, 白和盛, 等. 桃蚜取食和机械损伤对番茄和辣椒PAL、LOX和PPO活性的诱导作用[J]. 江苏农业学报, 2016, 32(6): 1273-1279.
[29] 张海波. 烟粉虱Bemisia tabaci (Gennadius)取食及外源JA处理对辣椒(Capisicum annuum L.)内源JA、SA的影响[D]. 扬州: 扬州大学, 2018.
[30] Li J Y, Zhu L Z, Hull J J, et al. Transcriptome analysis reveals a comprehensive insect resistance response mechanism in cotton to infestation by the phloem feeding insect Bemisia tabaci (whitefly)[J]. Plant Biotechnology Journal, 2016, 14(10): 1956-1975.
[31] Postnikova O A, Hult M, Shao J, et al. Transcriptome analysis of resistant and susceptible alfalfa cultivars infected with root-knot nematode Meloidogyne incognita[J]. PLoS One, 2015, 10(2): e0118269.
[32] Boba A, Kostyn K, Kostyn A, et al. Methyl salicylate level increase in flax after Fusarium oxysporum infection is asso-ciated with phenylpropanoid pathway activation[J]. Frontiers in Plant Science, 2017, 7: 1951.
[33] Gadzovska S, Maury S, Delaunay A, et al. Jasmonic acid elicitation of Hypericum perforatum L. cell suspensions and effects on the production of phenylpropanoids and naphto-dianthrones[J]. Plant Cell, Tissue and Organ Culture, 2007, 89(1): 1-13.
[34] 何瑜晨. 茉莉酸及水杨酸信号路径在番茄防御烟粉虱中的作用研究[D]. 杭州: 中国计量大学, 2017.
[35] Agut B, Gamir J, Jaques J A, et al. Tetranychus urticae -triggered responses promote genotype-dependent conspe-cific repellence or attractiveness in Citrus[J]. New Phytology, 2015, 207(3): 790-804.
[36] Niki T, Mitsuhara I, Seo S, et al. Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related (PR) protein genes in wounded mature tobacco leaves[J]. Plant & Cell Physiology, 1998, 39(5): 500-507.
[37] Koornneef A, Pieterse C M J. Cross talk in defense signal-ing[J]. Plant Physiology, 2008, 146(3): 839-844.
[38] Zhang P J, Zheng S J, Van Loon J J A, et al. Whiteflies interfere with indirect plant defense against spider mites in Lima bean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(50): 21202-21207.
[39] Zarate S I, Kempema L A, Walling L L. Silverleaf whitefly induces salicylic acid defenses and suppresses effectual jasmonic acid defenses[J]. Plant Physiology, 2007, 143(2): 866-875.
[40] 姚新建. 13個小麦种质对两种蚜虫的抗性机理与抗蚜基因的验证及研究[D]. 杨凌: 西北农林科技大学, 2018.
[41] 张羽宇, 郅军锐, 刘 勇, 等. 西花蓟马取食对菜豆不同部位叶片防御基因表达的影响[J]. 昆虫学报, 2017, 60(1): 1-8.
[42] 赵丽艳. 麦长管蚜取食为害诱导小麦防御反应的生化及分子机制[D]. 北京: 中国农业科学院, 2006.
责任编辑:黄东杰

