绿色荧光碳点在活细胞中Fe3+检测的应用
石利红,董晓芮,张国梅,张彩红,张彦
(山西大学 化学化工学院,山西 太原 030006)
0 引言
碳点(CDs)是一种新型的零维碳纳米材料,是一种具有准球形形貌和纳米级特征尺寸(<10 nm)的纳米颗粒[1]。2004 年 Xu[2]等人在制备单壁碳纳米管时发现碳点是一种副产物,从此碳点的研究取得了迅速的进展,2006年对其进行了第一次合成。相对于传统量子点,碳点具有一系列优越的特性,如良好的水溶性、优异的稳定性、低毒性、易于功能化等,这些卓越的特性使其广泛应用于如光催化[3-4]、生物成像[5-7]、离子检测[8-12]、指纹检测[13-14]、纳米医学[15-18]、传感[19-21]等诸多领域。
目前,碳点的合成方法有很多,包括激光烧蚀[22-23]、电弧放电[24]、电化学氧化[25]、热解[26-27]、模板合成法[28]等。尽管合成方法种类繁多,但它们普遍存在操作过程复杂、成本高、条件苛刻、难于控制等不可忽略的缺陷。水热法[29]是一种起步较晚但广泛使用的方法,它有效地克服了以上劣势,显示出操作简便、易于控制、绿色环保等优点。
铁是人体内不可缺少的微量元素,是血红蛋白的主要原料之一,可以在血液中运输氧和营养物质,对人体许多生理过程都有着至关重要的作用。铁摄入过量或不足都会对人体产生不利影响。例如,人体缺铁会导致缺铁性贫血、免疫功能下降、新陈代谢紊乱等;铁摄入过多容易导致人体组织损伤,还易诱发糖尿病、色素沉着等症状。因此,探索高效可靠的检测Fe3+的方法对人类生命健康尤为重要。目前测定铁离子的方法包括荧光光谱法、分子吸收光谱法、高效液相色谱法、电化学法等。近几年,碳点由于其具有优异的性能而被研究者广泛用于检测铁离子[30-32]。
本文以金银花为碳源采用一步水热法合成了绿色荧光碳点。以金银花作为碳源的优势在于原料廉价易得,绿色环保。此外,该原料含有碳、氢、氧等元素,满足了合成荧光碳点的需求。实验采用的方法简便易操作,获得的碳点具有良好的亲水性和生物兼容性,对Fe3+具有高的选择性和灵敏度,能用于水溶液和活细胞中Fe3+的检测。
1 实验部分
1.1 主要试剂与仪器
金银花(山西,中国);AlCl3、AgCl、BiCl3、Ca-Cl2、CdCl2、CuCl2、FeCl3、CoCl2、HgCl2、KCl、MgCl2、MnCl2、NaCl、NiCl2、ZnCl2、Pb(NO3)2、NaF、NaBr、NaI、Na2CO3、NaNO3、NaNO2、Na3PO4、Na2S2O3、Na2SO3、Na2SO4(均购自北京化工股份有限公司);Tris(购自广州赛国生物科技有限公司);罗丹明6G(购自E.Merck,Darmatadt公司)。实验中,一切药品和试剂均为分析纯,实验用水为去离子水。
紫外-可见分光光度计(TU-1901,北京);原子力显微镜(Multimode 8,德国Brucker);高分辨透射电子显微镜(JEM-2100,日本电子);荧光分光光度计(F-280,天津港东);傅里叶变换红外光谱仪(Nicolet iS50,美国尼高力);激光共聚焦显微镜(LSM880,德国Zeiss)。
1.2 实验过程
1.2.1 碳点的制备
首先称取0.5 g金银花并研磨成粉末,然后将其与20 mL二次水混合摇匀,随后将混合溶液密封在30 mL高压反应釜中,在220℃下保持水热反应5 h,待冷却后,将悬浮液离心(4 000 r/min)20 min,取上清液用截留分子量为500 Da~1 000 Da的透析袋透析12 h,最终制得绿色荧光碳点溶液作为储备液。
1.2.2 碳点的光谱性能测定
碳点的荧光性能主要通过荧光分光光度计进行测定,主要步骤是将100 μL的碳点储备液分散于500 μL pH=7.3 的Tris-HCl缓冲液中,测定在不同激发波长下的发射光谱。
碳点的吸收光谱主要通过紫外-可见分光光度计进行测定,它可以对碳点的结构和性能进行辅助分析,有助于探究其发光机理,主要步骤是用pH=7.3的Tris-HCl缓冲液作为参比,将碳点储备液分散到缓冲液中,扫描测量其吸光度。
1.2.3 碳点的表征
碳点的形貌和粒径主要通过透射电子显微镜(TEM)和原子力显微镜(AFM)进行表征,主要操作是先将碳点溶液进行一定的稀释,然后滴加到铜片和云母片上,自然风干,最后在相应的显微镜下观察。
碳点的结构特征通过傅立叶变换红外(FTIR)和拉曼光谱(Raman)进行表征,将碳点溶液冷冻干燥得到固体样品后在相应的仪器下进行一系列操作即可。
1.2.4 碳点的荧光寿命的测定
荧光寿命是粒子返回基态之前在激发态停留的时间,以ns计量。荧光寿命(τ)由荧光衰减曲线进行估算,荧光衰减曲线通过对方程Y(t)=B1exp(-t/τ1)+B2exp(-t/τ2)进行拟合而成,由此可知碳点的荧光寿命。
1.2.5 荧光测定Fe3+
室温下,取100 μL的碳点储备液分散于500 μL pH=7.3的Tris-HCl缓冲液中,分别加入不同浓度的Fe3+标准溶液,反应30 s后记录其荧光发射光谱。
1.2.6 体外活细胞成像实验
以人类肝癌细胞(SMMC-7721)为模型,采用MTT毒性实验,评估所制备的碳点的细胞毒性。将等量的浓度范围为0.1 mg/mL~0.6 mg/mL的碳点溶液分别加入培养液中,并在37℃下恒温培养1 h,测定细胞存活率。基于此,在37℃下,将SMMC-7721细胞置于含有5%的CO2辅以10%胎牛血清的DMEM的培养基中孵育,然后将碳点溶液(500 μL,0.15 mg/mL)添加到1.0 mL培养基中,30 min后,用0.25%胰蛋白酶-0.020%EDTA对混合液中的细胞进行消化收集,并用pH=7.3 Tris-HCl缓冲液缓慢洗涤3次后,加入Fe3+(10 μL,0.1 mol/L)处理1 min,在激光共聚焦显微镜下观察并收集图像。
2 实验结果与讨论
2.1 绿色荧光碳点的制备
如图1所示,以金银花为原料,通过一步水热法成功合成了分布均匀的绿色荧光碳点。该方法避免了烦琐复杂的程序,简单快速,并且在一定温度和压力的密闭环境中,可以在形成碳点的同时在其表面引入一些有机官能团,从而实现制备和修饰的一体化。
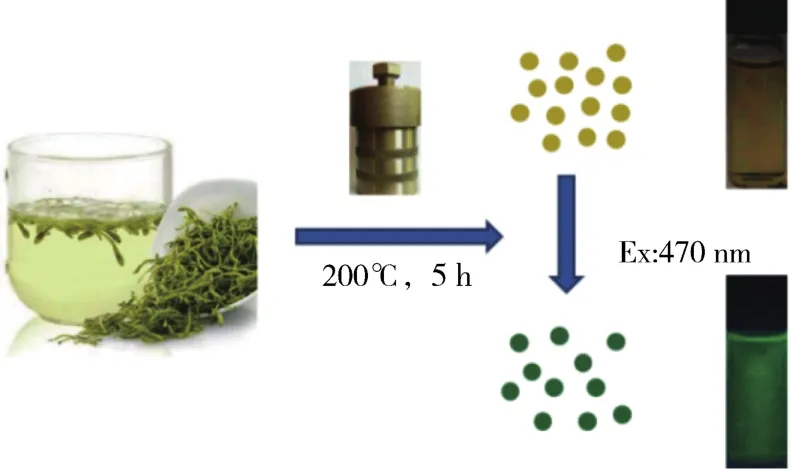
图1 金银花通过水热法合成碳点的示意图Fig.1 Diagram for the synthesis of CDs from hydrothermal treatment of honeysuckle,along with photographs of the corresponding samples under daylight and 470 nm excitation
2.2 碳点的表征
2.2.1 粒径和形貌表征
为了清楚地了解碳点的形貌及尺寸,采用TEM对其进行了表征。从图2中可以看出该碳点呈准球形、分散良好、尺寸相对均一。通过对50个碳点的粒径进行统计分析得出:该绿色荧光碳点的粒径集中分布在2.0 nm~4.5 nm区间内,平均粒径为(3.10±0.47)nm。
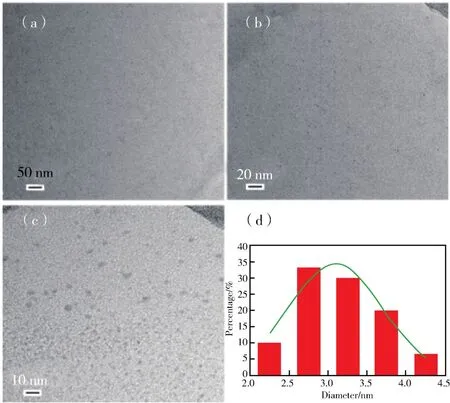
图2 (a-c)碳点在不同比例尺下的TEM图;(d)碳点的粒径分布Fig.2 (a-c)TEM images of CDs under different magnifications;(d)Size distribution of CDs
采用AFM进一步表征了该碳点的高度分布及形貌特征,表征结果如图3所示。图3a和3b充分地显示出碳点良好的分散性。图3d显示该碳点的高度主要分布在3.0 nm~4.0 nm范围内,颗粒高度约为3.5 nm,与透射电镜分析结果基本一致。
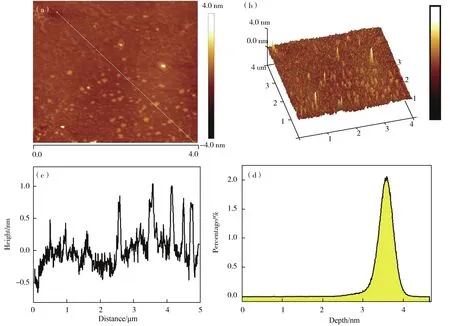
图3 (a)碳点的AFM平面图。(b)碳点的AFM三维图。(c)平面图中直线碳点的高度分布。(d)碳点的高度分布图Fig.3 (a)AFM flat view of CDs.(b)AFM 3D image of CDs.(c)The height profile on straight line in flat view.(d)The height distribution of CDs
2.2.2 结构表征
使用傅立叶变换红外(FTIR)光谱对该碳点的表面官能团进行了深入的分析。图4a是碳点的FTIR谱图,其中3 210 cm-1处的吸收代表O-H的伸缩振动,位于2 916 cm-1的吸收是C-H的反对称伸缩振动;1 760 cm-1和1 662 cm-1处的吸收都归因于C=O的伸缩振动;1 569 cm-1处的吸收是N-H的面内弯曲;1 400 cm-1处的吸收与-OH的面内弯曲相吻合;1 047 cm-1处的特征吸收峰是由于=C-O-C的伸缩振动引起的;O-H的面外弯曲对应红外谱图中920 cm-1处的弱吸收。由以上一系列分析可得:合成的碳点表面存在羟基、羧基和氨基。
图4b是碳点的拉曼光谱图,其中位于1 383 cm-1处的D带和位于1 528 cm-1处的G带分别与碳原子的sp3和sp2杂化相关。根据谱图可计算得出IG/ID≈1.54,说明碳点是一种类石墨结构。
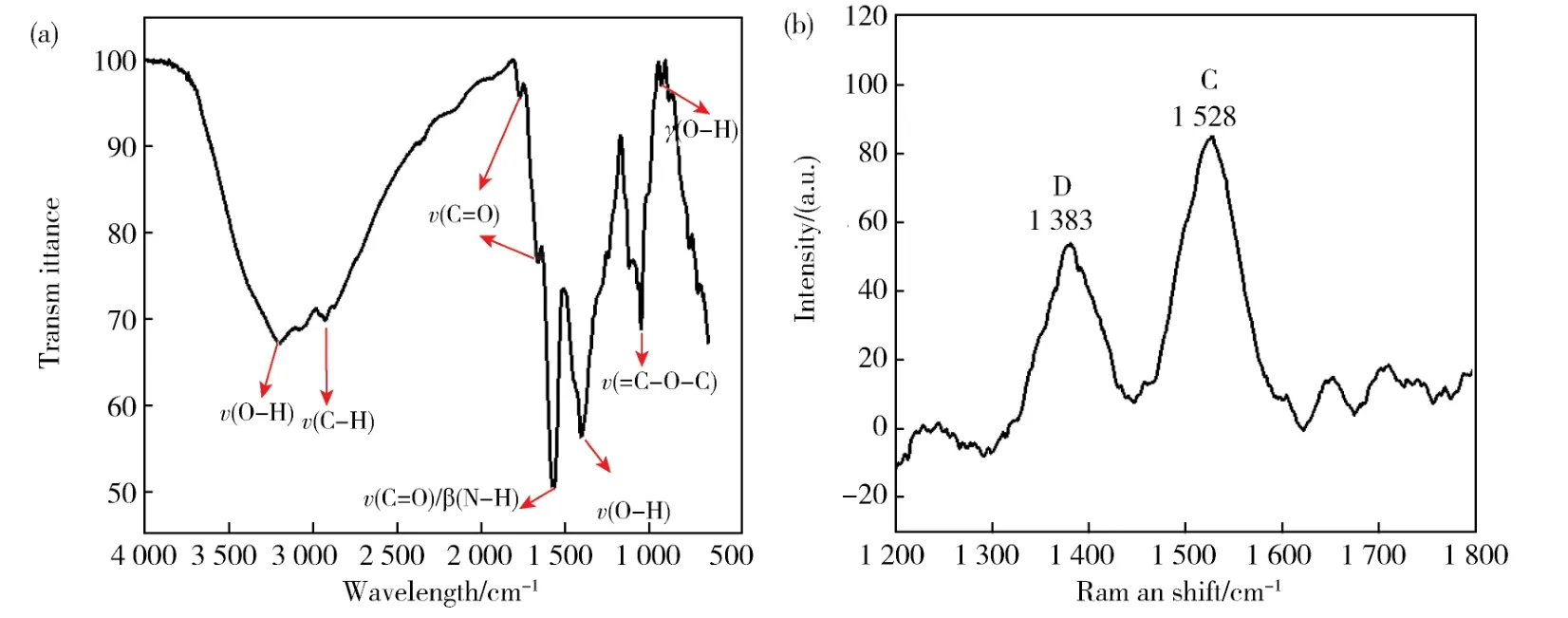
图4 (a)碳点的红外谱图。(b)碳点的拉曼谱图Fig.4 (a)FTIR spectrum of CDs.(b)Raman spectrum of CDs
2.2.3 碳点的光学性质
图5a是碳点的荧光光谱和紫外吸收光谱。紫外吸收光谱中处于268 nm处的弱吸收,可能来源于碳核中C=C的π-π*跃迁;图5b显示,随着激发波长的增加,碳点的荧光强度呈现先增加后减弱的趋势,荧光峰位置发生红移,表现出激发依赖的特性。在激发波长为470 nm时,碳点的荧光强度最强。因此选择470 nm为最佳激发波长,对应的最强发射峰位于523 nm。此外,选用罗丹明6G为参照物,计算其相对量子产率为1.5%。
2.2.4 pH、响应时间对碳点荧光强度的影响
通过测定在不同pH下碳点的荧光强度来进一步了解该碳点的稳定性。从图6a可以看出碳点的荧光强度随pH的增加稍有降低。同时,我们还研究了激发时间和贮存时间对碳点荧光强度的影响。如图6b所示,在470 nm下对碳点持续激发160 min,其荧光强度稍有降低。从图6c可以看出,碳点在室温下贮存600 min后,荧光强度仍然保持稳定。这些实验结果证明该碳点具有高稳定性,有利于其在实际中的应用。
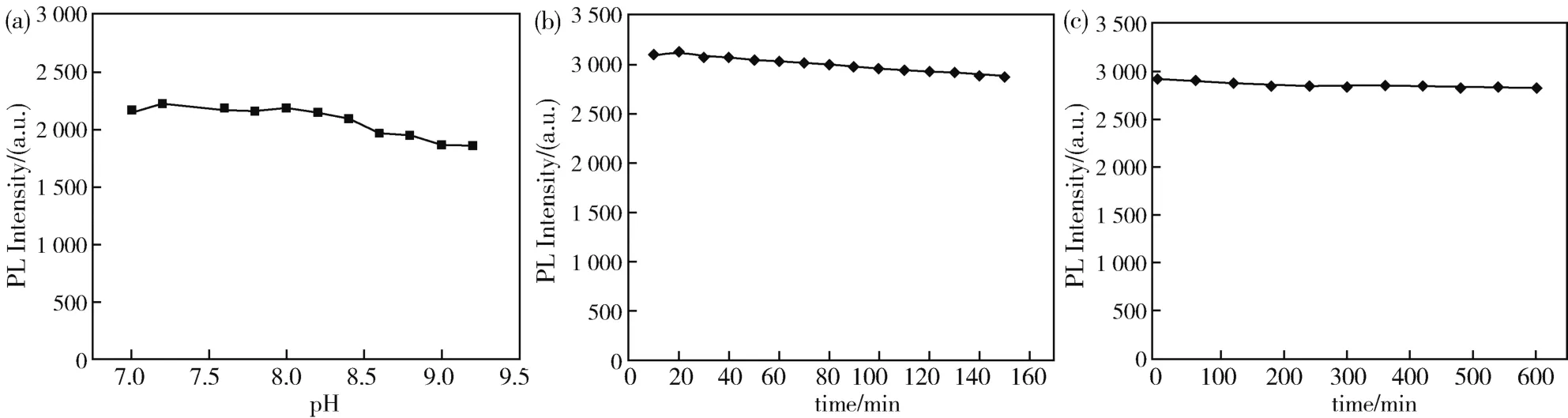
图6 (a)pH对碳点荧光强度的影响;(b)激发时间对碳点荧光强度的影响;(c)贮存时间对碳点荧光强度的影响Fig.6 (a)Effect of pH on the PL intensity of CDs;(b)Effect of excitation time on the PL intensity of CDs;(c)Effect of storage time on the PL intensity of CDs
2.3 离子检测
实验探究了在pH=7.3的Tris-HCl缓冲液中,该碳点对外部各种阴离子和阳离子的刺激响应,结果如图7a。在众多的外部阴、阳离子中,只有Fe3+会明显抑制该碳点的荧光。如图7b所示,随着Fe3+浓度从 0.05 μmol/L~400 μmol/L 逐渐增大,该碳点的荧光强度逐渐减弱,说明Fe3+对该碳点的荧光抑制作用越来越明显。这可能归因于碳点表面含有羧基和氨基,羧基上的O和氨基上的N拥有孤对电子。Fe3+包含空价轨道。因此,羧基上的O和氨基上的N与Fe3+发生配位作用,引起了能量或者电子转移,导致了明显的荧光猝灭。图7c表明在0.05 μmol/L~400 μmol/L区间内,Fe3+和该碳点表现出两段不错的线性响应,分别是0.05 μmol/L~50 μmol/L 和 75 μmol/L~325 μmol/L,其线性关系分别为Y=-0.005 26X+0.939 97(R2=0.991 7)和Y=-0.001 3X+0.697 74(R2=0.993 2),检测限为0.032 μmol/L。如表1所示,与以往报道过的Fe3+探针相比,该探针检测的线性范围更宽,检测灵敏度更高。图7d表明,加入Fe3+前后,该碳点的荧光寿命分别为9.719 2 ns和9.908 2 ns,二者比较接近,这表明Fe3+猝灭该碳点的过程是静态猝灭,可能是由于Fe3+和碳点表面含氧基团相互作用,形成比较稳定的非荧光络合物而造成的。
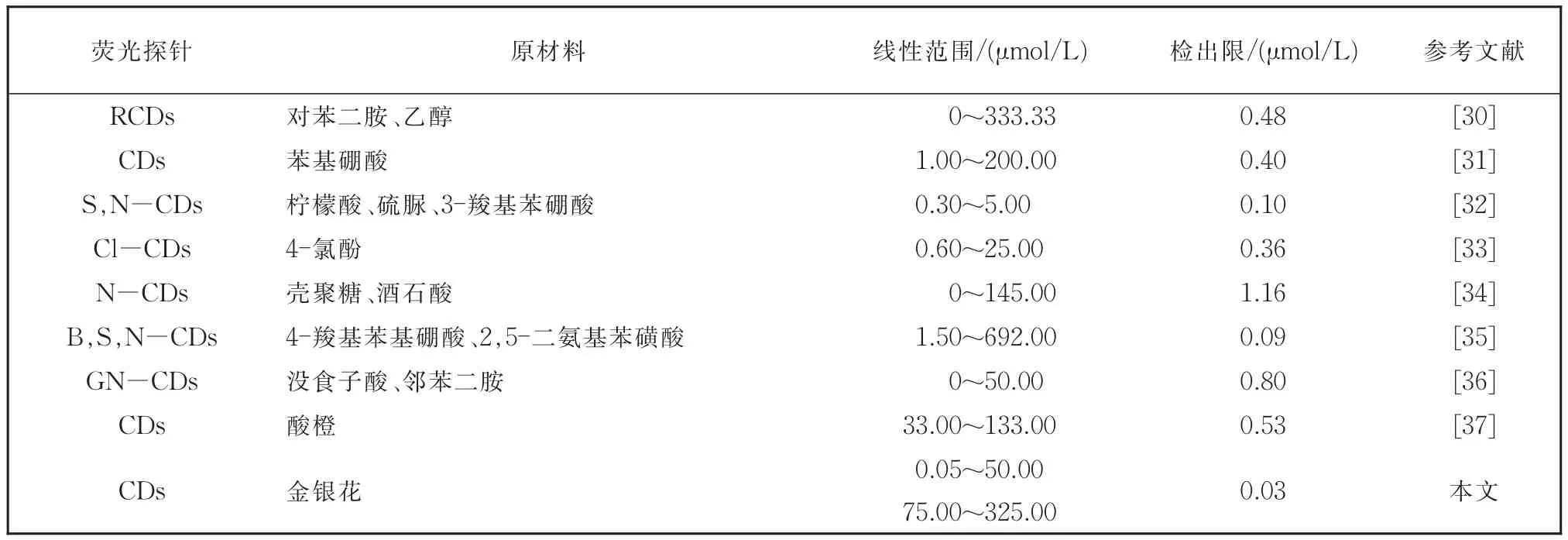
表1 与以往报道的不同荧光探针对Fe3+检测的比较Table 1 Comparison of previously reported different CDs based probes for Fe3+detection

图7 (a)在pH=7.3,470 nm激发下不同金属离子对碳点荧光强度的影响。(b)不同浓度Fe3+(0.05 μmol/L~400 μmol/L)对碳点荧光强度的影响。(c)F/F0和Fe3+浓度之间的关系。(d)加入Fe3+前后碳点的荧光寿命曲线。Fig.7 (a)Selectivity of CDs solution for Fe3+over other ionic species at pH=7.3 condition at 470 nm excitation.(b)Representative fluorescence emission spectra of CDs in the presence of Fe3+(0.05 μmol/L-400 μmol/L).(c)The relationship between F/F0and Fe3+concentration(0.05 μmol/L-50 μmol/L and 75 μmol/L-325 μmol/L).(d)The fluorescence decay of CDs and CDs/Fe3+
2.4 细胞成像及细胞中Fe3+传感
为了确保碳点可以应用于生物体细胞或组织当中,选用SMMC-7721细胞,采用MTT实验,评估了该碳点的细胞毒性。实验结果如图8,当碳点浓度达到0.6 mg/mL时,约有70%的细胞存活下来,这意味着该碳点毒性很低,为细胞在生物荧光成像应用中提供了良好的保障。
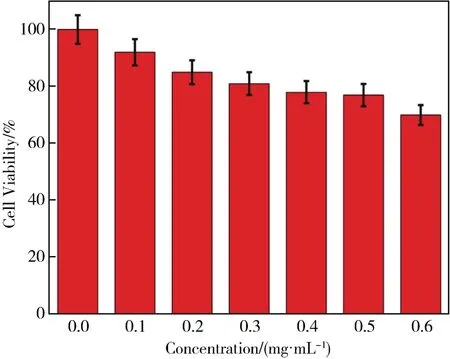
图8 碳点对SMMC-7721细胞的毒性效应Fig.8 Cytotoxic effect of CDs obtained on SMMC-7721 cells
为了探究该碳点在活细胞内的荧光标记用途,我们用该碳点对SMMC-7721细胞进行了孵育。如图9所示,在激光共聚焦显微镜下,观测到碳点能够有效地进入到细胞质中,对细胞进行标记。
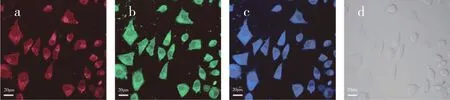
图9 碳点标记的SMMC-7721细胞的激光共聚焦图像分别用(a)514 nm激光激发,(b)488 nm激光激发和(c)405 nm激光激发.(d)明场Fig.9 LSCM images of SMMC-7721 cells treated with obtained CDs under(a)514 nm excitation,(b)488 nm excitation and(c)405 nm excitation.(d)bright field
此外,我们还设计了Fe3+的细胞内传感。由于人工培养的SMMC-7721细胞中不含游离的Fe3+,为了更好地检测活细胞中Fe3+的波动,从而验证其在生物领域中的实用性,因此需要在细胞中外加Fe3+。如图10所示,在被该碳点染色的SMMC-7721细胞中加入Fe3+,发现在加入Fe3+50 s内,活细胞中的荧光强度很快降低,这表明该碳点可以作为有效的荧光探针检测活细胞中的Fe3+。
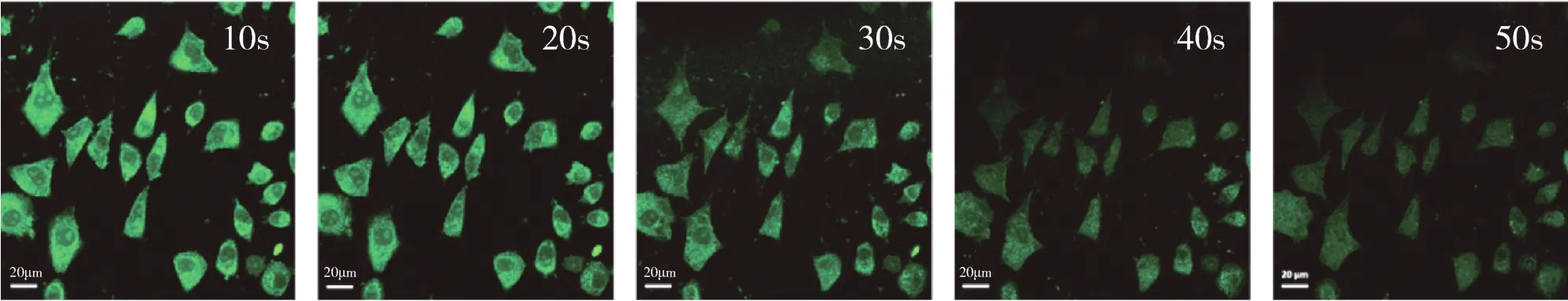
图10 CDs/Fe3+体系加入SMMC-7721细胞中的激光共聚焦显微镜下的动态图Fig.10 Dynamic LSCM fluorescence images of SMMC-7721 cells in existence of CDs/Fe3+
3 结论
以金银花为碳源借助一步水热法成功合成了绿色荧光发射的碳点。合成的碳点具有良好的荧光性质。该碳点在水溶液体系中能够对Fe3+进行检测,线性范围为 0.05 μmol/L~50 μmol/L 和 75 μmol/L~325 μmol/L,检出限为0.032 μmol/L。基于该碳点的低毒性和高生物相容性,可以将其应用于体外活细胞的染色成像和活细胞中的Fe3+传感。

