基于粪便样本的野生犬科动物物种鉴别与棘球绦虫感染调查
尚婧晔,张光葭,丹巴泽里,王 奇,喻文杰,何 伟,廖 沙,沈芸舟,黄 燕*,王 谦,钟 波,刘 阳*
(1.四川省疾病预防控制中心,成都 610041;2.甘孜藏族自治州州疾病预防控制中心,康定 626099;3.凉山彝族自治州疾病预防控制中心,西昌 615000)
犬科动物是棘球绦虫的主要终末宿主和传染源。了解犬科动物感染虫种及其感染水平,可以明确不同终末宿主在棘球蚴病传播中所起作用和风险程度,为棘球绦虫终末宿主的防控提供重要的策略依据。由于样本获取困难、检测方法有限,长期以来,包括流浪犬在内的棘球绦虫野外终宿主感染水平的调查始终是一个棘手的问题。出于对野生动物保护和食肉动物危险性的考虑,早期采用的捕杀剖检或药物导泄收集虫体的方法已经不再适用。非损伤性采样的粪样检测是目前最具有操作性的方法。与家犬不同,野外动物粪样为野外捡拾,来源并不明确。不同动物粪便虽然具有一定的外观形态特征,但单凭眼观鉴别其来源,仍可能出现偏差。简单进行病原检测而不对样本来源进行准确辨识,很可能会因为纳入其他非目标宿主样本而造成检测阳性率远低于实际感染率,或掩盖单一宿主的高感染率,难以保证结果的准确性。因此,利用分子生物学方法进行样本的溯源极为重要。
目前,国内棘球绦虫终末宿主种类分子鉴别的研究不多,且主要集中于单一属内物种的鉴别[1-2]。线粒体DNA(mtDNA)因具有多拷贝、变异快、缺乏重组、分子量小等特点,被广泛应用于各种动、植物的分子鉴定和分类,已证实对多种哺乳动物具有良好的区分效果[3-6]。本研究以采集自棘球绦虫高流行区野外环境中的犬科动物粪便为样本,以mtDNA控制区(D-loop)基因为分子标记,对不同犬科动物同源序列进行比对分析,探索mtDNA D-loop高变区序列用于棘球绦虫主要终末宿主鉴别的可能性,同时,通过粪-抗原检测,对样本棘球绦虫感染情况进行调查。
1 材料与方法
1.1 样本来源
本研究检测粪样101份,于2016年采集自甘孜州石渠县真达、呷依、格孟3乡的野外环境,包括居民定居点周围和狐狸、狼等棘球绦虫野外终末宿主洞穴口及经常出没的区域。根据粪样外观形态和采集地点,对粪样来源宿主种类进行初步鉴定,将采集的样本分为3组:1)疑似狼粪样32份,主要采自狼洞口和高山、半高山牛、羊、藏原羚等大型哺乳动物活动较多的地方,粪便较粗长,颜色泛白,带有少量动物长毛发和较多、较大的动物骨头;2)疑似狐粪样30份,主要采自狐洞口和半高山、沿河高原草甸高原鼠兔、青海田鼠等小型哺乳动物活动频繁的地区,粪便较细长,呈灰黑色,带有较多动物短毛发;3)疑似犬粪样本39份,主要采自定居点周边高原鼠兔、青海田鼠等小型哺乳动物活动较多的地区,粪便粗细、长短多介于狼和狐之间,呈棕黑或灰黑色,带有动物短毛发。
所有样本于-80 ℃冷冻保存1个月以上,以灭活虫卵。
1.2 主要试剂和仪器
主要使用试剂包括QIAamp DNA Stool Mini Kit(Qiagen,Germany),GoTaq G2 Hot Start Master Mixes(Promega,USA),犬粪包虫抗原检测试剂盒(深圳市康百得生物科技有限公司,中国)。主要使用仪器包括AB2720 PCR仪(Applied Biosystems,USA),电泳仪(BioRad,USA),凝胶成像仪(BioRad,USA),电热恒温培养箱(上海跃进医疗器械厂,中国)。
1.3 基因组DNA提取
参考文献[1]方法对粪样中可能存在的宿主肠道脱落组织、细胞碎片等进行富集处理后,按照粪便DNA提取试剂盒操作说明提取粪样基因组DNA,于-20 ℃保存备用。
1.4 宿主物种鉴别
1.4.1 PCR扩增和测序 参考文献[7]合成用以扩增哺乳动物mtDNA D-loop区的通用引物L15995:5′ -CTCCACTATCAGCACCCAAAG-3′,H16498:5′-CCTGAAGTAAGAACCAGATG-3′。PCR反应体积为25 μL,包含1×GoTaq G2 Hot Start Master Mixes,上下游引物0.4 μmol·L-1,DNA模板20~50 ng。扩增条件为94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测后,送擎科生物技术公司进行双向测序。
1.4.2 序列分析 所获序列经DNAStar软件进行自动双向拼接并加以适当手动调整后,采用ClustalX2软件[8]进行多重比对。使用DnaSP5软件[9]分析序列单倍型与变异位点。将单倍型序列与Genbank数据库中已发表物种序列进行BLAST比对。利用MEGA7软件[10]计算基于Kimura-2-parameter模型(K2P)的遗传距离,同时以小家鼠(Musmusculus)为外群,采用最大似然法(Maximum Likehood,ML)构建系统发育树。
1.5 棘球绦虫抗原检测
1.5.1 粪-抗原检测 粪样经适当捣碎处理后,按照犬粪包虫抗原检测试剂盒操作说明,采用ELISA夹心法对粪样中棘球绦虫抗原进行检测。
1.5.2 数据处理 采用EXCEL软件对数据进行整理,采用SPSS软件对数据进行统计分析,使用χ2检验对不同来源样本棘球绦虫抗原阳性率差异进行比较。
2 结 果
2.1 宿主物种鉴别
2.1.1 PCR扩增结果 提取的101份粪样DNA中有74份扩增出目的条带,PCR产物电泳结果显示在350~400 bp出现清晰的单一条带,扩增产物可用于后续测序分析,样本检测成功率为73.27%(图1)。
2.1.2 序列变异与单倍型分析 所获74条序列经比对、剪切后,最终整理为297 bp的同源序列(GenBank登录号:MZ189011~MZ189084),定义单倍型20个,根据序列碱基差异大小,分为4个单倍型集合,其中单倍型H1~H6核苷酸变异位点13个,6个单倍型间碱基差异为1~10个;单倍型H7~H10核苷酸变异位点5个,4个单倍型间碱基差异为1~5个;单倍型H11~H15核苷酸变异位点11个,5个单倍型间碱基差异为1~8个;单倍型H16~H20核苷酸变异位点5个,5个单倍型间碱基差异为2~5个(表1、2)。单倍型集间,以单倍型H1~H6与H7~H10碱基差异最小,平均为17.83,其次为单倍型H11~H15与H16~H20,平均碱基差异为38.64,单倍型H1~H6、H7~H10与单倍型H11~H15、H16~H20间碱基差异较大,平均为64.85~70.10。

表1 单倍型H1~H10线粒体控制区基因变异位点Table 1 Mutation sites in the mtDNA control region of H1-H10
2.1.3 序列相似度比对 经Blast比对,所有单倍型序列均与GenBank数据库中已公布的单一物种同源序列高度相似,对比结果分别为犬(Canislupusfamiliaris)、灰狼(Canislupus)、红狐(Vulpesvulpes)和藏狐(Vulpesferrilata)4种犬科动物(表3)。

表3 单倍型序列BLAST比对结果Table 3 BLAST results of the haplotype sequences

1~9.检测的粪便样本;M.DL5000 DNA相对分子质量标准;N.无模板对照1-9.Fecal samples detected in the study;M.DL5000 DNA molecular weight markers;N.No template control图1 PCR扩增结果Fig.1 The results of the PCR amplification

表2 H11~H20线粒体控制区基因变异位点Table 2 Mutation sites in the mtDNA control region of H11-H20
2.1.4 遗传距离分析 基于K2P模型的遗传距离分析结果显示,20个单倍型之间遗传距离为0.004~0.354。4个单倍型集间遗传距离远大于各集合内单倍型间遗传距离;单倍型H1~H6与H7~H10、单倍型H11~H15与H16~H20间遗传距离较与其他单倍型集间遗传距离小;单倍型H1~H6、H7~H10、H11~H15、H16~H20分别与犬、灰狼、赤狐和藏狐遗传关系最近(表4)。
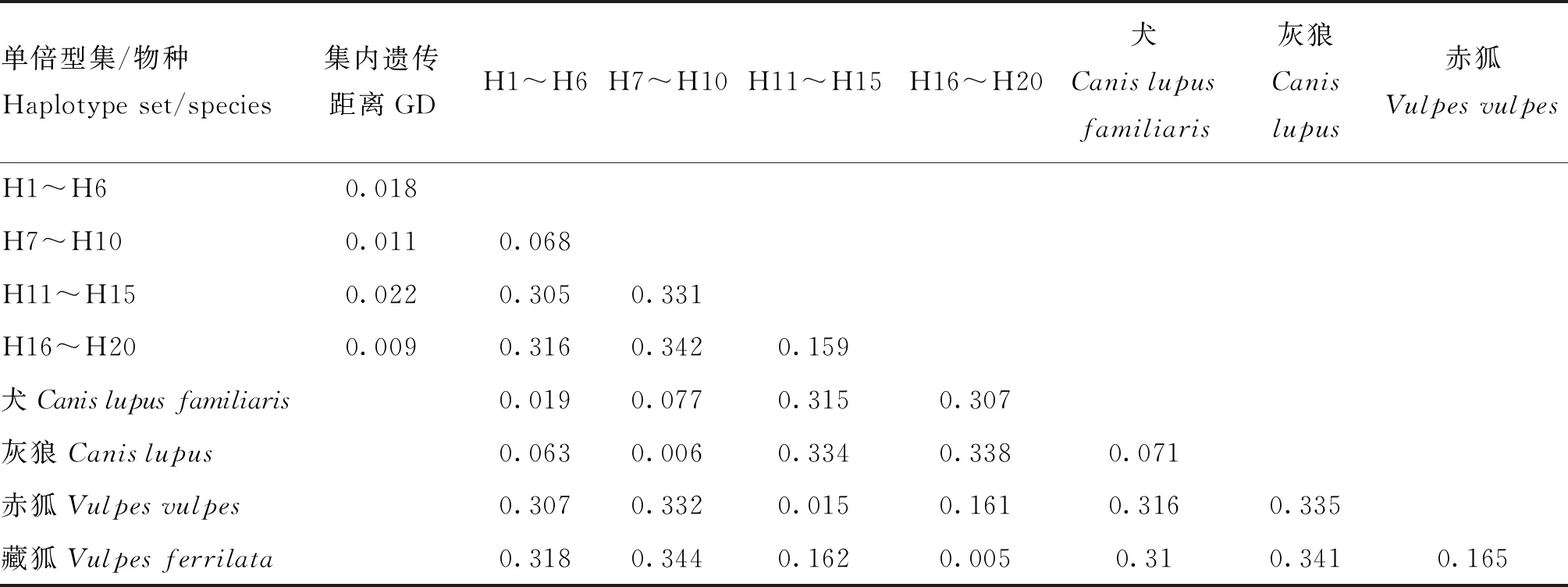
表4 基于K2P模型的平均遗传距离Table 4 Average genetic distance based on the K2P model
2.1.5 系统发育分析 构建的ML系统发育树表现出明显的聚类现象,所有单倍型分为两大支,其中单倍型H7~H10与灰狼参考序列(KT901460)聚集在一起,并与单倍型H1~H6及犬参考序列(JN695048)共处同一大分支;另一大分支是由单倍型H11~H15与赤狐参考序列(KJ846513),以及单倍型H16~H20与藏狐参考序列(JF520840)各自聚集成簇后再形成的一个大支(图2)。
2.2 棘球绦虫感染检测
经棘球绦虫粪-抗原ELISA检测共发现阳性样本11份,阳性率为10.89%(11/101)(表5)。

小于75%的自展值未予显示Bootstrap values below 75% were not shown图2 基于线粒体控制区基因序列构建的ML系统进化树Fig.2 ML tree based on mtDNA control region sequences

表5 棘球绦虫粪-抗原ELISA检测结果Table 5 The results of copro-antigen ELISA tests for detection of Echinococcus
3 讨 论
棘球绦虫终末宿主感染调查是棘球蚴病监测的重点,也是防控的难点和薄弱点。粪便作为非损伤性采集样本,可同时用于来源宿主的物种鉴定和棘球绦虫的感染检测,对棘球绦虫终末宿主,尤其是野生终末宿主的调查研究具有重要意义。近年来的研究报道中所涉及的野外犬科动物感染调查均选择以粪便为样本,在检测其内棘球绦虫特异性抗原或核酸的同时,根据粪样外形特征来推测其宿主来源[11-12]。本次研究结果证实,以粪样形态特点和采样环境来判断样本来源动物种类具有一定可行性,但也存在一定的误差,尤其是犬粪,误辨率较高。另外,由于眼观鉴别严重依赖现场人员个人经验,也极大地限制了该方法的推广应用。本次检测的101份粪样中,74份通过粪样DNA扩增、测序和分析,成功实现对其来源的4种犬科动物的鉴别,结果表明,分子检测可有效鉴定粪便样本来源动物种类,作为形态判别的修正依据,有效提升鉴定准确率。另一方面,研究结果也反映出粪样检测的不足,与血液、组织等样本相比,粪便样本检测成功率一般相对较低。本次用于检测的粪样为野外捡拾,部分样本可能因为曝露时间过长,受到高原阳光爆嗮或雨水冲刷,造成粪样被某些有抑制作用的成分污染,或其内含有的宿主核酸降解,而未能成功扩增。研究结果提示,要进一步提升样本检出率,应尽量采集新鲜粪便用于分子检测,同时,探索更为有效的目的成分富集前处理方法。
mtDNA目前被广泛应用于物种鉴定、遗传多样性和系统发生等研究,以cox1、细胞色素b(cytb)等编码基因为代表的DNA条形码技术在啮齿类、鱼类、鸟类等动物识别与分类研究中均取得了较为理想的结果[13-15]。然而,由于受到选择压力的影响,这些编码基因通常无法有效区分亲缘关系较近的物种,相较之下,作为mtDNA中唯一的非编码区域,D-loop区因为缺乏选择压力,变异速度较编码区基因更快,被认为对近缘和近期分化的物种具有更好的分辨能力[7]。本研究对成功扩增获得的74份mtDNA D-loop区基因片段进行了分析,同源序列比对结果显示,检测序列可与GenBank中单一物种序列相匹配,多态性位点差异与遗传距离分析结果与BLAST比对结果一致,所鉴定的物种间距离远大于种内距离,满足物种鉴定的判别条件,系统发育发育树中,鉴别为同一物种的不同单倍型以高自展值进行聚类,支持其鉴别结果,综合各项分析结果,可判断粪样来源分别为犬、灰狼、赤狐和藏狐4种犬科动物。研究表明,以mtDNA D-loop区序列分析作为犬科动物粪样不同物种来源的鉴定依据具有可行性,该方法对包括狼及其近缘驯化种犬在内的棘球绦虫主要终末宿主均具有较好的辨识能力。
尽管基于mtDNAD-loop区对犬科动物的鉴别具有快捷、高效、简易等优点,但仍然存在一定的局限性。由于线粒体基因母系遗传的特点,基于mtDNA的分析无法识别自然界中可能偶尔发生的杂交事件,对没有生殖隔离的物种间自然交配产生的杂交及其回交子代个体的鉴别存在一定缺陷[16-17]。因此,为进一步提高鉴别的准确度,在对mtDNA D-loop区碱基序列进行分析比较的同时,可结合常染色体基因的双亲遗传或Y染色体基因的父系遗传分子标记对物种进行鉴别[18-20]。此外,采用微卫星标记对物种个体进行识别分析,可进一步排除可能存在的来源于同一宿主的重复样本,实现对棘球绦虫终末宿主的精准识别,为棘球绦虫终末宿主防控提供更为系统、全面的数据支撑。
家犬作为牧区重要的生产工具和人类的亲密伙伴,与其相关的因素,如家庭是否养犬、犬只数量、是否与犬亲密接触等,被认为是我国棘球蚴病流行区、尤其是青藏高原地区棘球绦虫传播最重要的风险因素[21-23],但自2006年我国棘球蚴病防治项目实施以来,经过近15年以家犬驱虫为主的综合防控,目前各流行区家犬棘球绦虫感染率均已出现明显下降,并维持于较低水平[24-26]。与此同时,流浪犬(无主犬)因其数量多、流动性大等特点,干预十分困难,其感染控制成效极为有限[27-28],类似地,作为棘球绦虫的保虫宿主,狼、狐狸等野生犬科动物感染率也远高于家犬[1,11]。本次对粪样棘球绦虫抗原检测结果显示,调查地区野外犬科动物具有较高的棘球绦虫抗原阳性率,但相较于此前采用不同检测方法对该地区野生犬科动物棘球绦虫感染情况的调查结果,感染率有所下降,这可能是由于各研究项目调查时间、调查方法、样本代表性,以及所涉及宿主种类等的不同而导致[29-31]。由于现有针对野外犬科动物棘球绦虫感染情况的研究严重不足,依靠现有数据难以对当地野外犬科动物棘球绦虫感染水平作出全面的有效推断,但可以明确的是,在家犬棘球绦虫感染率得到有效控制的情况下,包括流浪犬在内的野外犬科动物所具有的高感染率可能对流行区棘球绦虫的传播起到更大的作用,由其引起人群感染的危害不应被忽视。强化宿主物种鉴别与个体鉴定、病原分子检测等关键技术,开展野外犬科动物棘球绦虫感染水平监测,有针对性地提出对野外犬科动物的防控措施,将有助棘球蚴病下一步防控目标的实现。
4 结 论
通过mtDNA D-loop区序列分析对野外犬科动物粪便的物种鉴别结果显示,成功确定检测的粪样分别来自犬、灰狼、赤狐和藏狐4种犬科动物,同时,基于棘球绦虫粪抗原的检测发现,样本来源个体具有较高的棘球绦虫感染率。研究结果可为进一步提升棘球绦虫野外终末宿主精准监测质量提供技术依据,作为调查地区野生犬科动物棘球绦虫感染数据的更新和补充,为当地开展棘球绦虫防控提供数据参考。

