基于NiO@Au传感器检测饮用水中铅的研究
郑辉
石家庄职业技术学院食品与药品工程系(石家庄 050081)
铅(Pb)一种常见的金属,由于其具有耐腐性强、抗辐射等优点,在冶金、蓄电池、油漆颜料等工业生产中被广泛应用[1-3]。铅在为方便人们生活做出贡献的同时,也对人们的身体健康产生某些方面的严重威胁,导致近些年“铅污染事件”层出不穷,如“衡东县儿童血铅超标事件”“河南济源千名儿童血铅超标事件”“甘肃徽县铅中毒事件”等。研究发现,铅中毒通常是慢性的,其可以在身体内聚集,长期接触铅及其化合物可导致肌肉酸痛、贫血、神经与大脑损伤,严重者甚至存在患癌的风险[4-7]。因此,研究一种方便、快捷的检测方法,对水中铅含量进行定量分析,意义重大。
目前,关于铅的检测方法主要有原子吸收分光光度法、原子荧光法、质谱法等[8-10],这些方法虽然检出限低、灵敏度高,但其检测成本较高、操作人员技术要求较高且设备体积较大,因此不适合现场快检。电化学法优于能够有效地避免传统方法的不足,且设备体积小、人员操作简单,因此在Pb的定量分析方面存在较大应用潜力[11-14]。
镍(Ni)是一种位于第四周期第Ⅷ族元素,具有和铁一样的超顺磁、导电性好等优良特性且其导电性优于铁[15-16]。目前,关于磁性纳米材料的研究主要关注在铁纳米材料上,关于镍纳米材料的研究及应用目前还较少。金(Au)由于其具有极好的导电性,在电化学传感器研究方面被广泛关注[17],但其价格也相对昂贵,在普及、应用方面目前比较受限。因此,试验以镍为基质,制备表面负载纳米金的磁性纳米材料并制备相应的传感器对引用水中的铅进行定量分析。
1 材料与方法
1.1 材料与试剂
硝酸铅(徐州市精科试剂仪器有限公司);铁氰化钾、亚铁氰化钾(洛阳市化学试剂厂);氯化钾(广州光华化学厂);醋酸钠(北京化工厂);冰乙酸、磷酸氢二钠(上海实意化学试剂有限公司);磷酸、硼酸(天津市科密欧化学试剂开发中心);磷酸二氢钠(天津市致远化学试剂有限公司)。
1.2 主要仪器与设备
CHI-660E电化学工作站(上海辰华仪器有限公司);MJ-06D超声波清洗机(长沙明杰仪器有限公司);移液枪[赛默飞世尔科技(中国)有限公司];玻碳电极(Ф3 mm)、Ag/AgCl为参比电极、铂电极(湖北武汉高仕睿联科技有限公司)。
1.3 试验方法
NiO纳米材料的制备:准确称取0.521 6 g的Ni(NO3)2·6H2O固体颗粒,加入到50 mL乙二醇溶液中,搅拌均匀,使其完全溶解,然后在不断搅拌条件下加入4 mL 1 mol/L的尿素溶液,搅拌均匀。随后将混合液转移至100 mL水热合成反应釜中(聚四氟乙烯内衬),于160 ℃保持8 h。最后将反应产物转移至马弗炉中于450 ℃高温煅烧2.5 h,冷却至室温,将固体粉末用超纯水清洗3次,于60 ℃真空干燥,即得NiO纳米材料。
NiO@Au纳米材料的制备:准确称取0.500 0 g制备好的NiO纳米材料于100 mL锥形瓶中,然后向其中加入50 mL超纯水,将混合液置于超声波清洗机中进行超声分散60 min,使其分散均匀。用移液枪准确吸取0.5 mL 3 mmol/L的HAuCl4和0.4 mL 0.1 mol/L的K2CO3搅拌均匀,在剧烈搅拌条件下,加入1 mL刚刚配制好0.2 mg/mL的NaBH4溶液,反复滴加5次,并不断搅拌20 min,即得初步的Au纳米粒子。将反应液以8 000 r/min离心,去除上清液,然后向其中加入50 mL超纯水,超声分散30 min,使其分散均匀,得初步的NiO@Au悬浊液,备用。在剧烈搅拌条件下,向NiO@Au悬浊液中依次加入0.1 mL 3 mmol/L的HAuCl4和1 mL 20 mmol/L盐酸羟胺溶液,剧烈搅拌20 min,使其反应完全,将所得悬浊液用离心机以8 000 r/min离心、洗涤,反复3次。最后将所得固体产物于60 ℃真空干燥,即得NiO@Au纳米材料。
NiO@Au/GCE的制备:GCE参考文献[18]处理。用10 μL移液枪吸取7.0 μL 1 mg/mL的NiO@Au,均匀涂布于GCE表面,于25 ℃干燥,即得NiO@Au/GCE。
1.4 样品处理
称取0.01 g的硝酸铅于100 mL烧杯中,加入50 mL超纯水,搅拌均匀,使其完全溶解,然后将溶液转移至1 000 mL容量瓶中,定容得0.01 g/L的硝酸铅母液,然后分别用pH 5.0的NaAc-HAc稀释至20,100和500 μg/L,在最佳试验条件下对其进行定量分析。
2 结果与讨论
2.1 不同电极的电化学表征
分别以GCE、NiO/GCE和NiO@Au/GCE为工作电极,以5 mmol/L和10 mmol/L的[Fe(CN)6]3-溶液(含0.1 mol/L KCl)为电解质溶液对其进行交流阻抗表征和循环伏安(CV)表征,其结果如图1所示。GCE在[Fe(CN)6]3-溶液中测得的阻抗为1 394.7 Ω,Ip为63.94 μA;NiO/GCE在[Fe(CN)6]3-溶液中测得的阻抗为1 083.13 Ω,Ip为74.8 μA,与GCE相比阻抗降低22.34%,Ip提高16.98%,这是说明NiO纳米材料具有良好的导电性和吸附性,能有效促使Pb2+在电极表面的富集以及电极表面电子的转移速率,提高电流响应。同样,NiO@Au/GCE在[Fe(CN)6]3-溶液中测得的阻抗为652.84 Ω,Ip为95.53 μA,与NiO/GCE相比阻抗降低39.72%,Ip提高27.71%,与GCE相比阻抗降低53.19%,Ip提高49.41%,这说明纳米金的引入能进一步改善传感器表面电子的转移速率,提高Ip,增加传感器的灵敏度。

图1 不同电极的表征
2.2 Pb2+在不同传感器上的行为
分别以GCE、NiO/GCE和NiO@Au/GCE为工作电极,pH 5.0的NaAc-HAc为电解质,对100 μg/L的Pb2+进行差分脉冲(DPV)扫描,其结果如图2所示。GCE在100 μg/L的Pb2+中测得的Ip为7.817 μA,NiO/GCE为11.271 μA,与GCE相比Ip提高44.17%,NiO@Au/GCE在100 μg/L的Pb2+中测得的Ip为29.946 μA,与GCE和NiO/GCE相比分别提高283.09%和165.69%。这说明NiO@Au能显著改善传感器的导电性,增加传感器的灵敏度,提高电极表面的电流响应。

图2 Pb2+在不同传感器上的DPV曲线
2.3 Pb2+在不同缓冲液上的行为
分别以pH 5.0的NaAc-HAc、PBS和BR缓冲液为支持电解质溶液,NiO@Au/GCE为工作电极,对100 μg/L的Pb2+进行DPV扫描,其结果如图3所示。Pb2+在pH 5.0的NaAc-HAc、PBS和BR缓冲液中测得的Ip分别为29.494,8.86和15.127 μA,其中在pH 5.0的NaAc-HAc中测得的Ip最大,与PBS和BR缓冲溶液相比Ip提高232.89%和94.98%。这说明NaAc-HAc缓冲液能够为传感器提供稳定的电化学环境,显著提高NiO@Au/GCE的电流响应,因此,选取NaAc-HAc为支持电解质溶液。

图3 Pb2+在不同缓冲液中的DPV曲线
2.4 NaAc-HAc缓冲液pH的优化
分别以3.0~6.0不同pH的NaAc-HAc为电解质溶液,对100 μg/L的Pb2+进行DPV扫描,其结果如图4所示。NaAc-HAc的pH对NiO@Au/GCE传感器存在较大影响,其效果呈现先增大后减小的趋势,且当NaAc-HAc的pH为5.0时,其效果最好,Ip为30.23 μA。这是因为不同pH的环境条件下各离子浓度存在较大的差异,严重影响电化学反应体系的稳定性。因此,选取pH 5.0的NaAc-HAc为支持电解质溶液。

图4 不同pH的NaAc-HAc对NiO@Au/GCE的影响
2.5 NaAc-HAc修饰量的选择
分别以3,4,5,6,7,8和9 μL 1 mg/mL的NiO@Au修饰电极制备NiO@Au/GCE,对100 μg/L的Pb2+进行DPV扫描,其结果如图5所示。修饰量对NiO@Au/GCE存在较为显著影响。NiO@Au可明显提高NiO@Au/GCE灵敏度,增加电流响应,但当使用过载时,NiO@Au/GCE的阻抗会明显增大,导致Ip降低。这是因为NiO@Au过多会导致其在电极表面的堆积,且物理吸附不能很好地起到固载效果,导致部分脱落,进而影响电流响应。因此,NiO@Au使用量选取7 μL。
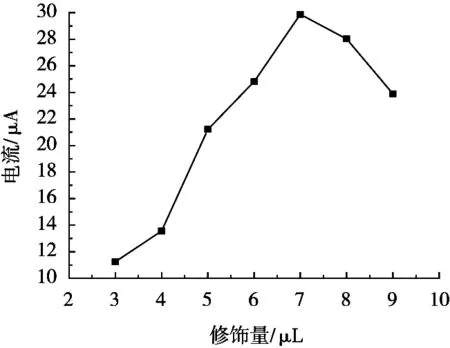
图5 NiO@Au对NiO@Au/GCE的影响
2.6 富集条件的优化
以pH 5.0的NaAc-HAc为电解质溶液,7 μL经NiO@Au修饰的NiO@Au/GCE为传感器,富集时间140 s,在不同的富集电压下对100 μg/L的Pb2+进行DPV扫描,分别记录不同富集电位下的Ip;然后同样在富集电位-1.2 V的条件下分别富集不同的时间对100 μg/L的Pb2+进行DPV扫描,分别记录不同富集时间下的Ip,其结果如图6所示。最佳的富集电位为-1.2 V,最佳富集时间为140 s。这是因为虽然富集电位适当增加可以使更多的Pb2+富集在电极表面,进而产生较大的Ip,当富集电压继续增加时容易产生析氢现象,使电极表面产生气体,进而增大阻抗。同样,在最佳的富集电压下,富集时间的延长能使电极表面Pb2+富集较多,但当其达到电化学反应饱和后继续增加,其Pb2+产生的阻抗效应占据主导地位,进而使电极表面阻抗增大,Ip减小。因此,富集电位选择-1.2 V,富集时间选择140 s。

图6 富集电位和时间对NiO@Au/GCE的影响
2.7 标准曲线的建立
在最佳试验条件下,分别对0.1~1 400 μg/L的Pb2+进行DPV扫描,其结果如图7所示。Pb2+浓度和其Ip在0.1~150 μg/L和150~1 100 μg/L范围内呈良好的线性关系,线性方程分别为Y=0.291 9X+0.618 4,R2=0.997 2和Y=0.110 2X+26.676 2,R2=0.998,相关性较好,线性范围较宽,检出限为0.027 μg/L(S/N=3),检出限较低,满足试验要求。
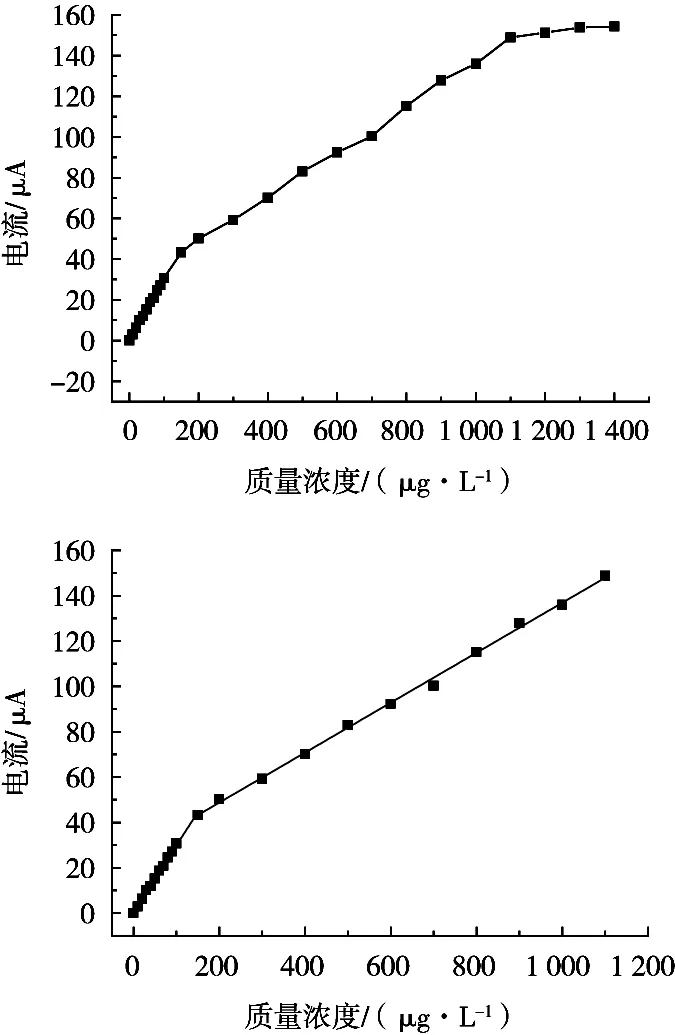
图7 Pb2+浓度与其Ip间的关系曲线
2.8 试剂样品检测
在最佳试验条件下用NiO@Au/GCE对不同质量浓度的Pb2+进行加标回收试验,其结果如表1所示。NiO@Au/GCE对Pb2+的加标回收率在96.72%~102.4%之间,与原子吸收分光光度法得的加标回收率结果96.79%~99.08%一致,其回收效果较好,准确度较高。
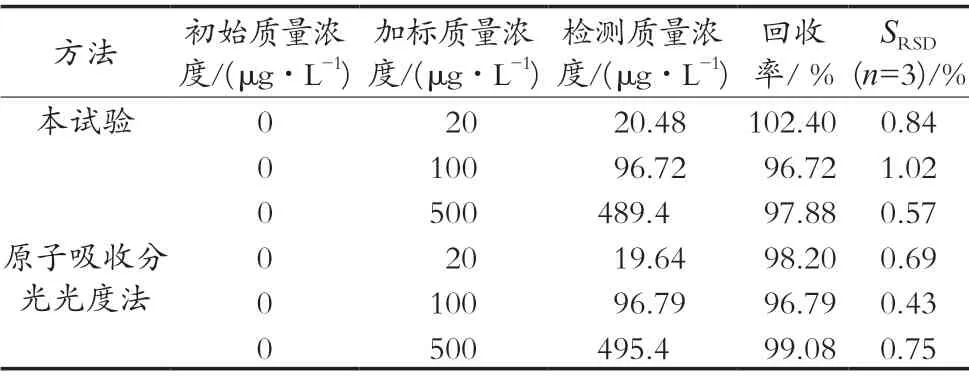
表1 Pb2+加标回收率试验
2.9 NiO@Au/GCE的稳定性研究
将制备好的NiO@Au/GCE于20~25 ℃保存,然后每周分别对100 μg/L的Pb2+进行DPV扫描,记录其Ip,其结果如图8所示。随着时间推移,NiO@Au/GCE对Pb2+的检测效果会有衰减现象,但并无显著变化。储存6周后,其检测效果仍可达到97.02%,说明NiO@Au/GCE稳定性较好。
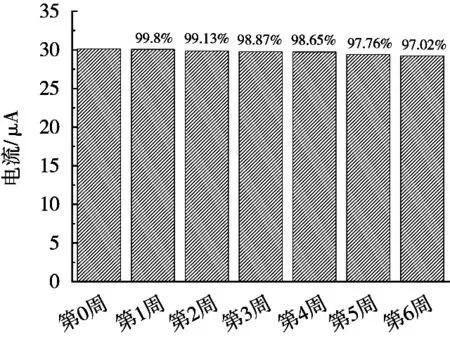
图8 储藏时间对NiO@Au/GCE的影响
2.10 NiO@Au/GCE的抗干扰特性研究
在最佳试验条件下分别在100 μg/L的Pb2+中加入5倍量的Z2+、Fe3+、Cu2+、Mn2+、Al3+、Mg2+、K+、Cd2+、Ni2+和Na+离子,然后对其DPV扫描,进行抗干扰性研究,其结果如图9所示。加入5倍常见抗干扰金属离子后,其Ip仍可达到加入前的95.13%~102.09%,这说明加入的干扰离子对NiO@Au/GCE没有显著性影响,说明NiO@Au/GCE对常见的Z2+、Fe3+、Cu2+、Mn2+、Al3+、Mg2+、K+、Cd2+、Ni2+和Na+离子有良好的抗干扰能力。

图9 不同金属离子对NiO@Au/GCE的影响
3 结论
试验合成了新型的NiO@Au纳米复合材料,并制备了NiO@Au/GCE传感器。研究发现,NiO@Au导电性、吸附性良好,可显著提高NiO@Au/GCE灵敏度。用NiO@Au/GCE对Pb2+进行定量分析,其线性范围较宽,准确度较高,且该传感器稳定性和抗干扰能力较好,对常见重金属离子有很强的抗干扰能力。NiO@Au/GCE传感器使用方便、成本较低,加之其稳定性、灵敏度较好,为水中重金属Pb2+的快速检测分析提供了一种新的方案,应用潜力巨大。

