棘皮动物神经肽的研究进展❋
陈慕雁,郑颖秋,丛 潇
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
1 神经肽介绍
神经肽作为一种化学信号,广泛参与、调节动物的生理过程和行为。相较于其他调节因子,神经肽的研究起步较晚,建立在20世纪生理学、内分泌学和生物化学领域的开创性研究基础之上,并基于三个开创性概念:(1)肽激素是内分泌系统中的化学信号;(2)肽激素的神经分泌遵循神经系统运作的一般原理;(3)神经系统对肽信号能做出反应[1]。1971年,De Wied提出了“神经肽”一词来描述神经活性肽激素及其片段[2]。1975年,脑啡肽的鉴定开创性地将激素从内分泌学领域带入到神经科学领域[3]。随着放射性配体结合测定法和分子技术的发展,受体的鉴定使得神经肽的作用方式得以明确,神经肽的定义也越来越明晰,即“神经肽是由神经元合成分泌并释放作用于神经底物的小蛋白质物质。”此后神经肽的研究进入新阶段[1]。
作为一种内源性肽段,神经肽在生物体内可作为神经递质,神经调质或神经激素,进行细胞间信号传导,是神经系统最大、最多样化的一类信号分子。神经肽长度不等,通常具有3~100个氨基酸[4],例如,促甲状腺激素释放激素(TRH)仅具有3个氨基酸残基[5],促肾上腺皮质激素释放激素(CRH)具有41个氨基酸残基[6]。神经肽都具有一些共同的特征:(1)衍生自较大的前体蛋白;(2)具有靶向调节前体蛋白分泌途径的N-末端信号肽;(3)前体蛋白具有典型的切割位点(例如,由激素原转化酶识别的一元或二元位点);(4)具有对生物活性至关重要的翻译后修饰的位点(例如,C-末端甘氨酸残基常常是酰胺化的底物,其对于成熟蛋白质的活性至关重要);(5)除少数例外,神经肽通常结合并激活属于视紫红质-β,视紫红质-γ和胰泌素secretin型受体家族的G-蛋白偶联受体(GPCR)来发挥作用[1]。上述特征是发掘神经肽在生物生命活动中的功能的基础,而功能探究一直是神经肽研究的重点。
1.1 神经肽的功能特征
人和动物的生理活动主要具有三大调节手段,即神经调节、体液调节和自身调节。相较于体液调节缓慢持久的特点,神经调节过程更为短暂精准。在神经调节过程中,大量的神经递质(例如,乙酰胆碱、5-羟色胺(5-HT)等)作为信息传递的“信使”,参与各项生命活动。神经肽通常与氨基酸和生物原胺类神经递质共存于神经末梢,按需存储和调节释放,但只有在强烈或长期刺激后才能释放[7]。因此,与“快速神经递质”相比,例如兴奋性氨基酸和生物原胺类物质,神经肽的细胞响应过程通常相对缓慢持久,这种延迟一方面是由于其储存在密集核囊泡中,这些囊泡未处于细胞释放位点(突触或突触按钮),需要募集后再进行释放。此外,对释放的神经肽响应较慢的另一个原因是几乎所有神经肽都作用于G蛋白偶联受体(GPCR)。这些受体触发分子内酶促事件的细胞内级联反应,从而产生细胞反应。发生这种反应的时间跨度(秒或更长)比神经递质的时间跨度要长得多,神经递质直接作用于离子通道来调节离子通量(毫秒)[1]。
神经肽衍生自较大的前体蛋白。源自同一神经肽前体的不同神经肽生理活性可能相同,不同甚至相反。因此,鉴定源自同一个前体产生的所有肽的具体生物功能非常重要。神经肽在同一物种中可能扮演不同的角色。例如,在红海盘车(Asteriasrubens)中,促甲状腺激素释放激素(TRH)型神经肽不仅介导幼虫的变态附着,而且还可能参与信号传导和加工的神经机制[8]。同时,同一种神经肽在不同物种中也可能具有相同的功能,例如软体动物加利福尼亚海兔(Aplysiacalifornica)、甲壳动物小龙虾(Orconectuslimosus)及红海盘车中的Pedal peptide(PP)/orcokinin(OK)型神经肽(刺激肌肉)[9-11],软体动物静水椎实螺(Lymnaeastagnalis)、线形动物秀丽隐杆线虫(Caenorhabditiselegans)及红海盘车中的加压素/催产素型(VP / OT)神经肽(繁殖)[12-14]以及红海盘车和海参(Holothuriaglaberrima、Apostichopusjaponicus)中的SALMF型(肌肉松弛剂)[15-17]等。
1.2 神经肽的作用方式
神经肽受神经元控制,直接通过神经受体调节介导神经功能[1]。它们可以直接作为神经递质、神经调质,也可以作为封闭的细胞环境中的自分泌或旁分泌调节剂,或者长距离的激素。通常,神经肽信号系统通过激活相应的GPCR调节生物学功能和行为。神经肽作用于受体的方式有两种,一种是直接与位于突触后神经元的受体结合,通过调节离子通道活性,直接影响突触后神经元的兴奋性;另一种是通过激活位于突触前轴突末端的受体,影响小分子神经递质的释放,间接影响突触后神经元的兴奋性[18]。关于G蛋白偶联受体,不同的G蛋白亚基(Gα,Gβ,Gγ)具有不同的功能。通常,神经肽与受体结合后,GPCR被激活,亚基发生构象变化,导致Gα和Gβγ亚基功能解离,从而调节下游效应子,例如磷脂酶,AC或离子通道[19]。这些在细胞水平的作用将分别在器官系统或个体水平表现为生理活动或行为的变化。
2 棘皮动物神经肽功能研究的意义
神经肽是大脑和其他周围器官中高度多样化的信号分子,以特定的方式影响大脑和机体活动,广泛参与调节动物生理过程和行为。例如,对温度波动等外部环境因子的响应[20],对摄食、代谢、运动、繁殖等生理过程的调节等[21-23]。因此,了解特定神经肽如何响应环境波动以及参与动物生理功能的调节,探明神经肽与受体之间如何相互作用有助于在细胞和个体水平更好地理解其潜在的调控机制。
棘皮动物属于后口无脊椎动物,全世界化石种类接近13 000种[24],现存有5个纲:海胆纲、海参纲、海星纲、蛇尾纲和海百合纲,分布范围广泛,多营底栖生活,在海洋生态系统的结构和功能中发挥重要作用[25]。在两侧对称动物中,棘皮动物连接起原口动物与脊索动物之间进化的“桥梁”,相较于原口动物,与脊索动物亲缘关系更近,因此,棘皮动物神经肽的功能研究将为高等动物提供更多的参考。此外,棘皮动物具有独特的生物学特征及特殊生理现象。例如,成体的五辐对称、分散的神经系统、特殊的水管系统辅助摄食、运动和其他功能[26]。有研究表明,神经肽可能参与介导棘皮动物中几种特殊生物学现象的神经控制,包括自溶、再生[27]及其胶原组织的可变性[28-29],这些对于我们进一步查明棘皮动物特殊生理行为分子调控机制具有重要意义。
随着基因组、转录组及蛋白组学等测序技术的发展,棘皮动物中越来越多的神经肽得以鉴定。自2006年紫海胆(Strongylocentrotuspurpuratus)基因组的测序以来[26],目前已在棘皮动物4个纲的11个物种中获得基因组序列数据,包括海胆纲(S.purpuratus,Lytechinusvariegatus,Eucidaristribuloides)、海参纲(A.japonicus,Apostichopusparvimensis,Parastichopusparvimensis,Australostichopusmollis)、海星纲(Acanthasterplanci,Patiriaminiata,Patiriellaregularis)和海蛇尾纲(Ophiothrixspiculata,Ophionereisfasciata),而在海百合纲中尚未有相关报道[30-34]。同时,基因组、转录组及多肽组的多组学联合分析,使得来自不同家族的神经肽前体及神经肽在棘皮动物某些代表性物种中得以鉴定(见表1),为探明神经肽信号系统如何调节动物生理和行为过程奠定了基础。棘皮动物神经肽的功能研究不仅有利于阐明其生理机制,也将为高效绿色养殖提供科学的理论支撑。
3 棘皮动物神经肽研究方法进展
大多数棘皮动物(海百合纲除外)的神经系统呈弥散状,一般包含两个部分,即外神经系统和深层神经系统[44]。由于其神经系统结构的独特性及难以定位,使得其中央神经系统研究远远落后于其他动物,同时神经肽的高分子量,低体内浓度,高度结构多样性和大量同工型,使得棘皮动物神经肽研究存在挑战。困难和方法共存,随着组学技术和分子生物学技术的发展,棘皮动物神经肽研究方法取得了很大进展,主要应用于神经肽的结构鉴定,时空分布特征及其生理功能探究。

表1 棘皮动物不同物种中已鉴定的神经肽及其前体数目
3.1 结构鉴定研究方法
神经肽结构鉴定是神经肽研究的基础,包括氨基酸序列、翻译后修饰(PTM)、折叠模式、结合位点等,这些信息有助于进一步阐明其功能和生物学机制。目前,质谱法(Mass spectrum, MS)是肽测序和确定神经肽PTM的普遍方法,随着组学的发展,质谱法对低浓度肽检测的灵敏度不断提高,这使得“神经肽组”的鉴定成为可能,同时质谱法也存在一些缺陷,例如片段读长一般为7~23个氨基酸,对于低于7个氨基酸的多肽尚无法检测[45]。
根据不同的肽段或组织特性,序列结构测定方法也随之调整。质谱在鉴定神经肽序列结构时通常与其他手段联用。例如,基质辅助激光解吸电离质谱(MatriX assisted laser desorption ionization mass spectrometry, MALDI-MS)、电喷雾二级质谱(Electrospray ionization ion trap mass spectrometry, ESI-MS/MS)、超高效液相色谱-串联质谱(Ultra performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)等分别成功地在佛罗里达弓背蚁(Camponotusfloridanus)、瓢虫科(Coccinellidae)和葬甲科(Silphidae)部分甲虫及多棘龙虾(Panulirusinterruptus)的神经肽鉴定中得到应用[46-49]。其中,和ESI相比,MALDI对有较大分子量、更强疏水性和更低等电点的肽的检测能力更强,传输效率较高,但ESI离子化效率更高。液相色谱(LC)与气相色谱(GC)相比,气相色谱具有分离效率和检测灵敏度都更高的特点,而液相色谱分析范围广,对于难分离混合物的分析具有很高的准确性,串联质谱则可以更好地分离分析样品。相较于一级质谱,二级质谱能够得到部分短肽的序列,具有更高的可靠性,且价格差距越来越小,是蛋白鉴定的大趋势[50]。作为一种互补分离技术,离子迁移谱(Ion mobility spectroscopy, IMS)技术发展迅速,与MS结合使用后对肽结构的研究更加全面[51]。在进行神经肽鉴定时,可以参考亲缘关系最近的模式生物或自身物种已有数据库进行比对,此外,还可以利用de-novo测序等方法发掘新的神经肽[52]。近年来,已有研究者利用UPLC-MS/MS、nano LC-ESI-MS/MS等技术在棘皮动物的紫海胆、红海盘车、棘冠海星、刺参和黑海参(Holothurialeucospilota)等物种中成功鉴定PP/OK、VP/OT、NPS/CCAP/NG等多个神经肽家族成员[23, 36-37, 40, 42, 53-54]。
富含二硫键神经肽的鉴定一直是神经肽鉴定的一大难题,核磁共振作为表征肽的构象和折叠模式的关键技术,可通过和质谱联用快速鉴定微量肽样品和表征二硫键[55]。结构特征对于神经肽与其受体之间的相互作用十分重要,通过核磁共振技术可以确定神经肽与受体位点的关系,评估与神经肽受体结合的激动剂和拮抗剂结构,从而确定其构象[56- 57]。在棘皮动物中,通过核磁共振与质谱联用,成功在红海盘车中鉴定到富含二硫键的VP/OT型神经肽[23]。
光谱是表征神经肽结构的另一手段。红外(Infrared Spectroscopy, IR)光谱已成功用于二级结构元素的定量估算,包括α-螺旋,β-折叠和转角[58]。 圆二色光谱(Circular Dichroism, CD)可用于二级结构的快速测定[59]。X射线晶体可表征神经肽与其受体在空间的结合特征,目前已在神经肽S和人OX2受体晶体结构的研究中得到应用[60]。
3.2 神经肽及其前体定位特征研究方法
组织中的神经肽定位可用于功能预测,为进一步功能鉴定提供基础。神经肽及其前体的定位分析通常包括两个层面:mRNA水平和蛋白水平。
在mRNA水平,主要通过原位杂交技术(In situ hybridization, ISH),合成靶神经肽的探针,基于碱基互补配对原则,实现对神经肽前体的组织定位,而对于胚胎细胞、棘皮动物早期幼体等,一般采用整胚原位杂交(Whole mount in situ hybridization)。此外,通过荧光原位杂交技术(Fluorescence in situ hybridization,FISH)可以实现同时对多个物种中的多靶RNA进行高灵敏度检测[61]。探针的标记方法包括放射性和非放射性两种,普遍采用的标记方法是地高辛标记,具有灵敏度高、特异性强、检测方便等优点,目前该方法已经广泛应用于棘皮动物的神经肽前体mRNA定位[8, 62-63]。然而,在检测低水平或单拷贝转录本时,丰度过低可能会造成假阴性,且RNA极易降解,对于神经肽前体的鉴定也造成了一定的困难。在某些模式生物中,例如黑腹果蝇(Drosophilamelanogaster)和秀丽隐杆线虫,由于繁殖速度快,较易实现转基因,可以建立启动子报告基因代替ISH在mRNA水平进行定位,检测更加便捷[64-66],但目前此法尚未应用于棘皮动物。
神经肽的蛋白定位,主要利用抗原抗体结合的原理,在合成靶神经肽的抗体后,通过应用放射免疫测定(Radioimmunoassay, RIA)、免疫组织化学(Immunohistochemistry, IHC)、免疫细胞化学(Immunocytochemistry, ICC)、免疫荧光(Immunofluorescence, IF)和免疫电子显微镜技术实现细胞、组织和整个生物体水平神经肽的可视化。与传统组织学方法相比,这些技术通过抗体的使用提高了反应的特异性和敏感性。然而,由于许多无脊椎动物神经肽基因编码一种以上的生物活性肽,彼此之间具有很高的结构相似性,容易导致抗体交叉反应,产生假阳性,而N端定向抗血清可以轻松区分具有高度相似C端基序的肽,帮助克服交叉反应问题[67]。
随着检测技术的发展,ISH与ICC/IHC联合使用,可以实现对靶神经肽及其前体的共同定位。同时通过合成多个靶探针,或者多个靶神经肽的抗体,利用不同的显色标记,实现多个靶神经肽及其前体的同时检测[67]。例如,利用双重IF染色实现了对红海盘车VP/OT型神经肽及其受体的共定位[23];通过多重ISH,并结合IHC,可比较分析紫海胆长腕幼虫阶段9个神经肽及其前体的表达模式[62]。
3.3 神经肽及其前体定量分析技术研究
神经肽的定量通常是研究生理功能的第一步。在无法确定哪些神经肽参与生命活动调节时,通常通过改变外界因素(例如环境),采集特定组织以定量比较,或者从动物中取出组织,在不同条件下孵育,观察产生的影响。目前普遍采用免疫蛋白印迹法(Western blot)对单个蛋白质进行半定量分析。然而,由于神经肽通常分子量较小,难以检测,因此此法通常用于评估神经肽相关蛋白,神经肽前体蛋白或神经肽受体的表达变化,例如海星Asterinapectinifera性腺刺激物质GSS相关的G蛋白(Gαs, Gαi, Gβ)的定量分析[68]。此外,还可以通过酶联免疫吸附测定(Enzyme-linked immunosorbent assay, ELISA)法来进行定量分析,但是检测结果易受其他因素干扰,准确性较低。MS同样可以应用于整体神经肽的定量表达模式分析,例如盐度或温度变化对甲壳动物北黄道蟹(Cancerborealis)、岸蟹(Carcinusmaenas)等神经肽表达水平造成的影响[20, 69]。
实时定量PCR(Quantitative real-time PCR, qRT-PCR)技术通常用于实现神经肽前体转录水平的定量分析,综合分析神经肽及其前体的表达特征。尽管更多的mRNA通常意味着基因表达增强,但蛋白质表达水平并不总是与mRNA呈正相关,因而mRNA水平和蛋白水平的综合分析依然是目前神经肽定量研究中的最佳策略。在棘皮动物中,已通过ELISA及qRT-PCR技术分别对海星(Patririapectinifera,Asterinapectinifera)中的性腺刺激物质GSS和Patiriella属不同发育阶段的Engrailed前体等进行了定量分析[70-71]。
3.4 神经肽功能测定研究方法
神经肽在不同组织中可能具有完全不同的功能,即使来自同一家族不同的神经肽同工型,在同一组织也可能产生截然不同的效果。功能研究主要涉及宏观(例如行为)和微观(例如信号传导途径)两个层面。在宏观功能研究中,主要从在体和离体两个维度来进行。通过剂量依赖性测试获得神经肽作用的最适浓度后,在在体或离体水平注射,观察神经肽对组织或者个体造成的影响。在棘皮动物中,该方法集中应用于对肌肉刚度、行为及繁殖的影响,例如,在体或离体注射神经肽结合电生理学的方法研究红海盘车的PPLN1b、Luqin、VP/OT型等神经肽在肌肉刚度、贲门胃外翻中的功能;在体及离体研究糙海参(Holothuriascabra) TRH/GnRH、刺参NGIWY等神经肽对繁殖的诱导作用等[23,53,63,72-73]。在此过程,电生理学方法被广泛应用,将距离、刚度等物理信号转化为电信号是进行功能研究的有效手段,但结果容易受到个体差异的影响,因此实验对于样本的数量及重复次数有一定的要求。研究发现电生理学与其他光学成像技术相结合,可定位神经信号,因此将经典电生理学的时间分辨率和光学成像的空间分辨率相结合,将有助于神经科学领域实现重大发现,也是未来研究探索的方向之一。
在微观层面,通常利用干扰神经肽前体基因的转录或表达过程对神经肽及其前体的功能进行研究。基因编辑技术CRISPR/Cas9因使用便捷和较高的效率而广受欢迎,脱靶现象是目前该技术亟待攻克的难点,而且需要成熟的细胞培养技术。在棘皮动物中,基因编辑技术仅在模式生物海胆中成功应用,主要用于查明海胆胚胎发育、摄食习性、体色变化等生理过程中信号传导通路[74-77]。对于非模式物种,siRNA(Small interfering RNA)技术是CRISPR / Cas9的有效替代方法,siRNA是干扰基因表达的短链RNA分子,通过复杂的递送方法(例如转染),或者注射入生物体,可以诱导基因沉默,干扰神经肽的表达。该方法操作相对简单,但也存在很多问题,例如siRNA在生物体内易被降解,抑制的效果不确定性等,而且siRNA只是抑制基因的表达,未完全阻止其发挥作用,对于神经肽“高效”的作用特点,使得研究结果可能存在偏差。在棘皮动物中,已有研究者通过siRNA技术发现特定基因及蛋白在虾夷马粪海胆(Strongylocentrotusintermedius)脂肪酸代谢、刺参免疫防御等方面的潜在作用[78-79]。
4 参与调节棘皮动物生理功能的神经肽
神经肽及其关联的G蛋白偶联受体的系统发育分布的研究表明,至少有三十个神经肽信号系统的进化起源可以追溯到两侧对称动物的共同祖先[80-81]。与其他被充分表征的模式无脊椎动物相比,如黑腹果蝇、秀丽隐杆线虫和软体动物加利福尼亚海兔,棘皮动物神经肽信号传导系统的研究仍处于起步阶段。随着神经肽功能研究技术的不断革新,越来越多的研究表明神经肽可能参与介导棘皮动物特殊生理现象的调控,包括组织的刚度变化、个体发育及繁殖过程[8, 29, 63, 82]等。
4.1 调控肌肉刚度的神经肽研究进展
棘皮动物具有“可变的结缔组织”,使肌肉刚度迅速变化。目前尚不清楚结缔组织可变性潜在的分子和细胞机制,但有证据表明神经肽介导了棘皮动物结缔组织刚度的神经控制[28]。不同的神经肽家族对于肌肉刚度的影响存在差异。
1991年,García-Arrarás等通过药理学实验发现CCK型神经肽可诱导海参(Holothuriamexicana)肠道肌肉松弛,由此开启了神经肽对棘皮动物肌肉刚度影响的研究[83]。随着技术的发展和研究的不断深入,Calcitonin(CT)型、Luqin/RYamide型及stichopin等神经肽在不同物种的组织中都表现出对肌肉刚度的调控能力。例如,CT型神经肽对海星(A.rubens和Patiriapectinifera)顶端肌肉和管足的松弛、Luqin型神经肽对红海盘车管足的松弛及holokinin 1、holokinin 2和stichopin对刺参体壁结缔组织的收缩作用等[73, 84-85]。此外,Elphick等对刺参体壁中分离出的二十种肽序列基于转录组数据库重新进行了比对分析,推测GN-19、GLRFA、SWYG型、KIamide-9等神经肽在纵肌或肠道中起到收缩/舒张的作用[29]。
贲门胃外翻是海星摄食时的特殊行为,这一行为同样与肌肉刚度变化密切相关。体外药理学实验证明,PP/OK型神经肽可以引起海星P.pectinifera(顶端肌肉、管足、贲门胃)、A.rubens(贲门胃)和Asteriasamurensis(顶端肌肉)组织松弛,与原口动物PP/OK型神经肽对肌肉的收缩作用形成对比[10, 86],表明后口动物和原口动物的分化过程可能伴随着PP/ OK型神经肽作为肌肉活动调节因子的抑制-兴奋性的转变[53]。GnRH和CRZ型肽均可引起红海盘车贲门胃、顶端肌肉和管足的收缩[87],但两种神经肽的诱导作用似乎具有组织偏好性,例如,GnRH对贲门胃的收缩诱导比CRZ更有效,而在顶端肌肉组织中,CRZ效力更强[82],这种偏好性的分子机理有待进一步研究。
4.2 调节繁殖行为的神经肽研究进展
许多棘皮动物物种具有极高的营养价值和经济价值,如海胆、海参等。近年来,野生种群被过度捕捞,种群数量迅速下降,人工育种已成为种群增殖的有效途径。然而,水产养殖中物种增殖和繁殖面临巨大挑战,传统诱导产卵的方法,如热刺激等,对亲体损害程度较大,具有很多的缺陷。生殖相关神经肽为我们提供了新的研究视角。
海星Asteriasforbesi的桡神经提取物注入该物种后会诱发配子脱落,这是有关无脊椎动物的促性腺激素物质的首个报道[88],这种活性物质被称为性腺刺激物质(GSS),并在生化上被描述为肽激素[89]。Cochran和Engelmann从海胆桡神经中分离出一种5.6 kDa的热稳定多肽——RNF,可诱导雄性和雌性紫海胆产卵排精[90-91]。同样有研究发现海参的桡神经粗提物(RNE)和从海胆(e.g.,Echinometramathaei,Stomopneustesvariolaris,Paracentrotuslividus)的卵子提取物中富集的MIF(成熟诱导因子)可以刺激众多海参物种(H.leucospilota,Holothuriapervicax,Holothuriamoebi,Holothuriapardalis,A.japonicus,H.scabra)卵母细胞的成熟[92-94],但桡神经提取物的具体成分尚未确定。直到2009年,在海星P.pectini-fera中鉴定出一种蛋白,属于松弛素型(Relaxin)肽家族,GSS由此被命名为松弛素样性腺刺激肽(Relaxin-like gonad-stimulating)或RGP[95]。目前,几种神经肽被验证具有刺激卵母细胞成熟的功能,包括GSS、RGP、cubifrin(NGIWYamide, NGLWYamide)和QGLFSGVamide。
在海星[89, 96-97]和海参[93, 98]中,卵母细胞的成熟可由GSS直接刺激。例如,GSS诱导的红海盘车卵母细胞成熟和产卵[96],而SALMFamide型神经肽可以抑制A.pectinifera性腺刺激物质GSS的释放[97]。源自A.rubens和P.pectinifera的RGP均可诱导红海盘车卵巢片段中卵母细胞的成熟和排卵,但AruRGP比PpeRGP效力更强[96]。在另一海星物种——棘冠海星中,体外重组的RGP能够有效诱导卵母细胞成熟和排卵,由于未成熟的性腺缺乏具有活性的Gαs,RGP仅对处于成熟末期(卵母细胞直径> 150 μm)的卵母细胞的性腺有效[99]。
Cubifrin-I(NGIWYamide)及衍生物 Cubifrin-L(NGLWYamide)可在体外诱导刺参卵母细胞成熟,促进产卵过程[72, 100-101]。但该肽并非是所有海参物种卵母细胞成熟的“通用诱导剂”,在黑海参中则未发现其诱导作用[102]。最近的研究显示卵巢壁对于GVBD和卵母细胞成熟十分必要[72]。QGLFSGVamide在浓度大于1 μmol/L时可以诱导刺参生发泡破裂,然而,由于该肽的效力低,因此不建议将该肽作为卵母细胞成熟的主要调节剂[72]。Chaiyamoon等向糙海参注射短的TRH/GnRH样肽,同样可显著加速性腺发育,并刺激配子发生[63]。
值得注意的是,有些神经肽虽然尚未在棘皮动物中进行表征,但已在其他动物中被证明可以调控两侧对称动物繁殖进程,例如,Kisspeptin型、GnRH/CRZ型神经肽,这将是未来神经肽参与棘皮动物繁殖调控研究的重点。
4.3 参与生长过程的(摄食、变态前附着)神经肽研究进展
动物的生长特征是科学投喂、敌害生物防治、高效养殖过程中十分重要的参考依据,易受遗传、环境等多种因素的影响。目前关于棘皮动物生长过程的神经调节机制研究尚少。研究表明海胆中insulin(IL)-relaxin家族成员SpILP1和SpILP2(Insulin-like peptide),可能参与摄食行为的调控,其中SpILP1 神经肽及其前体蛋白的表达与投喂方式密切相关[103]。此外,对促甲状腺素释放激素(Thyrotropin-releasing hormone, TRH)及促肾上腺皮质激素释放激素(Corticotropin-releasing hormone, CRH)型神经肽前体在红海盘车幼虫体内定位的研究揭示了TRH及CRH在海星变态前附着过程中具有潜在作用[8]。
4.4 同时调控多种生理进程的神经肽研究进展
神经肽作为生物体内最大、最多样化的一类信息分子,通常一种神经肽可同时调控多种生理进程。
作为棘皮动物中研究最为充分的神经肽之一,SALMFamide神经肽不仅可以诱导红海盘车、黑海参和刺参多种组织(管足、肌肉、肠道)的松弛[15-17],还可以诱导海星贲门胃的外翻,参与摄食调节[16-17],并能够抑制Asterinapectinifera性腺刺激物质GSS的释放[97]。
两侧对称动物进化过程中高度保守的VP/OT型神经肽除去可以引发棘皮动物海星(A.rubens)贲门胃、顶端肌肉及海胆(S.purpuratus)管足、食道和肌肉组织的剂量依赖性收缩[23, 104],该神经肽还参与了棘皮动物的摄食行为的调节。此外,通过对VP/OT型神经肽前体的原位杂交定位,发现其在红海盘车幼虫的变态前附着过程具有潜在作用[8]。
NG/NPS/CCAP型神经肽家族在棘皮动物中主要表现为NG肽。NG肽家族的成员会引起棘皮动物的肌肉、触手、管足、食管、肠道等组织的收缩(例如海胆Echinusesculentus和红海盘车 NGFFFamide、刺参 NGIWYamide)[54, 104-106]。此外,NGFFYamide还可以影响红海盘车幼虫口周围的纤毛摆动,降低运动能力[8, 54]。
4.5 棘皮动物神经肽受体的研究进展
神经肽主要结合并激活G蛋白偶联受体(GPCR)来发挥作用,GPCR包括六个家族,大多数肽受体属于视紫红质rhodopsin或促胰液素secretin家族[107]。相较于脊椎动物,棘皮动物中神经肽受体的研究起步较晚。近年来,随着组学的发展,棘皮动物基因组、转录组及多肽组序列数据相继发表,为神经肽受体的鉴定提供了可能。目前,在紫海胆、红海盘车、海星和刺参等物种中分别鉴定到多个GPCR(见表 2),其中,在紫海胆中最多,为44种。当前在红海盘车中已鉴定到与VP/OT型、NGFFF型、Luqin型以及Short Neuropeptide F/Prolactin-releasing peptide(sNPF/PrRP)等神经肽的受体,并发现与神经肽结合后在肌肉刚度、摄食、运动等行为中发挥重要作用[23, 54],sNPF/PrRP神经肽受体的发掘将原口动物sNPF和脊椎动物PrRP连接起来,重建了PrRP/sNPF型神经肽进化历史[108]。在刺参中,同样确认了Kisspeptin受体在介导Kisspeptin型神经肽参与刺参的代谢和生殖过程中的关键作用[109]。
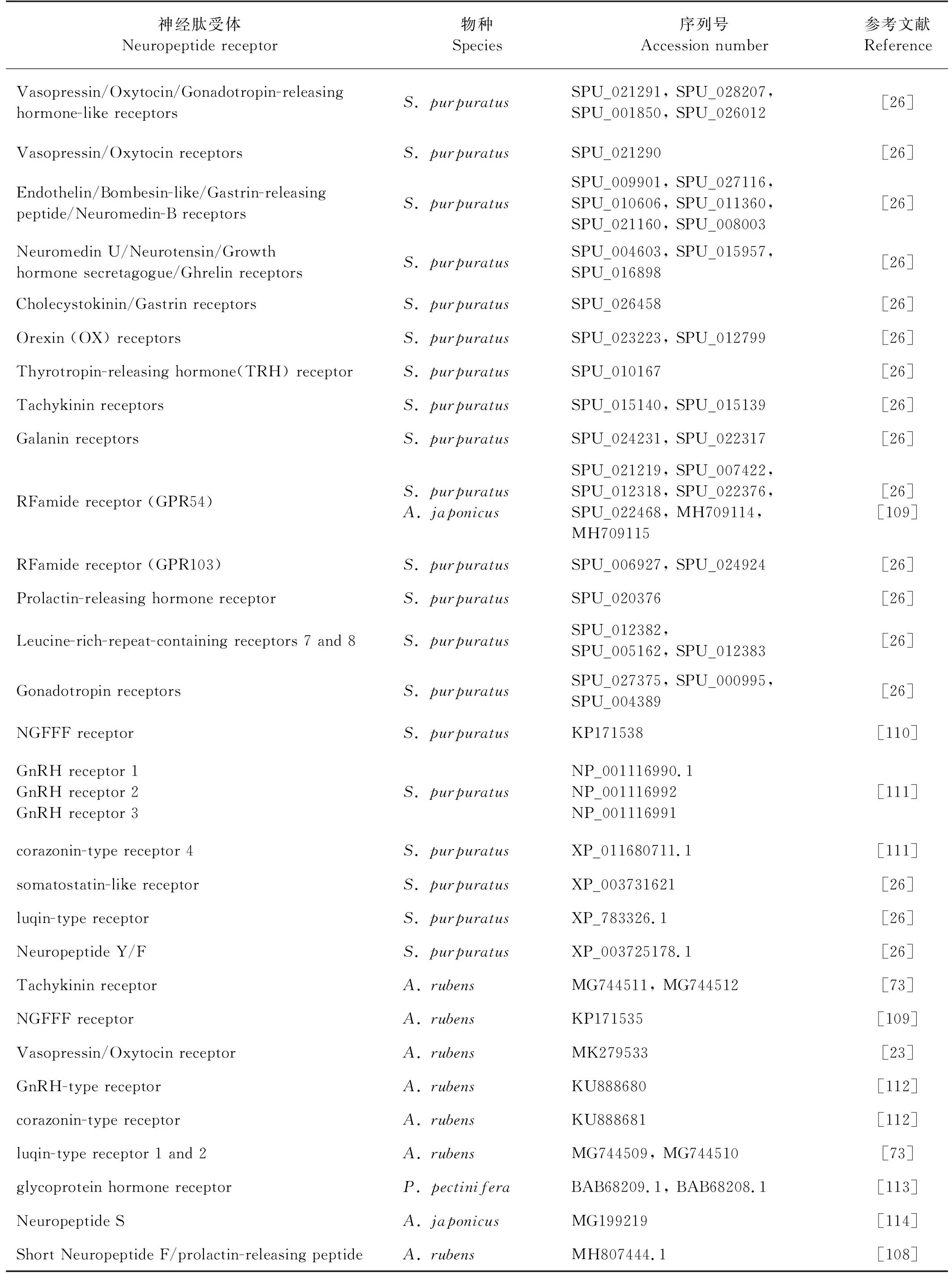
表2 棘皮动物神经肽受体
5 同一神经肽在不同棘皮动物物种中的功能比较
肽类物质作为细胞间信号分子(神经递质,神经调节剂或神经激素)释放,是神经元进化的古老特性。不同物种中同一神经肽的GPCR种类、数量等差异可能会对神经肽的功能或效力产生直接影响,因此同一神经肽在不同棘皮动物中的功能比较有助于更深刻地理解神经肽的作用机制。
VP/OT型神经肽家族在两侧对称动物中十分保守,可以调节多种功能。在棘皮动物中,通过体外药理学研究,发现VP/OT型神经肽可诱导红海盘车贲门胃、顶端肌肉的松弛,这与海胆E.esculentusVP/OT型神经肽促进管足和食道的肌肉收缩作用相反[14, 104, 115]。NG型神经肽NGIWYamide及其衍生物NGLWYamide可在体外诱导刺参卵母细胞成熟,而在黑海参中未发现诱导作用[72, 100-102]。PP/OK型神经肽在后口和原口动物间表现出功能的分化[53]。PPLN神经肽在棘皮动物中可以引起多种海星物种(P.pectinifera、A.rubens、Asteriasamurensis)的肌肉组织松弛,与其在原口动物中的肌肉收缩作用形成对比[10, 86]。
随着神经肽功能表征的不断丰富和补充,神经肽在生理调节过程中表现出的“物种特异性”可能会扩展到更多的神经肽家族,那时,对于产生这种差异的内在机制将初见端倪,为进一步了解神经肽如何调节生物体生命活动提供更全面的诠释。
6 研究展望
过去的十年,神经肽领域取得了快速的发展,神经肽对动物生理、行为的调控一直是研究的重点和热点。基因组、转录组序列数据的不断丰富促进了棘皮动物神经肽信号系统的功能表征[26, 34]。系统发育分析揭示至少30个神经肽信号系统的进化起源可以追溯到两侧对称动物的共同祖先[81],对于从功能保守性的角度揭示神经肽家族的生理作用大有裨益。众多神经肽信号分子的表征为棘皮动物的生殖、摄食及运动等生理过程的调控机制提供了全新的视角,尤其为极具营养价值的海洋经济物种(紫海胆、刺参等)的健康养殖开辟了更加高效、绿色的途径[11, 101];然而在两侧对称动物中,相较于某些神经肽被充分表征的生物(如加利福尼亚海兔、秀丽隐杆线虫等),棘皮动物神经肽研究仍然起步较晚,进展缓慢。因此,部分重要神经肽功能的鉴定和受体家族的发掘,包括在棘皮动物中已被鉴定,并在其他生物中验证具有重要或者特殊调控功能的神经肽以及棘皮动物中特有的神经肽,将是未来棘皮动物神经肽研究的重点。
6.1 KPP型神经肽(Kisspeptin-type neuropeptide)
2001年孤儿受体GPR54的内源性配体被鉴定,其衍生自转移抑制蛋白KiSS-1,具有C端RFamide基序,被称为Kisspeptin[116]。棘皮动物紫海胆、红海盘车、刺参与脊椎动物斑马鱼(Daniorerio)、海七鳃鳗(Petromyzonmarinus)、智人(Homosapiens)等物种的Kisspeptin型神经肽都具有预测的C末端LxF-NH2基序,而这一特征在半索动物囊舌虫(Saccoglossuskowalevskii)与头索动物文昌鱼(Branchiostomafloridae)中丢失,而在所有物种中C末端都发生了酰胺化,对该肽的生物活性十分关键[117-118]。kisspeptin信号系统生理作用的研究表明,其在调节哺乳动物(如绵羊、猪、大鼠等)的生殖过程和鱼类(如青鳉(Oryziaslatipes) 、军曹鱼(Rachycentroncanadum)等)早期发育中具有古老的作用,主要表现为对性腺发育的促进作用、神经肽及受体突变导致的性腺功能减退等方面[119-124]。同时还发现Kisspeptin是HPG轴重要物质GnRH分泌的有效刺激物[117]。例如斑马鱼(Daniorerio)tachykinins家族成员可以与Kisspeptin相互作用以控制GnRH的释放,从而调节繁殖过程,但这种相互作用的内在机制仍然未知[121]。此外,Kisspeptin可以受胰高血糖素的调控从而抑制胰岛素的分泌[125]。Yap等研究发现kisspeptin和生物的昼夜节律有明确的联系[126],从而暗示该神经肽可能参与能量平衡和代谢过程。目前该神经肽已在棘皮动物的紫海胆、红海盘车、刺参及三个海蛇尾物种(Ophionotusvictoriae、Amphiurafiliformis、Ophiopsilaaranea)中得以鉴定[35,37-38,41,43]。近期研究发现,在海参物种——刺参A.japonicus中Kisspeptin型神经肽可参与刺参的代谢和生殖过程[109]。作为多种生理角色的调节者,Kisspeptin在棘皮动物中的功能表征令人期待。
6.2 PDF型神经肽(Pigment-dispersing factor-type neuropeptide)
PDF型神经肽首先在甲壳动物北极甜虾(Pandalusborealis)中被发现[127]。在目前已被鉴定的棘皮动物中,PDF型神经肽具有两种亚型,其中红海盘车、刺参中只有一个亚型C末端发生了酰胺化,紫海胆中两个亚型C末端均具有该现象,当前这两种神经肽的活性及功能差异还不明晰[37, 41, 80]。值得注意的是,目前仅在刺参A.japonicus中发现PDF型神经肽衍生自两个神经肽前体,且其mRNA具有可变剪切现象,而剪切位点位于非活性片段中[37]。因此,关于刺参中两种PDF型前体同工型发生的功能意义及特殊的可变剪切模式对于深入理解神经肽结构进化意义匪浅。与之相对应,在所有非棘皮动物中,例如秀丽隐杆线虫(C.elegans)、霸王莲花青螺(Lottiagigantea)、环节动物海蠕虫(Capitellateleta)、黑腹果蝇(D.melanogaster)及水熊虫(Hypsibiusdujardini)等,通常仅具有一种PDF型神经肽,并且C末端均发生了酰胺化修饰[128-131]。
PDF型神经肽已在众多节肢动物和其他原口无脊椎动物(包括线型动物和冠轮动物)中得到了表征[127-132]。PDF型肽在原口动物中具有多种生理功能,包括调节色素迁移,运动的昼夜节律,产卵和摄食行为[127-129, 132]。棘皮动物中PDF型神经肽已在紫海胆、红海盘车、刺参及三个海蛇尾物种(O.victoriae、A.filiformis、O.aranea)中被鉴定,但其生理作用尚未在棘皮动物中报道[35, 37-43]。
另有一些神经肽,例如SALMFamide型神经肽,目前仅在棘皮动物中被鉴定,这类物种或者门类特异性以及在序列上与其他物种具有较大差异的神经肽,是否会由序列特异性体现为个体功能或行为的特异性,将为棘皮动物生理调控机制带来重大见解。基于质谱和生物信息学鉴定的某些神经肽,在棘皮动物中序列十分保守,例如np8、np9、np11、np15、np17、np18、np20、np21、np23和np25,已在多种棘皮动物物种中被发现,但目前尚未在任何物种中进行功能表征[35,37,38-43]。如何通过功能鉴定和受体发掘来建立更好的系统发育体系使之与现有神经肽家族建立联系,是深入理解两侧对称动物神经肽信号系统的进化历程亟待解决的关键问题,将为两侧对称动物神经肽生理行为调控网络提供重要的节点。在后基因组时代,棘皮动物特殊的进化地位、成体的五辐对称、胶原组织的可变性及特殊生理现象也将为两侧对称动物神经肽功能调控版图提供独特视角。

