全自动IdyllaTM系统在中国结直肠癌微卫星不稳定性检测中的可行性研究
王 乾,张 静,郁成礼,包龙龙,蔡 旭,蒋文华,黄 丹,盛伟琪,朱晓丽,周晓燕,柏乾明
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,复旦大学病理研究所,上海 200032
结直肠癌(colorectal cancer,CRC)的发病率和死亡率分别居全球第3位和第4位,12%~ 15%的CRC患者存在错配修复缺陷(deficient mismatch repair,dMMR),表现为高度微卫星不稳定(microsatellite instability-high,MSI-H)[1-2]。遗传性非息肉病性CRC(hereditary nonpolyposis CRC,HNPCC),也称为林奇综合征,其特征为MMR基因通常包括MLH1、MSH2、MSH6和PMS2胚系突变[3]。然而,大多数MSI-H病例是散发性的,通常是由于MLH1的表观遗传沉默所导致的[4]。目前,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐在晚期CRC患者中常规检测MMR/MSI状态,用以筛查林奇综合征并预测实体瘤对免疫检查点抑制剂的治疗反应。
常规MMR/MSI检测中,多重荧光聚合酶链反应(polymerase chain reaction,PCR)毛细管电泳法检测MSI状态被视为金标准,免疫组织化学(immunochemistry,IHC)因其物美价廉通常被临床选择用于dMMR的筛查。然而,由于MMR系统存在功能补偿,当IHC检测MMR蛋白发生缺失时,未必会导致MSI升高,仍可呈微卫星稳定(microsatellite stable,MSS)状态;反之,当编码MMR蛋白的基因发生错义突变时,MMR蛋白功能异常,但并未影响其抗原结构,在这种情况下,IHC仍能够检测到MMR蛋白的表达,但其MMR功能是异常的,MSI的检测结果为MSI-H。因此,在临床工作中,5%~ 10%的CRC病例IHC与PCR检测MMR/MSI结果会出现不一致的现象,给临床医师和患者带来诸多困惑[5-7]。此外,由于IHC方法的实验室间和实验室内差异以及所使用的抗体和病理学家判读水平的差异均可能造成实验结果出现误差,所以,精确度更高的Promega MSI检测系统在临床研究中得到广泛认可[8-9]。然而,Promega MSI检测系统需要比较非肿瘤正常组织微卫星标记等位基因图谱,并且检测周期在临床实践中为3~ 5 d,给临床治疗,尤其是病情严重恶化的晚期肿瘤患者带来诸多不便[10]。因此,国内迫切需要用于MSI快速检测的自动化平台。
基于实时荧光定量PCR的IdyllaTMMSI检测系统(比利时Biocartis公司)通过集成DNA提取、热循环、荧光检测和结果报告于一体,为临床MSI检测提供快速解决方案。全自动工作流程仅需2.5 h即可确定MSI状态,并且不需要非肿瘤正常组织作为对照。IdyllaTMMSI检测在白种人群CRC患者中已被广泛验证为快速、准确和可靠的实验方法,但在中国CRC患者中的应用尚缺乏足够的临床依据[11-13]。本研究通过与传统IHC和Promega MSI检测系统比较,评估IdyllaTMMSI检测在中国CRC患者中的临床可靠性。
1 资料和方法
1.1 入组病例
回顾性收集2017年3月—2019年3月复旦大学附属肿瘤医院病理科经IHC或Promega MSI检测为dMMR/MMR完整(proficient MMR,pMMR)或MSI-H/MSS的87例CRC患者。为更好地验证IdyllaTMMSI检测系统的性能指标,优先选择dMMR/MSI-H的CRC患者,包括56例dMMR/MSI-H和31例pMMR/MSS CRC患者。所有样本均来自CRC根治性手术切除标本,并经病理学检查确诊为腺癌。所有入组样本补齐MMR蛋白(包括MLH1、MSH2、MSH6、PMS2)IHC检测或Promega MSI检测,并全部进行IdyllaTMMSI检测。通过与Promega MSI/IHC比较,评估IdyllaTMMSI检测系统的灵敏度和特异度。当检测结果不一致时,进行必要的重复检测,或通过显微切割富集肿瘤组织后再重复检测。本研究已通过复旦大学附属肿瘤医院伦理委员会的审查与批准,所有入组患者均已签署知情同意书。
1.2 IHC检测方法
获取所有患者肿瘤组织4 μm厚石蜡包埋切片进行MMR蛋白(MLH1、MSH2、MSH6和PMS2)IHC检测。所有4个MMR标记在肿瘤细胞核中均有表达时,判定为pMMR;4个MMR标记中任何一个标记在肿瘤细胞核中表达完全缺失时,则判定为dMMR。所有IHC结果均由2名经验丰富的病理科医师阅片。每张切片上均设置合适的阴性、阳性对照。
1.3 Promega MSI检测方法
Promega MSI检测系统(美国Promega公司)是通过检测5种单核苷酸标记(BAT-25、BAT-26、NR-21、NR-24、MONO-27),并与正常对照组织比较,当≥2/5的单核苷酸标记所对应的峰型或位置发生改变时,判定为MSI-H;仅1个标记发生改变时,判定为低度MSI(MSI-low,MSI-L);无标志物发生改变时,判定为MSS[14]。
1.4 IdyllaTM MSI检测方法
IdyllaTMMSI检测系统包括1组7种新型标志物(ACVR2A、BTBD7、DIDO1、MRE11、RYR3、SEC31A、SULF2)。具体操作步骤依据说明书与实验室相关标准操作规范文件进行。简单地说,将肿瘤用40%甲醛溶液固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)组织连续切取5张5~ 10 μm厚度切片,第1、5张用于H-E染色,并评估肿瘤细胞百分比。第2~ 4张切片放置于去离子水浸湿的滤纸上,并将其平铺至载玻片上,然后,在上层覆盖同样被去离子水浸湿的滤纸构成“三明治”结构,将其转入IdyllaTMMSI检测试剂盒内,准备上机。上机时,扫描IdyllaTMMSI检测试剂盒上的二维码,输入肿瘤组织病理学编号后放入IdyllaTMMSI检测系统中,点击开始,2.5 h后即可读取结果。每个标记单独评分,以0~ 1之间的分值表示,当分值≤0.5时,报告为“未检测到突变”;当分值>0.5时,报告为“检测到突变”;当某孔指标无有效扩增信号时,报告为“无效”。7个MSI新型标志物中≥5个显示为有效的扩增信号时,则认为该测试结果有效。如果7个标志物中的2个或2个以上显示为“检测到突变”(阳性),则该例MSI检测结果判定为MSI-H,如果7个标志物中少于2个阳性,则判定为MSS。
1.5 统计学处理
两组间比较检测结果的差异采用t检验,多组间比较检测结果的差异采用χ2检验。使用SPSS Statistics 23.0版对数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 87例CRC患者的临床病理学特征及IHC、Promega和IdyllaTM 3种方法检测MMR/MSI状态的比较
本研究中87例CRC患者的临床病理学特征见表1。其中55例(63.2%)患者为男性,61例(70.1%)患者的发病年龄>50岁,组织病理学诊断均为肠腺癌,86例(98.9%)患者的肿瘤含量≥20%。
应用IHC、Promega和IdyllaTM3种方法检测MMR/MSI状态,结果显示,IHC和Promega两种方法的检测结果完全一致,其中56例被确定为dMMR/MSI-H,31例为pMMR/MSS。dMMR/MSI-H的CRC患者更常见于Ⅱ期(75.7%,28/37)、右侧结直肠腺癌(82.2%,37/45)中,差异有统计学意义(P<0.05)。IHC结果显示,在dMMR CRC患者中,MLH1/PMS2共缺失最常见,高达76.8%(43/56),其次为MSH2/MSH6共缺失,为23.2%(13/56),本研究中未见其他dMMR缺失(表1)。然而,其中4例dMMR/MSI-H患者被IdyllaTMMSI系统诊断为MSS,1例pMMR/MSS患者被诊断为MSI-H。若以IHC/Promega为标准,IdyllaTMMSI系统的诊断灵敏度为92.9%(52/56),特异度为96.8%(30/31),总体一致率达94.3%(82/87)。
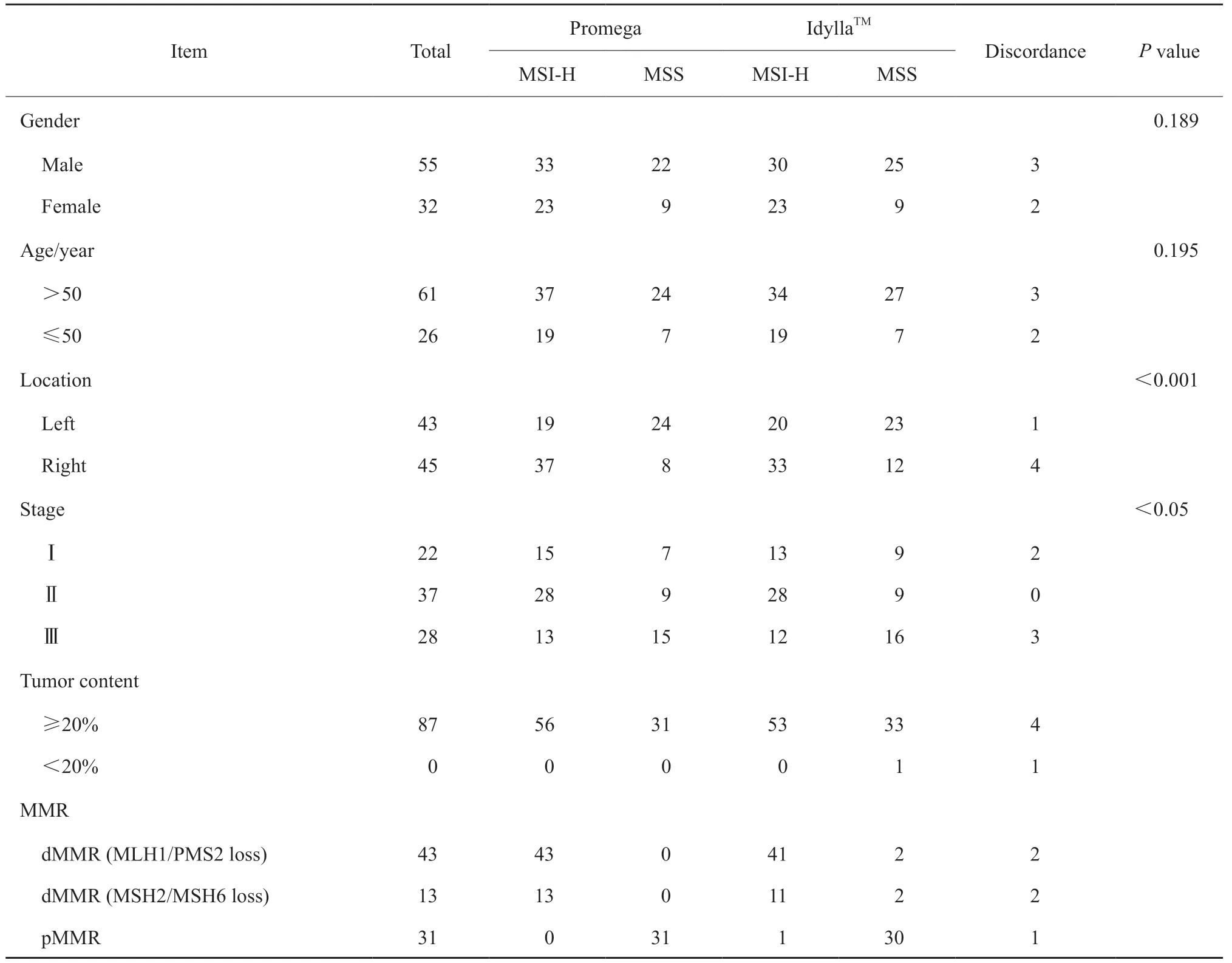
表1 87例中国CRC患者临床病理学特征及IHC、Progema和IdyllaTM 3种方法检测MMR/MSI状态Tab.1 Clinicopathological characteristics and MMR/MSI status detected by IHC and both Progema and IdyllaTM MSI analysis in 87 cases of Chinese CRC
2.2 IdyllaTM MSI系统对5例不一致病例重复检测结果
如上所述,与传统IHC/Promega检测相比,IdyllaTMMSI检测结果有5例CRC患者的MMR/MSI状态存在不一致,包括4例假阴性和1例假阳性。为进一步探究不一致的原因,5例原始FFPE样本被IdyllaTMMSI系统重复检测。结果显示,3例假阴性病例(病例17、22、26)被确定为MSI-H,1例假阳性病例(病例4)为MSS,与Promega MSI和IHC检测结果一致,且该4例肿瘤含量 均≥20%。然而,仍有1例(病例55)MSI状态不一致,该例肿瘤含量仅为5%。对该病例通过激光捕获显微切割技术富集肿瘤组织后,再次应用IdyllaTMMSI系统重复检测,结果显示为MSI-H,与Promega MSI/IHC一致(图1)。

图1 肿瘤含量仅为5%的病例55的检测流程图Fig.1 Test flow chart of case 55 with tumor content of only 5%
2.3 IdyllaTM MSI系统重复性验证
由于IdyllaTMMSI检测系统对5例不一致患者的两次检测结果存在差异,因此,IdyllaTMMSI检测系统的可重复性需被再次验证。选取5例具有不同肿瘤占比(20%~ 60%不等)的原始FFPE样本,包括4例dMMR/MSI-H和1例pMMR/MSS病例。分别获取5张连续组织切片(第1~ 5片),其中第1片和第5片均行H-E染色,用以评估肿瘤含量,均显示出相似的肿瘤含量。再选取第2~ 4片分别用IdyllaTMMSI系统进行3次重复检测。3次重复检测的最终判定结果均相同,且与IHC/Promega MSI分析结果完全一致。进一步分析IdyllaTMMSI系统中各标志物的可重复性,ACVR2A、BTBD7、DIDO1、MRE11和RYR3 5个标志物的分值在5例患者的3次重复中均高度相似。然而,病例39中的SEC31A标记和病例28中的SULF2标记所对应的分值在3次重复中显示出不同的结果,尤其病例28中的SULF2,第4片的MSI分数(0.92)远高于第2、3片的分数(0.02、0.01),详见表2。

表2 采用IdyllaTM MSI重复性检测分析7个新型标志物MSI分值的变化Tab.2 The changes of MSI scores of 7 novel markers were analyzed by IdyllaTM MSI repeatability test
3 讨论
本研究回顾性收集87例中国CRC患者的临床病理学资料,经IHC和Promega MSI分析MMR/MSI状态,56例被判定为dMMR/MSI-H,31例为pMMR/MSS。以IHC/Promega检测结果为参考标准,IdyllaTMMSI系统的诊断灵敏度为92.9%,特异度为96.8%,总体一致率达94.3%。对5例检测结果不一致的患者,应用IdyllaTMMSI系统重复检测,结果显示,除1例肿瘤含量仅为5%的病例外,其余4例肿瘤含量≥20%的病例复核结果均与IHC/Promega完全一致。此外,选取5例伴有不同肿瘤含量(20%~ 60%)的CRC组织样本,应用连续组织切片对IdyllaTMMSI检测系统的重复性进行验证,结果显示,3次重复检测的结论均相同,且与IHC/Promega MSI分析结果完全一致,表明IdyllaTMMSI检测系统在肿瘤含量≥20%的CRC中具有良好的可重复性。因此,IdyllaTMMSI检测系统可以为临床MSI检测提供一种快速、可靠、全自动的解决方案,并具有较高的灵敏度、特异度和可重复性。
2017年5月,美国食品和药物管理局(Food and Drug Administration,FDA)正式批准使用派姆单抗单药治疗具有MSI-H/dMMR的多种实体瘤[15-17]。然而,IHC和Promega MSI作为常规检测实验已无法满足快速增长的检测需求。Promega MSI处理步骤包括脱蜡、组织裂解、DNA提取、热循环和数据解释等,在临床实践中需3~ 5 d才能完成。而IHC需要严格的实验室间和实验室内质控,且医师在判断时存在主观性,容易产生假阴性或假阳性结果,影响患者后续治疗。相比之下,IdyllaTMMSI检测系统操作方法简便,运行周期短(2.5 h),整个工作流程在封闭系统中进行,可最大限度地降低污染风险。IdyllaTMMSI检测系统选取的7种新型标志物在高加索人、非洲人、亚洲人和美国人中均被证实存在[18]。此外,这些标志物的探针易组合在一起,从而实现多重检测[19]。同时,这些标志物还与生物信息技术和各种缓冲系统兼容,读数与数学变换算法兼容,以最大限度地区分MSS与MSI-H[20]。
本研究中IdyllaTMMSI系统首次检测87例CRC样本时,有5例结果与传统IHC/Promega方法不一致,其中4例在IdyllaTM系统重复检测中得以纠正,但仍有1例肿瘤含量仅为5%的病例,IdyllaTMMSI检测结果呈假阴性。通过激光捕获显微切割技术富集肿瘤组织后,IdyllaTMMSI检测再次复核的结果最终被纠正,呈MSI-H状态。进一步应用5例伴有不同肿瘤含量的连续组织切片评估IdyllaTMMSI检测系统可重复性时,结果发现7种新型标志物均具有较好的可重复性,且5例样本的3次重复性检测的结论均完全一致,但个别样本中标志物SEC31A和SULF2的MSI分值出现较大波动,可能与肿瘤内异质性相关[21]。这些研究结果提示在临床实际工作中应用IdyllaTM系统检测MSI状态时,应特别注意如下几种情况:①当送检样本中肿瘤占比小于该系统推荐的阈值(20%)时[22],需对肿瘤细胞富集后再行后续检测;② 当该系统检测结果与常规IHC或Promega等检测结果出现不一致时,应再次复核或用第3种方法验证;③当该系统结果提示7种标志物中1~ 3种标志物发生突变时,即结论为临界阳性或阴性时,应仔细复核原始数据中各标志物的分值,必要时再次重复检测;④ 尽管对于MSI-L的生物学意义仍存在争议,但IdyllaTM系统不能区分MSS和MSI-L[23],后续研究中应进一步关注。
虽然本研究结果在相对较小的样本量中得到验证,仍存在一定的局限性,但整体而言,对于肿瘤含量≥20%的CRC患者,IdyllaTMMSI检测系统可以为临床MSI检测提供一种快速、可靠、全自动的解决方案,并具有较高的灵敏度、特异度和可重复性,具有较好的临床应用前景。
利益冲突声明:所有作者均声明不存在利益冲突。

