新型可溶性环氧化物水解酶抑制剂TPPU 对缺血性脑卒中的保护机制
黄攀 易兴阳 (德阳市人民医院,四川 德阳 618000)
花生四烯酸(AA)是人体内心脑血管活性物质的前体,其代谢产物与脑血管病的发病密切相关〔1〕。AA 的细胞色素P450(CYP)代谢通路是近年研究的热点〔2〕。AA 在CYP 羟化酶作用下生成羟基二十碳四烯酸(HETEs),在CYP 表氧化酶作用下生成环氧二十碳三烯酸(EETs),EETs 再经过可溶性环氧化物水解酶(sEH)作用下生成生物活性较弱的二羟基二十碳三烯酸(DHETs)。HETEs 具有强力的脑血管收缩作用和促动脉粥样硬化作用。而EETs 具有扩血管、调节离子通道、抗动脉粥样硬化等多种生物学功能,对心脑血管具有保护作用。研究显示AA 的CYP 代谢通路代谢产物(EETs 和HETEs)水平与急性缺血性脑卒中后神经功能恶化密切相关〔3,4〕,提示其在脑缺血性损伤中可能发挥重要作用。sEH 是调控EETs 的关键限速酶。研究显示外周血EETs 降低不仅与缺血性脑卒中后神经功能恶化密切相关,还与脑梗死患者颈动脉狭窄程度和斑块不稳定密切相关,并受编码sEH 基因(EPHX2)的调控〔5~7〕。而另有研究表明,EPHX2 基因敲除可增加动脉中动脉阻塞模型大鼠脑血流量,减少梗死体积,对脑缺血具有保护作用,sEH 被认为是缺血性脑卒中防治的新靶点〔8〕。1-三氟甲氧基苯基-3(1-丙酰哌啶-4-基)脲(TPPU)是一种新型的sEH抑制剂,通过抑制sEH 的活性发挥脑血管保护作用,本文对TPPU 发挥的脑卒中保护机制进行综述。
1 缺血性脑卒中的治疗现状
缺血性脑卒中发病率高,占所有脑卒中的80%左右,溶栓治疗和神经保护治疗是其两大主要治疗策略。重组组织型纤溶酶原激活(rt-PA)是唯一获得批准的缺血性卒中的溶栓药物,其溶栓疗效已经在临床实践得到证实〔9〕。由于受到时间窗狭窄(发病后4.5 h 内)和颅内出血风险的限制,限制了溶栓治疗在临床上的广泛应用,因此,神经保护治疗一直是缺血性卒中治疗领域的梦想和希望。近30 年来,针对脑缺血病理生理环节开发了多种神经保护剂,如抗氧化剂、钙通道拮抗剂、兴奋性氨基酸受体抑制剂和神经营养因子等,全球进行了1 000 多个脑保护实验研究和100 多个临床研究,大多在动物实验有效而临床试验无效,导致临床转化失败〔10〕。迄今尚无有效的神经保护剂获得临床指南推荐〔11〕,但是人类研发有效神经保护剂的探索一直没有终止。
2 sEH 抑制剂对脑缺血保护的研究现状
针对sEH 的神经保护是近年关注的热点,虽然EPHX2 基因敲除对实验性脑缺血有保护作用,但EPHX2 基因敲除要用于临床预防和治疗缺血性脑卒中还相当遥远,因此sEH 抑制剂研发倍受关注。2005 年将sEH 抑制剂12-(3-金刚烷-1-基脲基)-十二烷酸(AUDA)应用在脑缺血神经保护实验研究中,证实其对实验性脑缺血有保护作用〔12〕。2007年又证实了另一种sEH 抑制剂转-4〔4-(3-金刚烷-1-基脲基)-环己氧基〕-苯甲酸(t-AUCB)能改善脑血流,对实验性脑缺血有保护作用。AUDA 和t-AUCB通过抗凋亡、抗氧化、抗炎、抑制Ca2+内流、线粒体保护、拮抗N-甲基-D-天冬氨酸受体(NMDAR)介导的兴奋毒性等多种机制发挥脑保护作用〔13〕。但这两种传统sEH 抑制剂从胃肠道吸收差,生物利用度低,要达到有效血药浓度所用的药物剂量必须够大,药物易在体内蓄积,不良反应较大,动物耐受性差,同时发现这些传统的sEH 抑制剂半衰期短,体内血药浓度不稳定,这些原因导致传统sEH 抑制剂临床转化失败。
3 TPPU 概述
TPPU 是2012 年由加利福尼亚大学兽医学院分子生物科学中心Bruce 教授等合成的一种新型sEH抑制剂〔14〕。TPPU 分子量为359.3,容易透过血脑屏障与中枢神经系统的sEH 结合,抑制sEH 活性(见图1)。猴体内药代动力学表明〔15〕,与传统sEH抑制剂相比,TPPU 表观分布容积和浓度-时间曲线下面积大,生物利用度高,半衰期长,1 次/d 即能维持有效血药浓度,可逆、非竞争性抑制sEH 电流,解离速度快,不会明显蓄积而影响正常的神经突触传导,动物耐受性好。心脏动物模型研究也表明〔16〕,TPPU 可预防心肌梗死后心肌纤维化,具有抗凋亡、抗氧化、保护线粒体等多种功能。
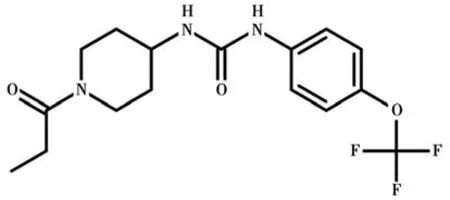
图1 TPPU 分子结构
4 TPPU 对脑卒中的保护机制
4.1 TPPU 抑制脑卒中后的炎症反应 炎症反应不仅可导致脑梗死的发生,而脑梗死的发生也可进一步激活炎症反应进而形成恶性循环〔17〕。研究显示脑梗死后炎症反应便开始进行,可加重脑组织的损伤。白细胞介素(IL)-1 及IL-6 是介导白细胞间相互作用的细胞因子,研究显示二者可作为评估脑梗死不良预后的独立标志物,但仍不能超越美国国立卫生院脑卒中量表(NIHSS)评分的价值〔18,19〕,而肿瘤坏死因子(TNF)-α 可由多种细胞产生,其过度表达可引起脂代谢紊乱、胰岛素抵抗,加重脑梗死后病情的严重程度〔20〕。Tu 等〔21〕通过建立脑梗死小鼠模型后给予TPPU 1 mg/kg 结果发现,TPPU 能明显促进小鼠神经功能恢复及减少梗死体积及炎症细胞因子IL-1β mRNA 和TNF-α mRNA 的表达,提示TPPU 可能通过减少梗死后炎症反应进而促进神经功能恢复。
4.2 TPPU 维持血管稳态作用 血管结构和功能稳态平衡是人体生理活动的基础,一旦血管稳态发生失衡将导致多种疾病〔22〕。血管损伤是导致血管稳态失衡的原因之一,脑梗死发生后必然造成血管损伤,而血管损伤后血管外膜发生相应的变化。研究显示在猪冠状动脉发生球囊拉伸损伤0.5 h后外膜即可检测到中性粒细胞,而内中膜需要更晚时间才能检测到;而对大鼠的颈动脉给予球囊拉伸损伤后最早在外膜可检测到血管内皮生长因子〔23〕。说明血管外膜是血管性疾病的起始部位及积极参与者,是治疗血管功能异常的新靶点之一,通过对血管外膜的保护可减少血管稳态的失衡进一步加重进而促进疾病的愈合。AngⅡ相关制剂能导致血管壁增厚、胶原沉积,影响血管外膜的重塑造进而造成血管稳态失衡,而研究者对AngⅡ模型小鼠给予TPPU干预后发现能明显阻止AngⅡ诱导的血管外膜的损伤,并且进一步体外研究还发现TPPU 可能是通过Ca2+-钙调蛋白/活化T-细胞核因子(NFATc)3 信号通路影响胶原蛋白的合成发挥作用的,提示TPPU可能是治疗血管外膜损伤新途径之一〔24〕。
4.3 TPPU 保护血脑屏障作用 神经元、星形胶质细胞、血管内皮细胞是构成神经血管单元(NCU)的核心成员;血脑屏障(BBB),包括内皮细胞、基底膜、星形胶质细胞的足突和周细胞是NCU 的核心结构,其中血管内皮细胞间的紧密连接(TJ)是保持血脑屏障完整性的关键部位,TJ 主要由跨膜蛋白(claudin、occludin 和JAM)和膜相关蛋白(ZO-1、扣带蛋白)共同组成。基底膜包绕在脑毛细血管外的膜性结构,周细胞镶嵌其中,是维持BBB 功能的重要组成部分。基底膜破坏可导致脑血管内皮细胞骨架破坏,影响内皮细胞紧密连接,导致BBB 通透性增加。基底膜由蛋白和多糖组成,能被基质金属蛋白酶(MMPs)家族降解,脑缺血后MMP9、MMP3 的显著升高与BBB 破坏密切相关。星形胶质细胞作为中枢神经系统最多的一类细胞,其终足包绕大部分的脑毛细血管,是BBB 的重要组成成分之一。星形胶质细胞膜上有丰富的水通道蛋白(AQP)4 表达,AQP4 是脑脊液重吸收、渗透压调节、脑水肿形成等生理、病理过程的分子生物学基础。脑缺血早期主要病理改变是BBB 通透性增加,引起脑水肿,因此,NCU 保护的关键是保护BBB,抑制通透性增加,减轻脑水肿〔25〕。研究发现TPPU 能明显减轻脑梗死后模型大鼠BBB 的损伤,其机制为TPPU 能增加与BBB 有关的连接蛋白ZO-1、occludin 及claudin-5 的表达量。此外,TPPU 还能降低血管内皮细胞的损伤进而减轻BBB 的破坏〔26〕。
4.4 TPPU 增加脑灌注作用 脑梗死发生后灌注量的减少是导致神经功能加重的重要原因,低灌注不仅能刺激局部炎症反应加剧,还能导致过多的氧自由基被激活进而导致病情加重〔27〕。Hao 等〔28〕通过建立线圈型颈动脉狭窄模型,使用TPPU 干预后发现小鼠的神经功能较对照组明显改善,进一步基础研究显示TPPU 对脑低灌注的神经保护作用可能与激活神经调节素(NRG)1/酪氨酸激酶受体(ErbB)4信号通路有关,并能进一步触发磷脂酰肌醇-3-激酶(PI3K)-蛋白激酶B(Akt)通路,提示TPPU 可发挥多靶点保护作用,减轻小鼠慢性脑低灌注的神经损伤程度。脑梗死后脑灌注的增加也是导致神经功能恶化的原因之一,因此探索合适的TPPU 治疗剂量使二者达到平衡尤为重要。综上,TPPU 可通过多种途径干预缺血性脑卒中,可能是治疗急性缺血性脑卒中的新途径、新靶点之一。然而,目前有关于TPPU 治疗急性缺血性脑卒中仍处于试验探索阶段,需要更多研究进行论证。

