阿司匹林对慢性萎缩性胃炎患者胃黏膜分泌功能血清学检测及出血风险的影响
王于梅,唐尚军,张艳芳
(重庆市黔江中心医院,重庆 409099)
慢性萎缩性胃炎(CAG)是胃黏膜固有腺体减少,伴或不伴肠上皮化生和(或)假幽门腺化生的一种慢性疾病[1],临床表现无特异性,内镜下主要表现为黏膜发白、变薄、粗糙不平,黏膜下血管网透见等特点[2],是胃的癌前病变,具有较高的癌变风险。随着我国人口老龄化,CAG患病率呈逐年上升趋势,50%~70%的老年人存在CAG[3]。幽门螺杆菌(HP)感染是CAG最重要的病因,与胃癌有密切相关,1994年被世界卫生组织列为胃癌的Ⅰ类致癌原[4]。目前,国内外研究已明确阿司匹林及其他非甾体类抗炎药(NSAIDs)致消化道损伤机制,基础研究发现阿司匹林及其他NSAIDs与胃癌、结直肠癌等多种肿瘤的发生呈负相关,具有一定抗肿瘤作用[5-7]。但需要注意的是,阿司匹林作为抗血小板药物,也是一柄“双刃剑”,使用时需权衡长期抗血小板治疗的获益和风险。本研究以胃的癌前病变患者为研究对象,观察阿司匹林对CAG患者胃黏膜分泌功能血清学检测及出血的影响。
1 资料与方法
1.1一般资料 将2019年8月至2020年2月在本院行胃镜检查明确诊断为CAG的97例患者纳入研究。纳入标准:(1)符合2017版《慢性萎缩性胃炎中西医结合诊疗共识意见》中CAG的诊断标准;(2)根据心脑血管疾病危险分层,需长期服用阿司匹林的CAG患者;(3)未服用NSAIDs的CAG患者。排除严重肝肾、血液系统疾病患者,妊娠期或哺乳期妇女,精神意识障碍患者。纳入人群年龄 41~77 岁,平均 68.3岁。本研究已获医院伦理委员会审核批准,所有入选患者均签署相关知情同意书。将入选患者分为治疗组(48例)和对照组(49例)。
1.2方法
1.2.1仪器及设备 窄带成像放大内镜(NBI-ME)使用的Olympus公司CV- 260 SL主机及GIF-H 260 Z镜子。
1.2.2检查方法 入选患者均行血清HP抗体检测,滴度≥30 U/mL为HP阳性,按共识处理意见根除方案为:质子泵抑制剂(PPI)+铋剂+2种抗生素,疗程为10 d或14 d,停药4周后复查C14尿素呼气试验。治疗组予服用阿司匹林肠溶片,每天100 mg,服用1年;对照组为未服用NSAIDs,随访患者第3、9个月血清胃功能检测及消化道出血指标,包括血清胃蛋白酶原Ⅰ(PGⅠ)与血清胃蛋白酶原Ⅱ(PGⅡ)比值(PGR)、胃泌素-17(G-17)、血清HP抗体、血常规、粪便隐血等检测。按新的胃癌筛查评分系统,将胃癌高危人群进一步行放大染色胃镜精查+病检。对比分析2组患者血清胃肠功能检测及出血风险情况。
1.3诊断标准
1.3.1内镜诊断标准 依据我国中华医学会消化病学分会制定的《中国慢性胃炎共识意见(2017年,上海)》[8]、中华医学会老年医学分会制定的《老年人慢性胃炎中国专家共识》[3],临床一般基于悉尼系统和新悉尼系统进行慢性胃炎分类,其中胃黏膜萎缩可分成单纯性萎缩和化生性萎缩,胃黏膜腺体有肠化生者属于后者。CAG在内镜下可见黏膜红白相间,以白相为主,皱襞变平,甚至消失,部分黏膜血管显露;可伴有黏膜颗粒或结节状等表现[9]。具体分类采用木村-竹本分类法根据内镜下萎缩界限范围进行分类[10],萎缩界限从胃窦开始至小弯,未超过贲门者为闭合型(C型),超过者为开放型(O型)。每个型再各自分为3个亚型,即C-1:萎缩界限局限在胃窦部;C-2:萎缩界限超过胃角;C-3:萎缩界限超过胃角且接近贲门;O-1:萎缩界限刚过贲门;O-2:萎缩界限已经遍及整个胃底;O-3:萎缩界限延伸到胃体。亮蓝嵴(LBC)为肠上皮化生胃黏膜,NBI模式下观察区域呈亮蓝色,NBI-ME见位于上皮细胞表面脑回样结构或嵴部的纤细、蓝白色的线样结构[11-12]。我国推荐使用新型胃癌筛查评分系统[13],该系统包含5个变量,即年龄、性别、HP抗体、PGR、G-17被赋予不同的分值(权重),总分0~23分,根据分值可将胃癌筛查目标人群分为3个等级:胃癌高危人群(17~23分)、胃癌中危人群(12~<17分)、胃癌低危人群(0~<12分)。
1.3.2病理诊断标准 参照《胃炎的分类和分级:悉尼系统(修正版)》[14]、《胃癌大体类型与组织学分类》[15]、《中国慢性胃炎共识意见(2017年,上海)》[8]及《慢性胃炎及上皮性肿瘤胃黏膜活检病理诊断共识》[16]等指南共识意见。我国共识指出,慢性胃炎有5种组织学变化要分级,即HP、炎性反应、活动性、萎缩和肠化生,分为无、轻度、中度和重度4级(0、+、++、+++)。

2 结 果
2.1内镜检查结果 2组受试者入组时的基线数据包括平均年龄、性别构成、HP抗体阳性的比例及C型/O型萎缩性胃炎占比等比较,差异均无统计学意义(P>0.05),基线资料具有可比性。见表1。CAG患者内镜下按木村-竹本分类具体情况见表2。

表1 2组CAG患者基线数据比较

表2 CAG患者内镜下木村-竹本分类占比情况
2.2不同时段各监测指标统计 治疗组患者的血清PGⅠ、PGR水平均高于对照组,G-17水平低于对照组,差异均有统计学意义(P<0.05)。HP根治后,2组患者新型胃癌筛查分值均有下降,治疗组口服阿司匹林后第9个月较第3个月,胃癌筛查评分显示高、中危患者例数呈明显下降趋势,差异有统计学意义(P<0.05)。见表3。

表3 2组不同时段各监测指标比较
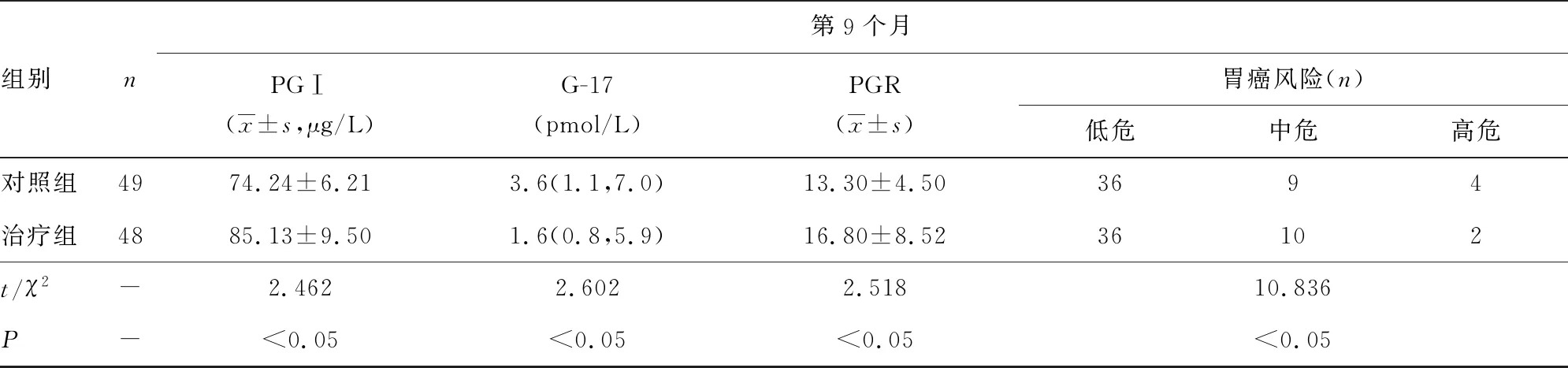
注:-表示无此项。
2.3HP根治后2组消化道出血发生率比较 2组HP感染均获根除,且均未发生消化道活动性大出血,血色素下降<10 g/L。对照组中3例患者发生出血,病因分别为糜烂性胃炎(2例)和十二指肠溃疡(1例),出血时的临床表现粪隐血试验阳性2例,黑便1例。治疗组中4例患者发生出血,病因为出血性胃炎(1例)和多发性胃溃疡(3例),临床表现为粪隐血试验阳性1例,黑便3例。在符合方案集分析中,对照组和治疗组的消化道出血发生率[分别为6.12%(3/49)和8.33%(4/48)]比较,差异无统计学意义(P>0.05)。
3 讨 论
CAG可由慢性浅表性胃炎发展而来,通常认为HP感染、饮食不当、遗传学特征、用药不合理等均可造成胃黏膜反复受损,从而导致胃固有腺体组织出现萎缩性病变,胃黏膜变薄、变色,血管出现显露、胃酸分泌量下降,胃肠蠕动功能失调,机体消化功能减退等,最终导致CAG发生,高承霞等[17]提出渐进式致癌模式,即慢性胃炎-萎缩-肠化-异型增生-胃癌。PG与萎缩性胃炎的发生密切相关,萎缩性胃炎可导致胃黏膜主细胞缺失,从而影响其分泌功能。其中,在胃体黏膜发生萎缩时,胃黏膜主细胞和腺细胞数量随之减少,从而导致血清PGⅠ水平下降,因PGⅡ尚可由胃窦和十二指肠腺细胞分泌,故PGⅡ水平尚可处于相对稳定的状态。因此,PGR降低,如胃黏膜萎缩程度继续进展,范围扩大累及全胃时,则PGⅠ和PGⅡ含量均降低,由于PGⅠ下降程度较PGⅡ更加明显,故PGR亦随之下降。泌酸腺减少,胃内呈现低胃酸状态,导致血清G-17水平升高。口服阿司匹林后发现患者的血清PGⅠ、PGR水平均高于对照组(P<0.05),说明阿司匹林增强胃黏膜的分泌功能,胃内低酸状态改善,G-17水平较基线水平降低。
阿司匹林选择性地抑制环氧化酶2(COX-2),导致PG合成受阻,进一步抑制胃癌等肿瘤细胞的增殖、肿瘤血管的生成、侵袭或转移,那其又是怎样影响胃的癌前病变的呢?体外研究显示,阿司匹林对HP的生长有抑制作用,还可明显降低HP的黏附性[18]。当HP和NSAIDs共同作用于胃上皮细胞时,NSAIDs可拮抗HP的促增殖作用[19]。而HP是导致萎缩、肠化发生的始动因子,故阿司匹林从源头上降低了CAG的发生风险,检测治疗组血清PGⅠ、PGⅡ水平升高,改善胃黏膜的分泌功能,随访内镜可见部分胃黏膜萎缩逆转。高宇飞等[20]研究团队指出,服用阿司匹林可改善萎缩性胃炎、肠上皮化生患者的胃黏膜分泌功能,且在HP阳性患者中效果更显著,服用阿司匹林1~5年是胃癌前变化患者血清PGR、G-17变化的保护因素。另外,方小鹤等[21]报道则显示,CAG患者血清G-17水平与萎缩病变部位及病变程度存在明显关联性,G-17可通过下调SHH基因,调节细胞增殖和凋亡,与胃黏膜萎缩及肠化有关,故根除HP和(或)口服阿司匹林可减轻萎缩程度及范围。伴HP感染的阿司匹林服用者发生消化性溃疡的风险高于单纯HP感染和单纯服用NSAIDs者[22]。对需要长期服用阿司匹林维持治疗的消化性溃疡患者,根除HP后溃疡复发率和并发症发生率均显著降低。本研究显示,HP根治后对照组和治疗组的消化道出血发生率比较差异无统计学意义(P>0.05),说明阿司匹林的临床应用安全性好。
综上所述,治疗组服用阿司匹林消化道出血发生率无明显增加,血清PGⅠ、PGR降低,胃黏膜功能状态有所改善,HP根治后新的胃癌筛查评分系统将显示总的分值呈下降趋势,治疗组下降更为明显,差异有统计学意义(P<0.05)。提示阿司匹林可降低消化道癌的发生风险。

