直接多肽结合试验的实验室验证
黎砚书 熊友文 徐丽瑛 肖小华

摘要:目的:本文旨在实验室转化和建立直接多肽结合试验(DPRA)方法, 并在实验室内进行验证,实现对化学物可能引起皮肤致敏性的预测。方法:选择五种已知皮肤致敏性化合物分别与半胱氨酸多肽和赖氨酸多肽在25℃暗处条件下共孵育24h,使用HPLC测定两种特征多肽消耗百分率并依据DPRA预测模型判定受试物致敏性程度,再进一步比较试验数据与OECD TG 442C指南参考结果。结果:DPRA准确的划分了五种受试物的致敏性。2,4-硝基氯苯和甲醛判定为极强致敏物,肉桂醛判定为中致敏物,正丁醇和6-甲基香豆素为非致敏物。结论:本实验室建立的DPRA 可准确预测单一化合物的皮肤致敏性及其程度,完成本实验室直接多肽结合试验的验证。
关键词:直接多肽结合试验;皮肤致敏;替代方法
【中图分类号】R-1 【文献标识码】A 【文章编号】1673-9026(2022)01--01
近年来,随着致敏免疫分子研究体系的逐渐清晰和动物福利原则的推行,建立体外评价化学物致敏性的方法就显得尤为重要。基于有害结局通路(AOP)概念的提出,多种体外替代方法被尝试并通过验证[1~2]。如DPRA[3]、人细胞系活化试验[4] 、角质细胞ARE-Nrf2荧光素酶检测方法[5]等。在皮肤致敏的发生过程中,化学物质与皮肤蛋白质的结合是一个关键步骤。大多数化学致敏原都具有亲电性,能与氨基酸(半胱氨酸和赖氨酸)的亲核中心共价结合[6]。DPRA就是基于该原理开发的一种体外化学分析方法。
1试验材料
1.1主要仪器
高相液相色谱仪(美国waters仪器公司);色谱柱、保护柱(含柱芯)(安捷伦科技有限公司);超微量电子分析天平(赛多利斯科学仪器有限公司);电热恒温培养箱(天津市泰斯特仪器有限公司)。
1.2主要试剂
半胱氨酸多肽(Ac-RFAACAA-COOH,分子量751.9)、赖氨酸多肽(Ac-RFAAKAA-COOH,分子量776.2),购于南京莱昂生物科技有限公司;肉桂醛(上海麦克林生化科技有限公司);2,4-二硝基氯苯(成都艾科达化学试剂有限公司);甲醛(西陇化工股份有限公司);正丁醇(西陇化工股份有限公司);6-甲基香豆素(上海源叶生物科技有限公司)。
HPLC流动相A:往500mL水中加入500uL三氟乙酸。HPLC流动相B:往1L乙腈中加入850uL三氟乙酸。
2试验方法
2.1 样品处理
分别将肉桂醛,2,4-二硝基氯苯,甲醛,正丁醇,6-甲基香豆素用乙腈配制成3mL 100mM的溶液作为储备液。
2.2标准曲线制作
将半胱氨酸多肽和赖氨酸多肽分别配制标准品1(0.667mmol/L)、标准品2(0.267 mM)、标准品3(0.1335 mM)、标准品4(0.0667 mM)、标准品5(0.0334 mM)、标准品6(0.0167 mM),依次进行高效液相色谱进样分析,用浓度与峰面积绘制标准曲线,此次试验我们半胱氨酸多肽和赖氨酸多肽的R 2均大于0.990。
2.3共孵育及HPLC进样
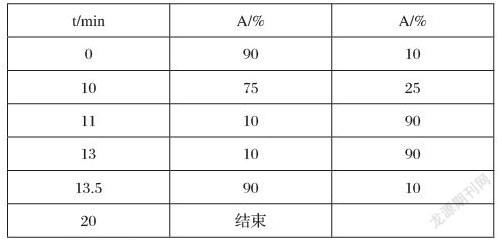
按下列表格(见表1)配制样品,加样于2mL进样瓶中,待充分混匀后再置于电热恒温培养箱中,25℃暗处条件下孵育24h。每个样品组和对照组均配制三个平行样。24h后将样品组和对照组置于HPLC中进行检测分析。
2.4 HPLC条件
用50%流动相A+50 %流动相B在柱温为30℃下平衡色谱柱2h,流量0.35mL/min。进样量为7uL,樣品温度为25摄氏度。洗脱条件如下。
2.5数据处理
计算样品和对照品的峰面积,根据峰面积计算多肽消耗率。
多肽消耗率=[1-(平行样多肽峰面积均值/空白对照C多肽峰面积均值) ] ×100%
2.6预测模型
根据DPRA预测模型对受试物进行判定[5]。当受试物均不与两种多肽共洗脱时,则计算两种多肽消除率的均值,均值≤6.38%,反应程度为无或较弱,为非致敏物;6.38%<均值≤22.62%,22.62%<均值≤42.47%,均值>42.47%,此3种情况均为致敏物,反应程度分别为低、中、高。当受试物与赖氨酸多肽发生共洗脱时,仅用半胱氨酸多肽消除率进行判断,非致敏物为消除率≤13.89%;13.89%<消除率≤23.09%,23.09%<消除率≤98.24%,消除率>98.24%,致敏物反应程度分别为低、中、高。当受试物与两种多肽均发生共洗脱时,则无法判断。
5、试验结果
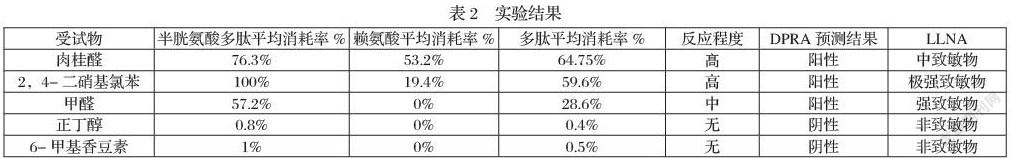
根据实验数据显示(见表2),此5种物质均不与两种多肽发生共洗脱。肉桂醛、2,4-二硝基氯苯、甲醛的多肽消耗率均值分别为64.75%、59.6%、33.6%,根据DPRA预测模型均为致敏物,反应程度分别为高、高、中。正丁醇、6-甲基香豆素多肽消耗率均值分别为0.4%、0.5%,根据DPRA预测模型均为非致敏物。五种受试物测试结果均与OECD TG 442C指南参考结果趋于一致。与体内致敏潜能(LLNA数据)相比程度判定有2个不一样,但判定致敏物和非致敏物分类一致。
6讨论
传统的化学物致敏性评价主要以动物实验为主,而近年来出于对动物保护的需求,使得建立可靠有效的皮肤致敏体外评价体系成当下研究的热点。皮肤致敏的有害结局通路是从分子起始事件、关键事件到产生系统效应的连续发生过程[7]。其分子起始事件是致敏原与皮肤蛋白发生结合反应形成半抗原化合物。DPRA使用化学方法模拟致敏原与人工合成多肽(半胱氨酸肽和赖氨酸肽)结合,采用HPLC分析反应液中多肽的损耗,以评估受试物的肽反应性,从而评估化学物质是否可能为皮肤致敏原。
本实验完成了在实验室内建立和验证DPRA方法,其验证结果与LLNA结果趋于一致。但在实验过程中仍出现过许多问题,如HPLC体系的干扰,样品配制误差,多肽降解,加样量过少等。本实验由于实验室条件限制只验证了五种受试物的致敏性,在产品检测应用中还需要积累大量实验数据和优化实验条件。
參考文献:
[1]瞿小婷,程树军,秦瑶,等.有害结局通路指南及毒性测试应用分析[J].日用化学品工业,2016,46(8):473-478.
[2]陈彧,喻欢,程树军,等.基于有害结局通路原理的皮肤致敏测试替代方法进展[J].日用化学品科学,2016,39(4):4-9.
[3]OECD.Test No.442C:In Chemico Skin Sensitisation:Direct Peptide Reactivity Assay (DPRA) [S].Organization for Economic cooperation and Development,Paris,2015.
[4]OECD.Test No.442D:In Vitro Skin Sensitisation:ARE-Nrf2 Luciferase Test Method[S].Organization for Economic cooperation and Development,Paris,2015.
[5]OECD.Test No.442E:In Vitro Skin Sensitisation:ARE-Nrf2 Luciferase Test Method[S].Organization for Economic cooperation and Development,Paris,2015.
[6]Gerberick G,Vassallo J,Foertsch L,et al.Quantification of chemical peptide reactivity for screening contact allergens:a classification tree model approach[J].Toxicology.2007,97(2):417-427.
[7]OECD.The adverse outcome pathway for skin sensitisation initiated by covalent binding to proteins.part 2:use of the AOP to develop chemical categories and integrated assessment and testing approach.Series on Testing and Assessment No.168[R].Paris, 2012.

