基于生物信息学分析HLA-DMA 基因在LGG 中的表达和功能
李泽艳,王晓旋,来明名,马雪艳
(大理大学基础医学院,云南 大理 671000)
低级别脑胶质瘤(low-grade glioma)是一组原发性脑肿瘤,起源于支持性胶质细胞。根据世界卫生组织(WHO)的标准,脑胶质瘤分为Ⅰ、Ⅱ、Ⅲ和Ⅳ级,并将Ⅱ和Ⅲ级统称为低级别脑胶质瘤(LGG)[1,2]。早期研究表明[3],LGG 在病理学、分子特征和预后等方面具有高度个体特异性。低级别脑胶质瘤最常见于35~44 岁的年轻人,生长较为缓慢。然而,大多数低级别脑胶质瘤最终转化为高级别胶质瘤,导致预后较差[4]。因此,筛选敏感、可靠的生物标志物对LGG 的早期诊断和预后评估至关重要。人类白细胞抗原Ⅱ类(human leukocyte antigen class Ⅱ,HLA-Ⅱ)分子主要与免疫系统疾病相关,除了参与经典的抗原抗体反应外,还广泛参与调节各种细胞过程,包括增殖、成熟、凋亡、以及细胞因子、巨噬细胞、B 细胞和树突状细胞等生成过程[5,6]。此外据报道[7-9],HLA-Ⅱ类分子常高表达于肿瘤中,主要与肿瘤细胞逃避免疫监视形成肿瘤转移浸润相关。主要组织相容性抗原复合体ⅡDMα(majorhistocompatibility complex class II-DM alpha,HLA-DMA)属于人类白细胞抗原(HLA)非经典Ⅱ类区,主要在抗原呈递细胞(APC:B 淋巴细胞、树突细胞、巨噬细胞)中表达,和其他HLA-Ⅱ类分子共同参与抗原的加工、提呈及其他免疫调节过程。因此猜测,HLA-DMA 可能和其他HLA-Ⅱ类分子一样,高表达于肿瘤细胞中并和其他HLA -Ⅱ分子共同参与肿瘤细胞逃避免疫监视,形成肿瘤转移浸润。早期有研究表明HLADMA 多态性与脑胶质瘤遗传易感性有关[10]。但目前关于HLA-DMA 在LGG 中的表达及功能尚未见相关报道。为此,本研究将通过生物信息学方法分析HLA-DMA 在LGG 中的表达,探讨HLA-DMA 在LGG 中的预后价值,以及HLA-DMA 与共表达基因在LGG 中的生物学作用。进一步研究HLA-DMA 调控LGG 的可能机制,为LGG 的诊断、治疗和预后提供新的思路。
1 资料与方法
1.1 数据来源 数据来源于基因表达谱数据动态分析(gene expression profiling interactive analysis,GEPIA)数据库(http://gepia.cancer-pku.cn),癌基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/),基因共表达网络(GeneCo -expreesionNetwork,Coexpedia)数 据 库(http://www.coexpedia.org/)和FunRich 3.1.3 软件。
1.2 GEPIA 数据库 GEPIA 数据库是由北京大学张泽民教授团队开发的一种交互式网络服务器,收录TCGA 和GTEx 项目的9736 例肿瘤和8587 例正常样本的RNA 测序表达数据。可在线分析基因在不同肿瘤类型中的表达情况以及正常组织与肿瘤组织mRNA 的表达情况。本次通过基因表达谱动态分析(GEPIA)对HLA-DMA 在各种类型肿瘤中的表达情况进行可视化并对HLA-DMA 在正常组织与LGG组织mRNA 的表达情况进行在线分析。
1.3 TCGA 数据库 TCGA 数据库设定数据过滤条件如下:“brain”“TCGA-LGG”“transcriptome profiling”“Gene Expression Quantification”及“HTSeq-FPKM”,下载LGG RNA-seq 数据及LGG 患者临床资料数据和预后数据。应用perl 将下载文件中探针名字转换为基因名字,使用R 软件读取转换后文件,通过“limma”包提取“HLA-DMA”表达数据。去除数据集中临床病理参数不完整及缺乏预后随访资料的样本,仅保留同时包含临床参数和生存数据的样本,共纳入510 例患者进行分析。
1.3.1 HLA-DMA 表达与临床病理特征的关系 应用R(v3.5.3)软件读取TCGA-LGG 基因表达数据及临床资料数据,进行Wilcoxon 秩和检验,分析HLADMA 表达与肿瘤分级和年龄之间的关系。
1.3.2 HLA-DMA 与LGG 患者生存预后的相关性采用R(v3.5.3)软件读取TCGA-LGG 基因表达数据及临床资料数据,利用“survival”包根据HLA-DMA在LGG 中表达的中位数将患者分为高表达组和低表达组,并分析两者的总体生存情况。同时运用“survminer”包绘制生存曲线,随后对患者年龄、WHO 分级及HLA-DMA 表达水平进行单因素和多因素Cox 回归分析,预测影响LGG 患者预后的独立危险因素。
1.4 Coexpedia 数据库 利用Coexpedia 数据库在线分析HLA-DMA 基因在LGG 中的分子调控网络,并获取共表达基因。按照Score>2 对共表达基因进行预处理,共筛选出20 个共表达基因。
1.5 FunRich 3.1.3.软件 利用FunRich 3.1.3.软件对HLA-DMA 与Coexpedia 数据库筛选出的20 个共表达基因的分子功能(molecular function,MF)、生物学过程(biological process,BP)、信号通路(biological pathway,BPA)进行分析,临界值设定P<0.05。
1.6 GSEA 软件 利用GSEA3.0 软件分析HLA-DMA表达水平对各种生物通路基因集的作用。以HLADMA 高、低表达分组作为表型文件,按照GSEA 软件默认参数,随机组合1000 次进行富集分析。按错误发现率(false discovery rates,FDR)进行序排序,并将FDR<0.25 的基因集作为显著富集基因集。
1.7 统计学方法 下载数据集后使用R(v3.5.3)软件进行整理分析。HLA-DMA 在正常组织和LGG 组织中的表达差异采用t检验;临床病理特征采用Wilcoxon 秩和检验进行分析;Log-rank 检验计算基因表达与LGG 患者生存的关系;单因素和多因素Cox 回归模型用于分析HLA-DMA 在LGG 患者中的预后意义。P<0.05 表示差异具有统计学意义。
2 结果
2.1 HLA-DMA 在不同肿瘤类型中的表达情况 通过GEPIA 数据库在线分析HLA-DMA 在不同肿瘤中的表达情况,并进行可视化分析。HLA-DMA 在弥漫性大B 细胞淋巴瘤(Lymphoid Neoplasm Diffuse Large B-cell Lymphoma,DLBC)、胆管癌(Cholangiocarcinoma,CHOL)、胰腺癌(Pancreatic adenocarcioma,PAAD)、多形性胶质瘤(Glioblastoma multiforme,GBM)、急性髓细胞样白血病(Acute Myeloid LeukemiaL,AML)、低级别脑胶质瘤(Low-Grade Glioma,LGG)、睾丸癌(Testicular Germ Cell Tumors,TGC)等多种肿瘤中高表达,见图1。
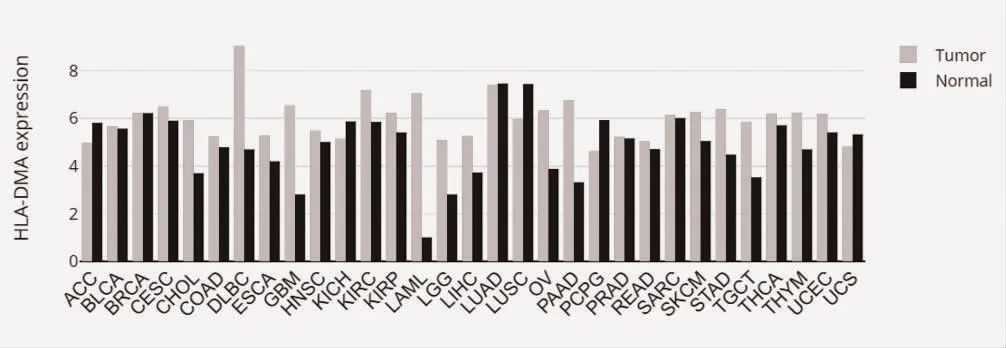
图1 HLA-DMA 在各种肿瘤组织和正常组织中的表达
2.2 HLA-DMA 在低级别脑胶质瘤和正常脑组织中mRNA 的表达情况 使用GEPIA 数据库对低级别脑胶质瘤组织(518 例)和正常组织(207 例)中HLADMA 的mRNA 表达水平进行分析,低级别脑胶质瘤组织中HLA-DMA 的表达高于正常组织,差异具有统计学意义(P<0.05),见图2。

图2 HLA-DMA 在低级别脑胶质瘤和正常脑组织中mRNA 的表达情况
2.3 HLA-DMA 表达与临床病理特征的关系 TCGA数据集中共纳入510 例临床病理参数完整的病例资料,通过统计分析病例资料发现,WHO Ⅲ级的LGG中HLA-DMAmRNA 表达高于WHOⅡ级的LGG,差异具有统计学意义(P<0.05),见图3A,HLA-DMA的表达与LGG 患者的肿瘤分级相关。另外,不同年龄患者的HLA-DMA 的表达比较,差异无统计学意义(P>0.05),见图3B。
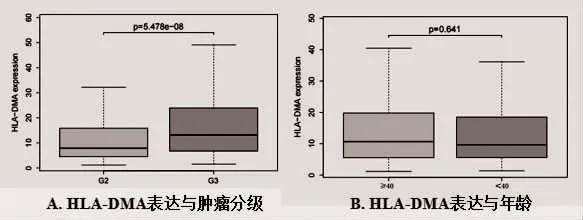
图3 HLA-DMA 表达与临床病理特征的关系
2.4 HLA-DMA 与LGG 患者生存预后的相关性 使用R 软件的“survival”软件包进行生存分析,采用“survminer”软件包绘制生存曲线。可知,HLA-DMA表达量与低级别脑胶质瘤患者的总体生存率相关(P<0.05),高表达HLA-DMA 患者的总体生存率低于低表达组,见图4。HLA-DMA 高表达组的低级别脑胶质瘤患者5 年生存率为57.7%,而低表达组为70.1%。进一步对影响LGG 患者预后的因素进行单因素和多因素Cox 分析,单因素Cox 分析结果显示,患者年龄、肿瘤分级、和HLA-DMA 表达水平均可能影响LGG 患者的预后。并将上述临床指标纳入多因素回归分析,结果显示,患者年龄、肿瘤分级、HLA-DMA 高表达是影响LGG 患者预后的独立危险因素(P<0.05),见表1。
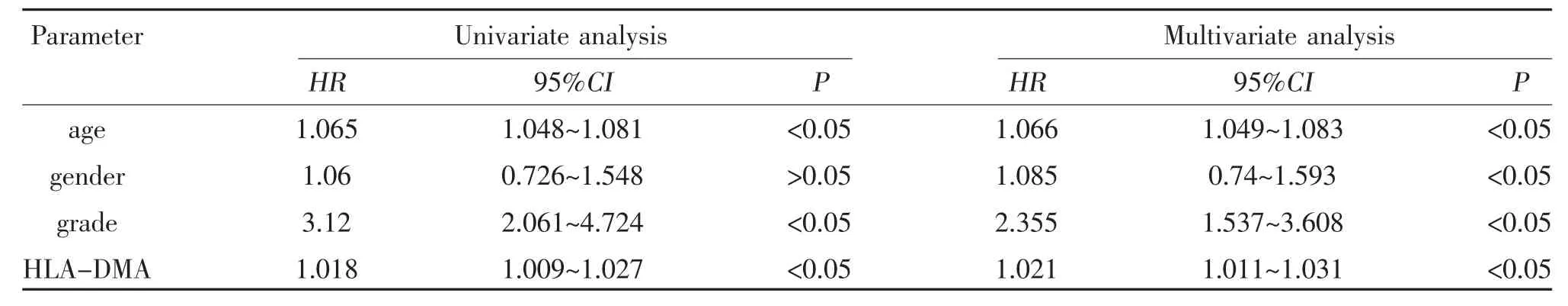
表1 LGG 预后影响因素的单因素、多因素Cox 回归分析

图4 HLA-DMA 与LGG 患者生存预后的相关性
2.5 HLA-DMA 与共表达基因在LGG 中的分子调控网络 利用Coexpedia 数据库绘制HLA-DMA 与共表达基因在LGG 中的分子调控网络图,得到HLA-DMA 的共表达基因数为58 个,见图5。其中score>2 的共表达基因有20 个:CD74、HLA-DPB1、HLA -DRA、TYROBP、ITGB2、HCLS1、HLA -DQB1、LAIR1、LAPTM5、C1QB、HLA -DMB、FCER1G、MYO1F、C1QA、HLA-DPA1、CD86、CD53、LY86、MS4A6A、RNASET2。

图5 HLA-DMA 在LGG 中共表达基因的分子网络
2.6 HLA-DMA 及其共表达基因的注释与分析 为了解HLA-DMA 与共表达基因在LGG 中的生物学功能,采用Funrich 软件进行基因注释分析。结果显示,分子功能方面,在MHC Ⅰ类受体活性、MHC Ⅱ类受体活性、受体活性、补体活性、T 细胞受体活性中起着重要作用,见表2 。生物学过程方面,12 个基因在免疫反应过程中发挥重要作用,基因占比57.1%(P<0.05),见表3。信号通路方面,主要参与免疫系统、补体系统、STAT4 介导的IL12 信号转导、信号调节蛋白(SIRP)家族的相互作用、CXCR4 介导信号信号传递等多条信号通路,见表4。

表2 HLA-DMA 共表达基因的分子功能

表3 HLA-DMA 共表达基因的生物学过程
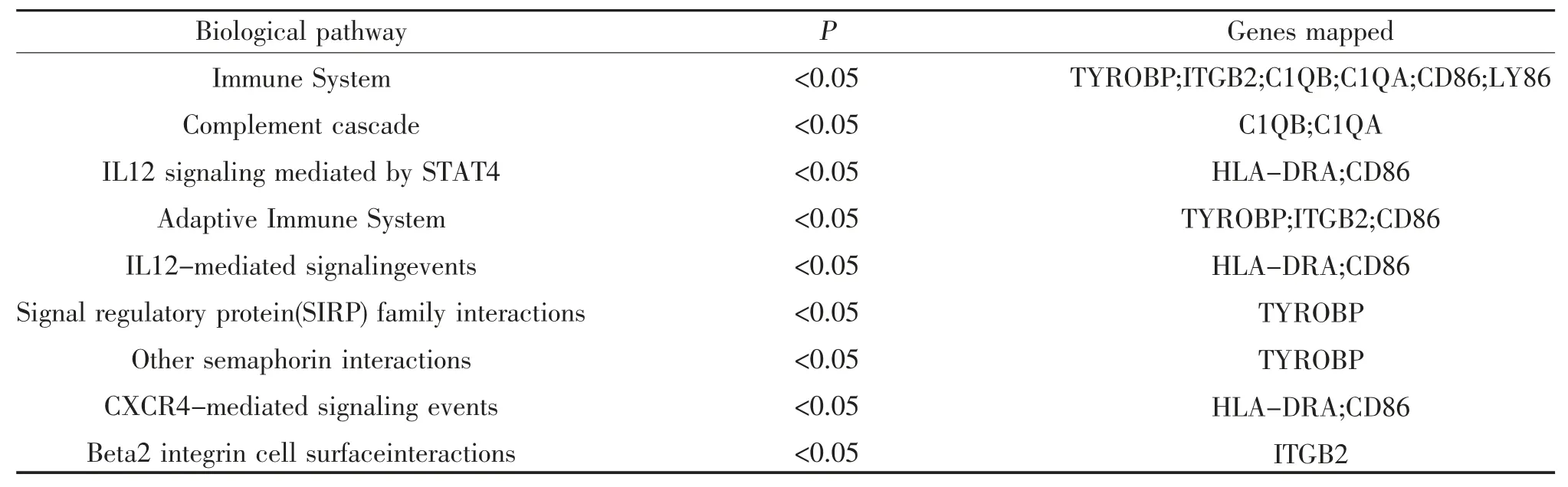
表4 HLA-DMA 共表达基因的信号通路
2.7 GSEA 分析HLA-DMA 相关富集基因集 为了进一步研究HLA-DMA 参与肿瘤调控的机制,利用TCGA 的GSEA 数据集分析HLA-DMA 高表达组所参与的信号通路。结果表明,LGG 中HLA-DMA 高表达组主要富集于JAK-STAT 信号通路、细胞外基(ECM)受体相互作用、NOD 样受体、自然杀伤细胞介导的细胞毒性作用、细胞凋亡、B 细胞受体信号通路、TOLL 样受体、蛋白酶体等信号通路,见图6。

图6 GSEA 分析HLA-DMA 相关富集基因集
3 讨论
低级别胶质瘤是由中枢神经系统(CNS)中的胶质细胞(星形胶质细胞和少突胶质细胞)产生的一组异质性肿瘤,患病人群一般为年轻人,但与胶质母细胞瘤患者相比,其病程更为缓慢,对患者的生活质量影响甚微,所以一般不会对其进行针对性的治疗[11-13]。近期有研究表明[14],LGG 是一种原发性脑肿瘤,由于其具有浸润性,不能通过切除、化疗、放疗等方法完全根除,经常演变为更高级别的恶性肿瘤。因此筛选敏感、可靠的生物标志物对LGG 的早期诊断和预后评估至关重要。
本研究基于生物信息学方法分析了HLA-DMA在LGG 中的表达及功能。首先,本研究通过GEPIA在线数据库分析HLA-DMA 在各种类型肿瘤组织中的表达差异,结果表明HLA-DMA 在弥漫性大B细胞淋巴瘤、胆管癌、胰腺癌、多形性胶质细胞瘤、急性髓细胞样白血病、低级别脑胶质瘤、睾丸癌等肿瘤组织中高表达。其次,本研究应用TCGA 数据库对HLA-DMA 的表达量与临床病理特征、生存预后相关性进行了探究,结果显示与Ⅱ级肿瘤相比,Ⅲ级肿瘤中HLA-DMA 表达上调。并且,高表达HLA-DMA的LGG 患者生存期低于低表达组。此外,单因素和多因素Cox 分析结果也表明HLA-DMA 的表达可作为LGG 患者预后的独立危险因素。以上结果提示HLA-DMA 可能在LGG 发病过程中作为肿瘤促进因子发挥作用,同时可以作为预后指标预测LGG 患者的生存。
HLA-DMA 位于人类白细胞抗原非经典Ⅱ类区,常与各类自身免疫性疾病相关。有大量文献表明HLA 类分子通过细胞免疫和体液免疫等免疫功能,清除肿瘤细胞[6]。本研究在GSEA 基因通路富集分析中发现除细胞凋亡信号通路外,B 细胞受体信号通路、NOD 样受体、自然杀伤细胞介导的细胞毒性作用、TOLL 样受体信号等与免疫调节相关的信号通路也富集于高表达HLA-DMA 表型中。此外,对HLA-DMA 基因及其共表达基因的生物学过程、分子功能和信号通路进行分析表明,HLA-DMA 与共表达基因主要参与免疫系统的调节等生物学过程。以上结果提示,调控肿瘤免疫反应相关信号通路可能是HLA-DMA 促进LGG 进展的重要机制之一。但HLA-DMA 在免疫调控中的具体作用,以及是否能够作为LGG 治疗靶点,有待进一步研究。
“凋亡”是指细胞程序性死亡[15,16]。当肿瘤发生时,凋亡通路通常会受到抑制,使肿瘤细胞的增殖和侵袭能力增强[17]。所以凋亡通路中的靶向蛋白通过上调促凋亡因子来调节肿瘤细胞的凋亡可能是治疗肿瘤的一个较为前景的方向[18]。早期研究报道,在脑胶质瘤中,细胞的抗凋亡能力增强,从而导致治疗效果不理想,因此凋亡抑制也是脑胶质瘤治疗不理想的原因之[19,20]。本研究通过GSEA 基因通路富集分析发现,细胞凋亡通路在高表达HLA-DMA 表型中显著富集,提示HLA-DMA 可能还通过调控细胞凋亡途径来调控LGG 的发生和发展。
综上所述,HLA-DMA 高表达与LGG 恶性进展密切相关,可能是一个可预测LGG 预后的独立风险因素。同时,HLA-DMA 可能通过调节免疫,并参与细胞凋亡相关通路影响LGG 的发生、发展。

