基于液质联用的植物化学形态学分析体系建设初探
——以甜叶菊叶为例
罗庆云,印敏
(1.南京农业大学园艺学院,南京 210095;2.江苏省中国科学院植物研究所(南京中山植物园)江苏省药用植物研究开发中心,南京 210014)
0 引言
植物化学分类学(Plant chemotaxonomy)是植物分类学与植物化学相互渗透、相互补充、互为借鉴而形成的一门交叉学科。它以植物化学成分为依据,以经典分类学为基础,对植物加以分类和记述,研究植物化学成分与植物类群间的关系,探讨植物界的演化规律[1]。植物化学分类学的主要研究任务是:(1)探索各级分类群所含化学成分及其合成途径;(2)探索各种化学成分在植物系统中的分布规律;(3)配合传统分类学及有关学科,从植物中化学成分的角度,共同探索植物系统发育[2]。植物化学形态学(Plant chemical morphology,PCM)研究是对植物资源目标器官所含化合物的全面解析,是以特定部位所含化合物为依据对资源加以描述和分类的一门形态学与化学相互渗透的学科。它揭示种内亚种、变种及变型分化的化学物质基础,为种内各化学变种、化学型及化学宗的确定提供分类依据,是植物化学分类学的有机组成部分。它基于植物化学成分间的有机联系,探讨化合物的形成、积累及转化机制,为以植物资源特定部位所含化合物为关注对象的遗传改良和栽培管理提供依据。植物化学形态学的主要研究任务包括:(1)建立全面表征植物特定部位所含化合物的方法;(2)探索植物特定部位所含化合物的形成、积累、转化机制;(3)分析种内各化学变种、化学型及化学宗间所含化学组分差异,探索种内分化的化学物质基础。
我国植物化学分类工作的特点之一就是与植物资源开发紧密结合[1],植物化学形态学的研究着眼于种内,在对种内各化学变种、化学型及化学宗所属各植株间特定部位所含化合物定性、定量差异分析基础上,阐明各化合物的形成、积累、转化机制,揭示种内亚种、变种及变型分化的化学物质基础,为以特定部位所含化合物为关注对象的遗传改良、栽培管理和开发应用提供依据。
甜叶菊(Stevia rebaudianaBertoni)为原产于南美洲阿曼山脉的菊科斯特维亚属宿根性多年生草本植物,因其叶内富含一类口味不同程度地接近蔗糖、甜度为蔗糖200~300倍、热量为蔗糖1/300的四环二萜类化合物——甜菊糖苷(Steviol glycosides)而被广为种植加工。自上世纪70年代引入以来,我国已发展为世界最主要的甜叶菊种植、加工基地。为探讨植物化学形态学分析体系建设所面临的挑战及对策,建立植物化学形态学数据分析体系,为植物化学形态学研究提供参考,本研究以对甜菊糖苷所在关键部位——甜叶菊叶所含化学组分的分析为例进行探讨。
1 材料与方法
1.1 实验材料
为建立植物化学形态学分析体系,本研究以甜叶菊为例,2018 年以本实验室于2016—2018 年选育的田间性状及叶片各甜菊糖苷组分差异大、按常规方法种植于江苏东台(E 120.8375、N 32.7794)的208份甜叶菊品系的现蕾期植株叶片为材料。为进一步考察不同采集时期、不同种植区域及仪器状态对甜叶菊叶内包括甜菊糖苷在内各化合物检出稳定性的影响,2019年以种植于江苏南京(E 118.8455、N 32.0409)、江苏东台(E 120.6163、N 32.8414)、山西运城(E 111.6323、N 35.5174)、新疆奎屯(E 84.9149、N 44.4169)等地的38 份甜叶菊品系叶片为材料。
1.2 材料的处理
所有叶片在日光下晒干后于80℃烘箱中烘干过夜,参照罗庆云[3]等方法准备样品,备用。
1.3 标准品
甜菊糖苷标准品瑞鲍迪苷D(Rebaudioside D,RD)、瑞鲍迪苷M(Rebaudioside M,RM)、瑞鲍迪苷A(Rebaudioside A,RA)、甜菊苷(Stevioside,STV)、瑞鲍迪苷F(Rebaudioside F,RF)、瑞鲍迪苷C(Rebaudioside C,RC)、杜克苷A(Dulcoside A,DA)、甜茶苷(Rubusoside,Rub)、瑞鲍迪苷B(Rebaudioside B,RB)和双糖苷(Steviolbioside,SB)等标准品购于ChromaDex,用含30%(v/v)乙腈的水溶液溶解。
1.4 甜菊糖苷的液质联用分析器材及方法
分析仪器:液质联用仪Agilent 1260 UPLC-DAD-6530 ESI-QTOF MS。
质谱条件为:离子源为电喷雾电离源,负离子扫描模式,雾化气为纯度99.9%氮气,碰撞气为纯度99.999%氮气,雾化气压力为50 psi,干燥气温度为350 ℃,干燥氮气流量为10.0 L/min,毛细管电压为3 500 V,Mass range 100~3 500 m/z,碰裂电压170 V,Mass Hunter B0.05.00工作站。
分析耗材:色谱柱ACE Ultracore 2.5 Super C18柱(150 mm×4.6 mm,2.5 μm)(广州菲罗门科学仪器有限公司);甲酸(美国如意,LCMS级),乙腈(Tedia company Inc,absolv),去离子纯化水。
1.5 液质联用分析数据的采集、匹配和整理用软件的编写
为便于相关人员的使用和升级,使用VB6.0语言,依照人为处理/判断模式拟人化地设计解决方案。
2 结果与分析
2.1 甜叶菊叶各组分分离体系的建立
对目标器官所含化合物的鉴别及含量测定是植物化学形态学分析体系确立的基础,包括本研究所涉对象甜叶菊叶在内的植物器官所含化学组分复杂(如,甜叶菊叶内已检出化合物达1 000 种以上),常采用的HPLC-UV 检测体系因其只能检测对紫外有吸收的化合物且仅以保留时间来定性各化合物,信息采集少、化合物鉴别效率低。为充分利用化合物相关信息、提高检出能力、实现对目标器官所含化合物的全面评估,化学形态学分析体系的建设宜采用定性范围广、相对定量准确的LC-MS技术。在LC-MS技术支持下,可通过碎片离子、分子离子、双分子离子、加和化合物离子等的m/z值信息相对全面地表征各化合物。LC-MS 技术对各化合物的定性鉴别以高效液相技术对各化合物的有效分离为支撑,为此我们首先对适宜于LC-MS技术的甜叶菊叶各组分UPLC分离体系进行了探讨。
由于磷酸盐缓冲体系不适用于质谱检测仪,本研究以甲酸为pH调节剂建立适宜于质谱仪的甜叶菊叶组分分析的UPLC分离体系。研究结果表明,在以ACE Ultracore 2.5 Super C18柱(150 mm×4.6 mm,2.5 μm)为固定相、含0.1%(v/v)甲酸(A)的纯净水和乙腈(B)为流动相条件下,实现甜叶菊叶各组分有效分离的洗脱梯度条件为:0 min 22.0%B;7.0 min 26.5%B;12.0 min 26.5%B;15.0 min 38.0%B;19.0 min 100%B;22.0 min 100%B;22.01 min 22.0%B。其他相关条件为:进样量5 μL、柱温50℃、流动相流速1.5 mL/min,并用分流器将进入检测系统的流速调整为0.5 mL/min、二极管阵列检测器(DAD)检测波长210 nm。
基于前述方法,初步建立了利用LC-MS 的甜叶菊叶所含化学组分的分离检测体系。图1 为基于前述检测体系的本室自育‘1351’甜叶菊品系叶内所含化合物的总离子流(TIC)图谱。其中保留时间(tR)=6.4 min左右处的最高峰所示化合物为当前所开发的口感最接近蔗糖的甜菊糖苷RM,tR=5.6 min 左右处的最高峰所示化合物为甜叶菊叶内另一口感相对较好的甜菊糖苷RD,tR=11.2 min左右处的最高峰所示化合物为甜叶菊体内含量高但口感一般的甜菊糖苷RA和STV。
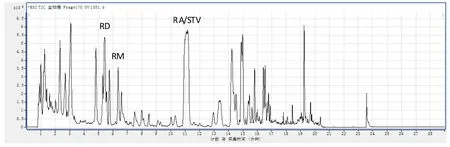
图1 甜叶菊叶LC-MS检出化合物总离子流(TIC)图示例Fig.1 Total ion current(TIC)of extracted chemical materials of stevia leaf
对2018 年检测的208 份材料及2019 年新增检测的38 份材料的联合分析表明,在上述分离条件下,在1.0~5.0 min、15~20 min、23.5~24.0 min 三个tR段内检出化合物种类较多,多达150~450种/min(见图2),出现信号拥挤,这为基于tR、碎片及分子离子峰m/z的化合物定性带来不便。后续分析结果表明,为实现对包括本研究所涉甜叶菊叶在内的植物器官所含化合物的有效定性定量,实现对其化学形态学性状的准确评估,目标器官所含化合物在各检测时间段内应分布均匀且每分钟检出化合物数应介于30~50种。
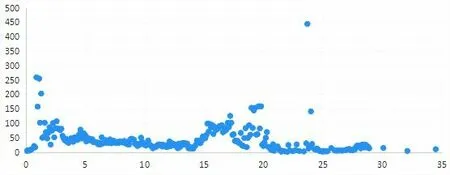
图2 各tR段内甜叶菊叶所含化合物检出数分布情况(种/min)Fig.2 Distribution of compounds in stevia leaves in different retention periods(kinds per minute)
2.2 植物化学形态学数据采集分析所面临的挑战
除严格自交、无性繁殖及人工杂交制种材料外,自然界分布的多为杂交的野生资源,单株间遗传变异大。植物种内各化学变种、化学型及化学宗等种下等级的分类研究,多涉及不同地区、不同居群和不同生育期样品的分析,因目标器官所含化合物的有无及含量高低受外界环境影响大,由目标器官所含化合物构成的化学形态学性状多表现为受微效多基因控制的低遗传力性状,要求单株取样、单株分析[1],为提高分析结果可靠性,还应在对各单株进行无性繁殖的基础上重复采样,需分析材料多,为便于植物化学形态学研究工作的有效开展,有必要建立一种可对大批量样品的化学形态学信息进行快速且准确的采集手段,这存在下述3方面挑战(下面以本文所涉材料甜叶菊叶为例进行阐述):
2.2.1 目标器官所含化合物种类繁多,各化合物间有效分离受限
图3 示为甜叶菊品系“1351”叶片样品检测时,tR介于13.0~17.2 min 间各化合物的分离情况。为进行有效积分,理论上应实现基线分离,从图3 可以看出,即便在化合物分布密度适中的13.0~15.0 min 间,化合物间也存在重叠,受化学形态学研究所需考察大批量样品及目标器官所含化合物种类繁多等特点影响,不可能将所有化合物一一分开,需建立一种允许化合物间存在一定重叠的化合物信息采集方法。

图3 甜叶菊品系‘1351’叶样品LC-MS检测时各化合物分离情况Fig.3 Separation of leaf compounds of stevia line of"1351"in detection of LC-MS
2.2.2 样品间各化合物保留时间的不规则漂移,各化合物相关信息提取受限
图4示2018年利用同一色谱柱、同批流动相、在同一LC-MS仪器上所检测的208个甜叶菊品系叶片所含化合物tR漂移情况。各样品检出图谱间存在不规则的tR漂移,与参照样品检出图谱相比,在同一个样品中,在一部分区段内tR提前而在另一区段内tR延后,这对基于几个参照化合物的tR来计算一个固定漂移时间从而对各材料检测数据标准化的分析策略形成了挑战。

图4 甜叶菊叶样品间各化合物tR漂移情况Fig.4 Drift of retention times of compounds from leaves samples of different stevia lines
2.2.3 材料间及样品内化合物含量波动幅度大,化合物定性信息丰度不一
由于不同地区、不同居群和不同生育期样品间化合物的含量差异大,同一化合物在不同材料间及同一样品内不同化合物间含量相差可达10~100倍以上,使LC-MS 检测中可用于化合物鉴定的碎片离子信息丰度不一,有的化合物碎片离子信息多(图5A 所示),有的化合物碎片离子信息少(图5B 所示),结合前述样品间各化合物tR的不规则漂移,这对基于tR和碎片离子m/z信息的各化合物定性鉴别构成了挑战。

图5 甜叶菊叶样品间及样品内各化合物定性用碎片离子信息量差异情况Fig.5 Differences of abundance of fragment ions used for qualitative analysis of compounds in leaves samples of the same and different sevia lines
2.3 植物化学形态学数据采集分析对策
开展植物化学形态学研究,种内各化学变种、化学型及化学宗所属材料目标器官所含化合物的准确定性及相对含量的有效确定是基础。包括甜叶菊叶在内各植物材料所含化合物LC-MS数据信息丰富,为化合物的定性和定量带来了便利,但也为这些信息的归类整理及分析带来不便,人为整理枯燥易错,若能利用计算机软件来辅助归类整理植物化学形态学研究所涉海量信息,为数据分析提供便利,必将促进植物化学形态学学科发展。为此,本研究以甜叶菊叶样品LC-MS数据的归类整理为例建立了植物化学形态学数据的采集整理软件。
2.3.1 植物化学形态学研究LC-MS数据的采集
由于样品所含化合物离子信息极为丰富,为实现对其快速准确提取,以VB 语言为工具,编写了LC-MS 数据信息提取系统《LC-MS 数据采集匹配输出助手》(见图6),该软件可帮助研究人员对各化合物离子信息进行采集并输出到Excel 表中,避免手工采集时因枯燥而导致的错漏,提高工作效率,确保数据采集准确。

图6 软件《LC-MS数据采集匹配输出助手》使用界面Fig.6 Interface of the software of LC-MS data collection,matching and output
2.3.2 植物化学形态学研究LC-MS数据的整理
进行植物化学形态学研究需面对大量的、化学组分各异的样品。为探讨目标器官内化合物的形成、积累及转化机制,揭示亚种、变种及变型间分化的化学物质基础,为种内各化学变种、化学型及化学宗的分类提供依据,材料间相关化合物的有无及含量高低等信息是植物化学形态学研究得以实施的基础。在前述各样品所含化合物离子信息采集基础上,实现对大批量样品所含化学组分的快速、准确定性是植物化学形态学研究面临的关键点。为实现该目标,以VB语言为工具,编写的基于LC-MS数据信息的化合物高通量定性分类整理软件系统——《LC-MS 检出数据归类整理及筛选系统》(见图7)可帮助研究人员依照tR和碎片离子信息实现对各样品所含化合物的碎片离子、衍生离子、分子离子、双分子离子等信息的整理,有助于实现各化合物的准确定性及后续定量。

图7 软件《LC-MS检出数据归类整理及筛选系统》使用界面Fig.7 Interface of the software of sorting and screening system of LC-MS detected data
分析结果表明,材料间化合物种类的差异是开展化学形态学研究必须面临的挑战之一。如,在编号‘1351’的甜叶菊品系叶片中共检出1 003 种化合物、而在编号‘1353’的甜叶菊品系叶片中仅检出466种化合物(见图8)。
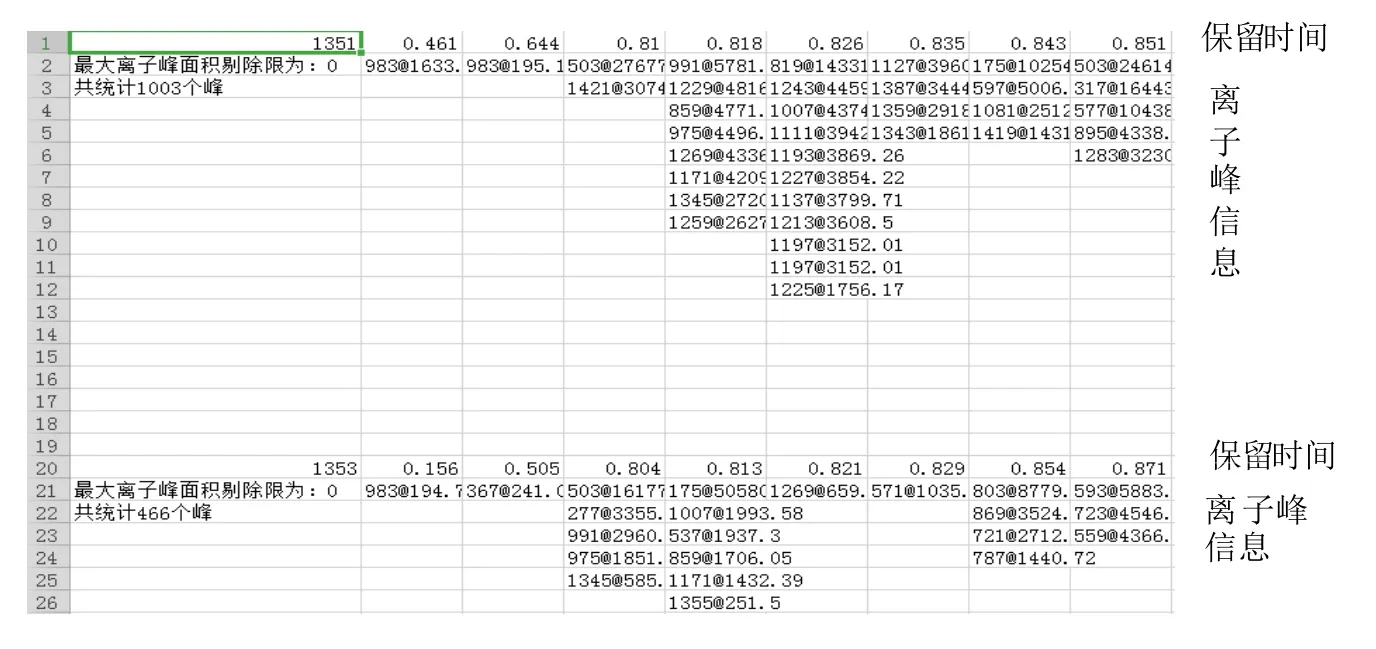
图8 甜叶菊品系‘1351’和‘1353’叶中检出化合物种类差异比较Fig.8 Difference of detected compounds in leaves of stevia lines of"1351"and"1353"
2.3.3 植物化学形态学研究LC-MS检出化合物的归类
对各化合物的定性/归类是植物化学形态学研究的基础。研究结果表明,在LC-MS条件下,无论其含量高低、各类化合物都有一个相对稳定的主峰(最大峰面积峰)和次峰(第二大峰面积峰),结合这两种特征峰及tR等信息可较好地实现对各化合物的定性/归类。对此,经过前述软件的归类整理,以当前LC-MS 方法检出化合物种类最丰富、编号‘1351’甜叶菊品系叶片所检出1 003种化合物的tR及相关化合物的离子信息为参照实现对编号‘1349’的甜叶菊品系叶片所检出954 种化合物中939 种化合物的匹配鉴定(见图9)。进一步分析表明,模糊匹配者多因化合物离子信息不充分所致,可通过调整化合物碎片信息采集量来增强化合物匹配度。

图9 利用《LC-MS检出数据归类整理及筛选系统》软件对‘1349’品系叶片检出化合物匹配结果示例图Fig.9 Example of matching and sorting output of detected compounds in leaves of line"1349"by software"Sorting and Screening System of LC-MS Detected Data"
2.3.4 植物化学形态学研究LC-MS检出化合物的定量
LC-MS 的质量分析器包括四极杆、离子阱、轨道阱、飞行时间和傅里叶变换等,因植物化学形态学研究要求对目标器官所含化合物全面表征,所面临化学组分复杂,相对其他质谱分析方法,Q-TOF的使用成本相对低、可检测质量范围宽、分子量测定精确度高,可为植物化学形态学研究所采用[4-5]。
在定量分析方法上,以多反应监测技术(Multiple Reaction Monitoring,MRM)代表的定量分析方法虽具灵敏度高、稳定性强等特点,但其不足之处在于:(1)只能检测已知m/z的化合物,无法满足植物化学形态学研究对目标器官所含未知化合物的表征[6-7];(2)在样品体系中,因各待检化合物易与提取溶剂或流动相各组分发生加成反应生成各种加和离子,浓度高者还会形成双分子离子,由于同一化合物在各样品间浓度差异大,导致各待检化合物存在形式中包括分子离子峰在内的各离子所占比例波动幅度大,如表1 所示,LC-Q-TOF检测体系中,各品系甜叶菊叶所含RA等4种代表性甜菊糖苷的分子离子峰检出峰面积占各化合物对应检出离子峰总面积的相对百分比波动明显,表明只利用包括分子离子峰在内的一种或几种离子来表征化合物含量的策略所得数据可靠性差。
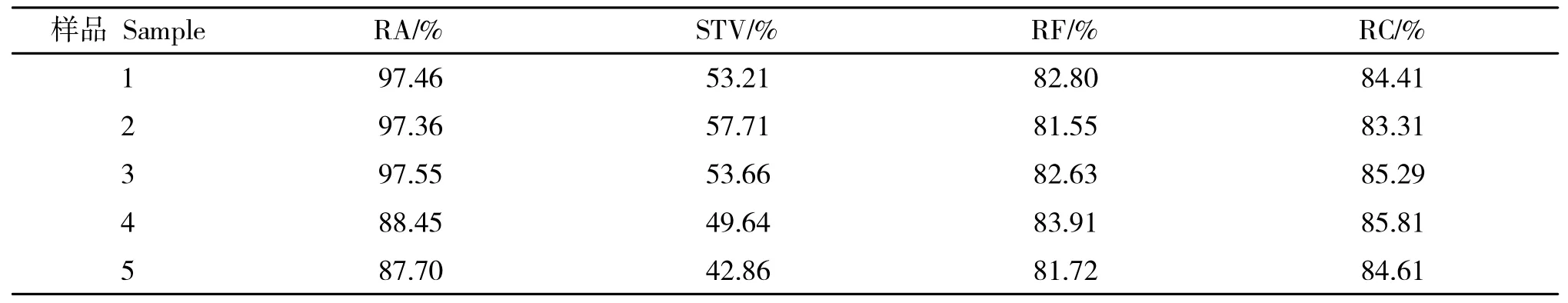
表1 LC-Q-TOF 检测各甜叶菊叶样品所含4 种代表性甜菊糖苷的分子离子峰检出面积占比波动情况Table 1 Fluctuation of area ratio of molecular ion peak of 4 representative steviol glycosides in stevia leaf detected by LC-Q-TOF
为此,在植物化学形态学研究中,为实现对LC-MS 各检出化合物的有效定量,应对其各加和离子、分子离子、双分子离子、质荷比大于等于M/2的碎片离子等进行联合计算,以实现对各化合物含量相对准确的定量。
3 讨论
3.1 植物化学形态学研究对植物化学分类学研究的推动作用
在对目标器官所含化合物全貌进行分析的基础上,通过对种内各化学变种、化学型及化学宗所属株系目标器官所含化合物的系统分析,解析各化合物间存在的有机联系,明确推动种内化学变种、化学型及化学宗分化的关键化合物,有助于推动种内化学变种、化学型及化学宗分化的分子基础研究,促进植物化学分类学与分子遗传学研究的结合。
3.2 植物化学形态学研究对于作物品质提升之必要性
植物化学形态学研究是对目标器官所含化合物的全面评价,有利于促进植物种质评价、目标化合物合成通路解析、收获器官品质育种和栽培措施确定,为植物收获器官所含化合物的分类、评价、改良和利用研究提供依据,对植物产品品质改良意义明显。
3.3 将本类研究定名为植物化学形态学研究的原因
在对植物特定器官所含化合物的分离鉴定中,其所含化合物因理化性质差异tR不同。在特定的固定相和流动相条件下,各化合物出现在不同tR节点上,最终不同tR段内各化合物的分离色谱呈现出以tR轴为树干的类似于根冠、枝条和树冠一样的图谱,将各tR段类比于由根到冠不同部位,各tR段内检出化合物的多少类比于根冠、枝条和树冠形态的复杂度,各tR段检出化合物间的相关性类比于树各部位性状间的关联性。这种将植物特定器官所含化合物在一定分离检测体系下所呈现出的类似于一棵树的由下向上形态上的类比有利于研究人员对种内各化学变种、化学型及化学宗间目标器官所含化合物在质和量上的差异形成一个直观印象,有利于化学分类及遗传改良工作的开展。为此,我们将这种植物特定器官所含化合物在一定分离体系下所呈现出的类似于一棵树的由下向上的“树形图”定名为植物化学形态(见图10),是对植物特定器官所含检出化合物的统称。

图10 同一LC-Q-TOF监测体系下3个代表性品系甜叶菊叶检出化合物总离子流(TIC)图多样性Fig.10 Diversity of total ion current(TIC)diagrams of detected compounds in leaves of 3 representative stevia lines under same LC-Q-TOF detection system
3.4 植物化学形态学研究与其他研究之间的区别和联系
植物化学形态学研究着眼于种内各化学变种、化学型及化学宗所属植株目标器官所含化合物信息的全面提取、分析和比较,这是与其他研究区别的本质之所在。
在概念上与植物化学形态学研究易混淆的是有研究者将基于组织化学(Histochemistry)定位的研究称为化学形态学研究(Chemomorphology)[8]。后者为在组织或细胞水平,对某种(类)物质在其内的存在性或移动性进行定性、定量分析,将该类研究定义为组织化学定位研究较为确切,其研究目标在于明确相应组织或细胞内目标化合物的存在性,其敏感性低、假阳性高,且其研究对象多为一种或少数几种化合物,无法从整体上揭示各化合物间的有机联系,与基于色谱分离技术的植物化学形态学研究间差异明显,现多应用于酶等有催化活性蛋白的存在性检测。
在研究方法上与植物化学形态学研究最接近的为植物代谢组学研究[9-12]。植物代谢组学是对植物的某一组织或细胞在特定生理条件下所含代谢产物进行定性和定量分析的一门学科,其多着眼于组织细胞等微观对象。由于化合物在细胞、组织及器官间存在转运,植物化学形态学分析着眼于器官等宏观对象,对以收获器官所含特定化合物为评价指标的作物品质育种及栽培管理更具指导意义。
在表现方式上与植物化学形态学研究最接近的为指纹图谱和特征图谱研究。指纹图谱和特征图谱研究为产品质量稳定性评估研究,指纹图谱强调对各批次产品间所含化合物的共同性和相似性进行表征,特征图谱强调对各批次产品间一种或几种化合物的一致性进行表征,两者都是对各产品所含化合物信息的部分提取,无全面表征要求[13-15]。而植物化学形态学研究是对目标器官所含化合物的全面表征,全面分析种内各化学变种、化学型及化学宗所属各单株目标器官所含化合物在质和量上的不同,即,植物化学形态学研究要求对各单株目标器官所含化合物进行全面表征,其对研究体系的稳定性和可靠性要求更高。
3.5 植物化学形态学研究对各化合物结构解析的要求分析
植物化学形态学研究对各化合物结构解析的要求具阶段性。在研究初期,植物化学形态学研究的主要任务为:(1)分析种下各化学变种、化学型及化学宗所属各单株系目标器官所含化合物在质和量上的差异,明确在各化学变种、化学型及化学宗分化过程中具有分类意义的一种或一组化合物;(2)分析各化合物间的转化关系,明确与目标化合物的形成、积累及转化密切相关的化合物。在此阶段,植物化学形态学研究对各化合物结构信息的需求度不高。在明晰前述两类关键化合物的基础上,随着植物化学形态学研究的深入,可将薄层色谱(TLC)、气相色谱(GC)、高效液相色谱(HPLC)等色谱法与红外光谱(IR)、紫外光谱(UV)、质谱(MS)、核磁共振(NMR)及X 衍射等光谱法结合,对该两类化合物进行追踪、分离、纯化、鉴定和结构解析,在此基础上分析各化合物间的转化机制。简言之,植物化学形态学研究初期的重点在于解析各化合物之间的关联性,不需要明确其结构信息,在此基础上,再对关键化合物的结构进行解析。
3.6 植物化学形态学研究对各化合物定量的要求分析
植物化学形态学研究对各化合物的定量要求也具阶段性。在研究初期,植物化学形态学研究的主要任务为:(1)明确材料间各化合物的有无及相对含量高低;(2)解析各化合物间的转化关系。在此阶段,对各化合物含量进行相对定量即可。当在种内分化上起关键作用或与目标化合物的形成和积累密切相关化合物确定后,随着植物化学形态学研究的深入,可分离制备该类关键化合物标准品,对其在关键材料内的绝对含量进行标定。
3.7 液质联用(LC-MS)技术在植物化学形态学研究中的优势分析
为实现对目标器官所含化合物的全面解析,色谱技术是必须依赖的技术,而质谱技术因可提供化合物分子量、化学基团等相关信息,也作为植物化学形态学研究的一个关键技术。气质联用(GC-MS)和液质联用(LC-MS)技术是目前发展较为成熟的色谱-质谱联用技术。GC-MS 是最早商品化的联用仪器,其优点在于有标准谱库可比对,方便解析化合物的种类,其不足之处在于只能分析热稳定高、能气化的挥发性小分子化合物。LC-MS应用面广,可检测非挥发性化合物、极性化合物、热不稳定化合物、大分子量化合物等,但是由于多没有商品化的谱库可查询,只能自己建库或自己解析谱图。在植物化学形态学研究的早期阶段,其重点在于解析化合物间的关联性,不需要明确其具体结构信息,可利用LC-MS可分析化合物种类多的特点,尽量全面地解析目标器官所含化合物[4],为此,在本研究案例中,我们以液质联用(LC-MS)技术作为植物化学形态学分析体系建设的基本技术,寄此建立植物化学形态学分析体系,为植物化学形态学研究提供支撑。
3.8 植物化学形态学研究的可能表现形式
植物化学形态学研究是对目标器官所含化合物的全面分析,该类研究的表现形式有:
(1)当所使用材料包括种内各化学变种、化学型及化学宗所属株系,丰富度及差异代表性足够时,有助于解明推动种内各化学变种、化学型及化学宗分化的关键化合物,为进一步开展推动种内化学变种、化学型及化学宗分化的分子基础研究,促进植物化学分类学研究与分子生物学及分子遗传学研究的结合提供依据。
(2)当所使用材料对种内各化学变种、化学型及化学宗代表性足够时,有助于解析各化合物间的关联性、相互转化关系、明确与目标化合物的形成、积累及转化相关的化合物,为结合各组学手段解析目标化合物形成、积累及转化的分子机制提供依据。
(3)同样地,当所使用材料对种内各化学变种、化学型及化学宗的代表性足够时,在明确化合物间关联性及相互转化关系基础上,可有效评价各材料用作提高有用化合物含量或降低有害化合物含量育种亲本的可行性,促进作物品质育种核心种质资源库建设,促进作物收获器官所含化合物改良。
(4)当所使用材料的区域代表性和田间栽培措施差异度足够大时,可进一步分析土壤及田间栽培措施对收获器官所含化合物品质性状的影响,为适宜产地及有效栽培措施的确定提供依据。
从上述分析可以看出,植物化学形态学研究对目标器官所含化合物的全面分析,有助于有效解析各化合物间相互转化关系,在促进植物化学分类学发展、目标化合物次生代谢途径解明、作物品质育种核心种质库建设、作物品质育种亲本评价和作物栽培措施评估等方面具有广泛应用场景。
4 结论
植物化学形态学研究是对目标器官所含化合物的全面解析,探讨化合物形成、积累、转化机制,揭示种内亚种、变种及变型分化物质基础,是以特定部位所含化合物为关注对象的作物品质改良和栽培管理的前提条件。但是,由于自然界分布的多为自交不亲和的杂交资源,单株间遗传变异大,且所含化合物的有无及含量高低受外界环境影响大,要求进行单株取样、单株分析,为便于植物化学形态学研究工作的有效开展,应建立一种可对大批量样品化学形态信息进行快速准确采集的手段。
相比HPLC-UV 等检测体系,LC-MS 具有定性范围广、相对定量准确等特点,可充分利用化合物相关信息提高检出能力,实现对植物器官所含化合物进行全面评估。但LC-MS 检出信息的有效利用存在3方面挑战:(1)目标器官所含化合物种类繁多,化合物间有效分离受限;(2)多样品间各化合物保留时间不规则漂移;(3)材料间及样品内各化合物含量波动幅度大,化合物定性信息丰度不一。
对此,本研究利用Visual Basic 编程语言,初步建成植物器官所含化合物LC-MS 分析数据的采集、整理、定性和定量分析系统,为以甜叶菊为代表的作物品质育种及作物收获器官化学形态学研究提供分析工具。该分析系统可实现对LC-MS 检出数据的全面提取,促进对目标器官所含化合物的全面分析,有利于高效解析各化合物间的相互转化关系,促进植物化学形态学研究在植物化学分类学发展、目标化合物次生代谢途径解明、作物品质育种核心种质库建设、作物品质育种亲本评价和作物栽培措施评估等方面的应用。

