腹盆腔孤立性纤维瘤的CT和MRI特征
赵才勇 刘陈汉 崔凤*
孤立性纤维瘤(solitary fibrous tumor,SFT)是一种起源于成纤维细胞或肌纤维母细胞的软组织肿瘤,生物学行为大多数为良性、交界性,少数为恶性[1]。该肿瘤可发生于全身各个部位,以胸部最为常见,位于腹盆腔者少见[2]。因其发生率低,临床表现缺乏特异性,影像学表现形式多样,术前误诊率较高。笔者通过回顾性分析经病理证实的8例腹盆腔SFT的临床、病理及影像资料,以期提高该病的术前诊断准确率。
1 资料与方法
1.1 临床资料 回顾性分析2013年1月至2019年12月杭州市中医院及浙江大学医学院附属邵逸夫医院收治的经病理证实的腹盆腔SFT 8例。其中,男4例,女4例;年龄31~74岁,平均54.4岁;病程1天~10余年;2例因下腹坠胀感、1例因腹部隐痛、其余5例在健康体检或因其他疾病检查时偶尔发现。
1.2 检查方法 2例行CT平扫、增强扫描,1例CT平扫、MRI平扫及增强扫描,5例同时接受CT、MRI平扫及增强扫描。(1)CT扫描:采用Siemens Definition AS 40 CT 扫描仪及Philips 256 CT扫描仪。扫描参数:管电压120 kV,管电流300~350 mA,矩阵512×512,层厚5 mm,层间距5 mm。对比剂使用碘海醇(300 mg I/mL),剂量1.5 mL/kg,注射流率2.5~3.0 mL/s,分别于注射后25~30 s、60~65 s行动脉期、静脉期扫描。(2)MRI扫描:采用GE Signa HDx 3.0T和Discovery MR750 3.0T磁共振扫描仪。常规横断位FSPGR T1WI、FSE T2WI、DWI(b值=1000 s/mm2)扫描,动态增强前后扫描采用三维LAVA扫描,对比剂使用钆喷酸葡甲胺(Gd-DTPA),剂量0.2 mmol/kg,注射流率2.5~3.0 mL/s,静脉推注,多期动态扫描。
1.3 影像资料分析 由2名影像诊断主治/主任医师共同分析检查获取的图像,主要观察肿块的部位、数目、大小、形态、边界、密度/信号(包括有无囊变坏死、钙化等)、动态增强特征及其与邻近结构的关系。结果不一致时,经协商后取得一致。
2 结果
2.1 病灶形态学表现 8例共有11个病灶。其中,单发病灶7例,良性4例、交界性3例;多发病灶1例,为恶性,由4个肿块粘连构成。肿瘤位于盆腔腹膜外间隙4例,脾脏前缘、肝门部、肾盂内各1例,1例多发病灶跨腹盆腔。肿瘤最大径为3.4~15.0 cm,平均最大径6.8 cm。8个病灶呈类圆形,3个病灶形态欠规则,边缘不同程度分叶状改变。病灶有包膜6个,无包膜5个。病灶边界清楚8个,周围结构受压或移位表现;边界不清3个,周围脂肪间隙模糊,为恶性SFT。所有患者均未见淋巴结肿大及远处转移征象。
2.2 CT表现 8例11个病灶均行CT平扫,6个病灶均匀等密度(与周围肌肉相比),CT值约32~40 HU;5个密度不均匀,病灶内可见不规则或类圆形低密度区,以1例恶性SFT其中2个较大病灶坏死囊变最为显著。1例恶性SFT其中2个病灶伴有斑点、斑片状钙化灶。7例单发病灶CT增强呈现不同程度强化,3例可见无强化的黏液囊变区,其中1例表现为囊样分房状结构(图1a)。动脉期5例病灶实质部分显著强化,CT值约112~182 HU;静脉期持续强化,CT值约130~205 HU(图1b、1c)。2例动脉期不均匀轻度强化,CT值约45~55 HU;静脉期渐进性均匀强化,CT值约65~95 HU。5例肿瘤周围可见迂曲蔓状强化供血动脉,其中4例病灶内仍可见迂曲强化血管影(图1b);1例瘤周可见粗大引流静脉回流至髂内静脉。
2.3 MRI表现 6例9个病灶行MRI检查,病灶实性部分T1WI为等或略低于肌肉信号; 7个病灶T2WI信号混杂,表现为高信号、稍高信号内夹杂条索状、斑片状低信号影(图2a、图3b),2个病灶为均匀稍高信号。3例单发、1例多发病灶瘤体内外T2WI可见迂曲蔓状、点状血管流空信号影。动态增强扫描5例单发病灶动脉期明显不均匀强化4例,轻度不均匀强化1例;静脉期、延迟期5例病灶持续强化或渐进性强化,逐步趋向均匀(图2b~2d)。1例多发SFT由2个较大的囊实性病灶和2个较小实性病灶组成,增强扫描较大病灶以边缘轻中度渐进性强化为主,中心囊变坏死明显,瘤体内外多发迂曲蔓状强化血管影;另2个较小实性病灶明显持续强化(图3c、3d)。

图3 患者,女,64岁,腹盆腔恶性SFT。a. CT平扫腹盆腔多发占位,局部粘连,边界欠清,可见钙化灶;b. T2WI示高信号、稍高信号内夹杂点状、片絮状低信号影;c. 动脉期肿瘤内外可见多发点状、条索状迂曲血管影(白色箭头);d. 冠状位静脉期大病灶以边缘强化为主,中心囊变坏死,小病灶显著均匀强化(白色箭头)
2.4 病理与手术结果 7例单发病灶均行手术完整切除,5例病灶表面多发迂曲血管,切面多呈灰白、灰红,质韧,部分可见黏液变、囊变坏死;1例多发病灶穿刺活检证实为恶性SFT,剖腹探查显示肿块与胰腺体尾部、脾脏粘连,血管丰富、触之易出血,无法安全切除。镜下观察:肿瘤细胞呈梭形,编制状、旋涡状排列,细胞疏密不均,间质富于胶原纤维、薄壁血管伴玻璃样变性(图1d),部分细胞可见核分裂像,轻中度异型性。免疫组化:CD34、Bcl-2检测8例均(+),CD99检测5例均(+),SMA、S-100检测8例均(-)。7例Ki-67阳性<5%,1例多发病灶Ki-67>5%。
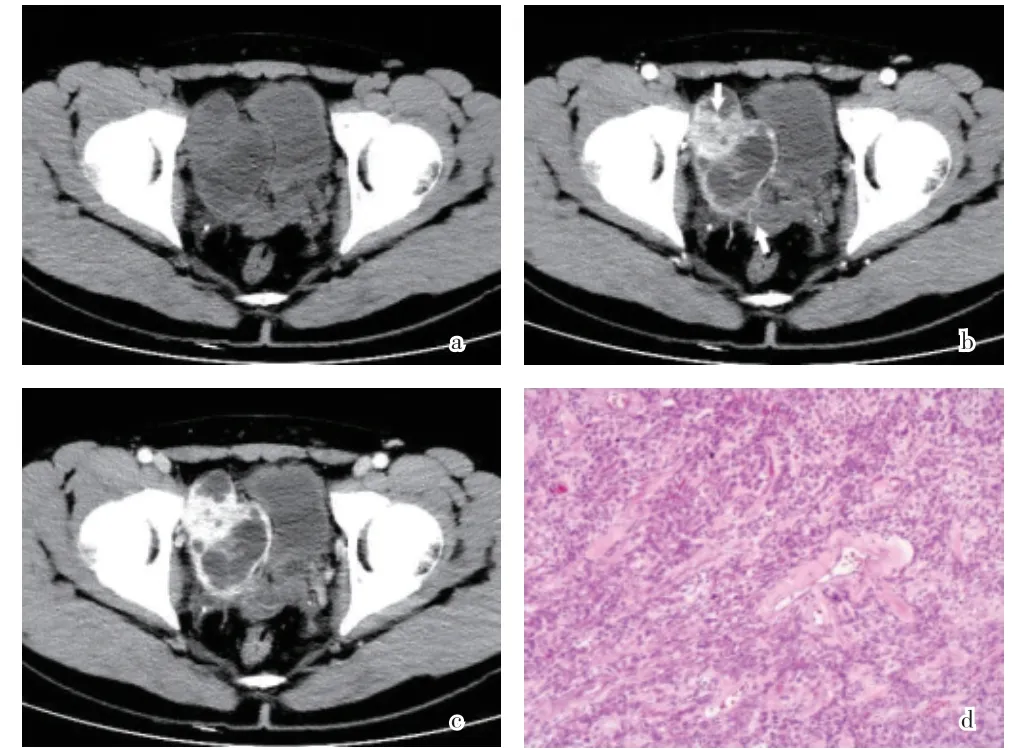
图1 患者,男,31岁,盆腔腹膜外间隙交界性SFT。a-c. CT平扫、动脉期、静脉期轴位像,盆腔囊实性分房状占位,边界清楚,分叶状,动脉期瘤体明显不均匀强化,瘤体内外可见点状、条索状强化血管影(白色箭头),静脉期持续强化,平扫、动脉期、静脉期肿瘤实质CT值分别为40 HU、120 HU、138 HU;d. 肿瘤细胞呈梭形,细胞密集伴核增大,血窦丰富(HE×20)
3 讨论
SFT是一种起源于表达CD34树突状细胞的少见梭形细胞肿瘤。WHO于2013年将SFT归类于纤维母细胞或肌纤维母细胞来源的软组织肿瘤,属于中间型(罕见转移)[3]。SFT分布较为广泛,以胸部最为常见,腹盆腔较为少见,约占所有SFT的20%[2]。该类肿瘤的发病年龄与病变部位无明显相关性,常见于50~60岁,男女比例无差异[2]。本组病例的发病年龄31~74岁,平均54.4岁,与文献报道类似。
3.1 腹盆腔SFT的临床与病理学特点 SFT生长缓慢,一般无临床症状,多为体检或偶尔发现,当瘤体较大挤压或累及邻近结构时,才会引起相应的压迫症状。约5%的患者由于肿瘤过度分泌胰岛素样生长因子II引起顽固性低血糖,称为Doege-Potter综合征,在恶性SFT中更为常见[4],偶有杵状指、肥大性骨关节病、关节痛等副肿瘤综合征[4],本组病例均无类似临床症状。手术切除是腹盆腔SFT的首选治疗方式,尤其是单发肿块。文献报道,约16%的SFT术后发生复发[5],因此术后需加强随访、以提高生存率。
SFT确诊主要依赖病理,由细胞丰富区(胶原较少)和细胞疏松区(胶原丰富)交替分布,肿瘤细胞呈梭形或短梭形,细胞间可见粗细不均的胶原纤维及丰富的薄壁血管,细胞异型性及核分裂像多不明显。当肿瘤细胞密集,核异型性较多,核分裂象>4/10高倍视野,肿瘤坏死和(或)浸润性边界,高度提示恶性[3]。免疫组化,测得CD34、 Bcl-2、CD99均呈阳性,SMA、S-100均呈阴性,其中CD34、Bcl-2常作为与其他软组织肿瘤区分的鉴别标志物,且与肿瘤细胞分化程度有关,良性肿瘤CD34阳性率较高,随着恶性程度增加,CD34阳性率下降[6]。Ki-67被认为是肿瘤增殖扩散标志,有助于预测肿瘤的恶性潜能,本组1例恶性SFT Ki-67>5%,其余7例Ki-67均小于5%。
3.2 腹盆腔SFT的影像学特点 (1)大小、形态、边缘:肿瘤大小差异较大,其直径由数厘米至数十厘米不等,位于盆腔者瘤体往往较大。本组病例肿瘤最大径为3.4~15 cm,较大者位于盆腔,与文献报道[7]基本相符。SFT多呈膨胀性生长,边界清楚,可见纤维包膜,部分恶性SFT局部边界不清,易粘连、侵犯周围组织[8],本组1例多发恶性SFT与胰腺体尾部、脾脏粘连。大多数肿瘤形态规则,呈类圆形或椭圆形,部分为不规则或分叶状,可能与肿瘤内部生长速度不一及对抗肿瘤生长的不同阻力有一定关系。(2)密度、信号:肿瘤密度、信号多样,与肿瘤大小、良恶性及组织成分相关。CT平扫多以等或略低密度为主,部分可见不同程度黏液变性或坏死囊变低密度区。本组病例较小肿瘤的CT密度尚均匀,较大病灶的密度欠均匀,以恶性SFT其中2个较大病灶坏死囊变最为显著,1例良性SFT呈多房囊样表现。钙化少见,偶尔出现在良性较大病灶或恶性病变中,可能与肿瘤坏死有关[9],本组仅1例恶性SFT显示斑点、斑片状钙化影。MRI平扫表现:T1WI多呈等或略低信号;T2WI多为混杂信号,细胞密集区常表现为略高信号影、致密胶原纤维常为低信号、黏液变性或坏死囊变区为高信号。有研究认为,T2WI表现为高、略高信号内夹杂条索状、斑片状低信号是腹部SFT典型MRI表现之一[1,10],提示病灶含有纤维成分,本组7个病灶符合此特点。(3)增强表现:SFT强化方式多样,主要与肿瘤血管、细胞密度及纤维基质的数量、分布密切相关[11]。本组5例单发SFT动脉期、静脉期强化明显,CT值均超过100 HU,病理证实肿瘤细胞密集、血管丰富,对SFT的诊断具有一定提示意义;2例不均匀轻中度强化,与肿瘤细胞稀疏、胶原纤维增生明显有关。本组病例MRI增强早期病灶强化幅度类似CT,延迟期病变渐进性或持续强化,由于SFT富含胶原基质及纤维基质,结构致密,对比剂流出缓慢所致,与文献报道基本一致[11]。良恶性SFT强化方式存在明显重叠,本组1例恶性SFT其中2个较大病灶以边缘轻中度渐进性强化为主;另2个较小实性病灶强化方式类似良性病变,表现为明显持续强化。肿瘤血供丰富,瘤周(6/8)及瘤内(5/8)可见迂曲肿瘤血管,恶性SFT肿瘤血管更为丰富,这些表现与病理上肿瘤周围、间质内存在大量血管相吻合。结合文献[12-13]及本组病例,笔者认为瘤体内外迂曲肿瘤血管是腹盆腔SFT的特征性影像学表现之一。
3.3 腹盆腔SFT的鉴别诊断 需与以下肿瘤鉴别:(1)副神经节瘤:好发于腹主动脉旁,囊变坏死、出血多见并可见液平面,增强扫描多呈动脉期明显强化,静脉期强化稍减弱。(2)Castleman病:好发于中青年,90%为透明血管型,沿中轴淋巴链分布富血供肿块,早期明显均匀强化,囊变坏死少见,灶内分枝状钙化较有特征性,灶周可有渗出。(3)腹内型韧带样纤维瘤病:与创伤、手术、遗传等相关,以浸润性生长多见,多无包膜,大部分边界不清,坏死少见,强化方式可类似SFT渐进性或持续强化,但瘤内肿瘤血管不明显。(4)其他肉瘤:与平滑肌肉瘤、血管肉瘤、未分化多形性肉瘤等鉴别困难,最终确诊仍须依赖病理学检查。
综上所述,腹盆腔SFT临床少见,术前误诊率高,影像学通常表现为边界清楚、孤立性富血供肿块,T2WI出现条索状、斑片状低信号区,瘤体内外可见多发迂曲肿瘤血管,增强扫描渐进性或持续性强化时,应考虑到该肿瘤的可能。当肿瘤较大,囊变坏死明显,边界不清,粘连、侵犯周围组织,提示恶性SFT可能,最终确诊仍需结合病理及免疫组化检查。

