小球藻—芽孢杆菌共生体系处理污水的研究
王华光,赵 玥,谭 炯,王文静,景连东
(1.山东德利环保工程有限公司,山东 烟台 264000;2.西南民族大学化学与环境学院,四川 成都 610041;3.西南民族大学化学基础民委重点实验室,四川 成都 610041;4.中国科学院烟台海岸带研究所,山东 烟台 264003)
微藻可以吸收污水中的营养物质,促进氮磷等元素循环,提高水体的pH和溶解氧[1-2].降低营养盐的同时,微藻还可产出有价值的生物燃料的原料.因此有许多研究关注微藻在生活污水处理中的应用,其中小球藻是微藻的重要代表.微藻处理生活污水具有环境友好、成本低廉等优势,但是该技术面临处理效率低的问题[3].
微藻细胞之间的微环境中常存在不易彻底分离或不易去除的细菌,它们与微藻之间存在着密切的物质和能量传递[4].这些与藻类共生的细菌为微藻的生长提供了CO2和无机盐及其他微量元素;微藻则提供了有机营养物质促进菌的生长[5-6].部分研究表明,藻-菌共生体系的构建可进一步实现污水营养物质的去除,微藻生物量的积累,废水净化及资源化利用效果明显[7-8].
垃圾渗滤液具有水质复杂危害性大,氮(尤其是氨氮)、磷营养盐、有机物含量浓度超高等特点,是污水处理行业中的一个难点.为提高该类污水的处理效率,本研究构建了两组小球藻-芽孢杆菌共生体系,分析其在光培养反应器中生长情况及对污水内氮磷去除的影响.研究结果将为藻菌共生系统应用到规模化处理污水耦合小球藻生产提供理数据和技术支撑.
1 材料和方法
1.1 细菌的分离鉴定
取某垃圾填埋场垃圾渗滤液,将渗滤液稀释后,在lysogeny broth平板培养基涂平板,16 h后分离菌株SL1和菌株SL2.对菌株SL1和SL2纯化培养后利用细菌DNA提取试剂盒(型号:DP302,品牌TIANGEN,China)提取菌株SL1和SL2的总基因组.琼脂糖凝胶电泳对DNA进行检测后,切胶利用琼脂糖凝胶DNA回收试剂盒 (增强型)(型号:DP219,品牌TIANGEN,China)对提取的细菌基因组进行纯化.纯化后的DNA送至上海美吉生物医药科技有限公司对16S DNA引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3')进行双向测序.获得的序列在NCBI 数据库进行BLAST比对, 获取序列相似度较高菌株,随后将NCBI获得的序列相似度较高的菌株同SL1和SL2的序列在MEGA软件中进行序列比对.
1.2 微藻的培养
小球藻取自烟台市某城市污水处理厂活性污泥,经过富集后分离,培养液为f/2培养液,主要组分包括:NaNO375 mg L-1,NaH2PO4·H2O 5 mg L-1,Na2SiO3·9H2O 20 mg L-1,Na2EDTA 4.36 mg L-1,FeCl3·6H2O 3.16 mg L-1, CuSO4·5H2O 0.01 mg L-1ZnSO4·7H2O 0.023 mg L-1, CoCl2·6H2O 0.012 mg L-1,MnCl2·4H2O0.18mg L-1,Na2MoO4·2H2O 0.07mg L-1维生素B10.1g L-1,维生素B120.5 g L-1生物素 0.5 g L-1,采用Whatman GF/C滤膜过滤后的1L海水作为溶剂配置小球藻培养液.维生素溶液通过0.22 μm滤膜进行过滤除菌.培养条件:25 ℃,光照:5 000 lux,光周期12 h:12 h.
1.3 小球藻-细菌共生体系的建立
污水培养液的配制:为避免其他颗粒物以及杂菌对本研究的干扰,取某垃圾填埋场渗滤液,经沉淀、滤纸过滤固体颗粒物后,120 ℃,20 min高温灭菌,备用10 L滤液做污水培养液,盐度为15‰.该污水具有垃圾渗滤液污染物浓度超高的特征,具体水质参数参见结果与讨论中各实验组初始浓度(第0天).
藻细胞的收集:在无菌室内离心收集对数期小球藻,离心力5 000 g,时间15 min,温度4 ℃.
细菌的收集:利用无菌LB 平板培养基 (胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂20,去离子水950 mL)对细菌进行划线培养,30 ℃,培养12 h.挑取单菌落加入100 mL LB 液体培养基内 (胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,去离子水980 mL)培养30 ℃,24 h后,5 000 g,15 min,4 ℃条件下分别离心收集芽孢杆菌细胞.
实验设置(图1):实验室以1L玻璃烧杯作为培养装置,未加藻菌的污水培养液为对照组(CK),分别设置三组实验组Exp.1,Exp.2和Exp.3.Exp.1加入小球藻 (浓度:1×106cells mL-1);Exp.2加入小球藻(浓度:1×106cells mL-1)和细菌SL1(浓度:1×107cells mL-1);Exp.3加入小球藻(浓度:1×106cells mL-1)和细菌SL1(浓度:1×107cells mL-1).对照组及实验室分别设置三个生物学重复.每隔5天取样,去除藻,菌细胞后,测定无藻培养液的总氮(TN),氨态氮(NH4+-N),总磷(TP)和化学需氧量(CODCr)浓度.

图1 实验设计Fig.1 Experiment design
1.4 测定指标及方法
1.4.1 微藻计数方法
藻细胞计数采用视野法,计数前充分搅匀藻细胞培养液,取0.1 mL样品注入浮游植物计数框内,在400倍的Olympus BX23型光学显微镜下计数100个视野,每个样本重复计数3次.
1.4.2 细菌计数方法
细菌计数采用4',6-二脒基-2-苯基吲哚染色法.取1 mL搅拌均匀后的藻细胞培养液至离心管,加入2mL 4',6-二脒基-2-苯基吲哚染色法染料后,遮光染色10 min.将染好的藻液过滤至黑色0.2Millipore(GTBP02500,Millipore)上.滤干后,将滤膜取出,展平至载玻片上,调节荧光聚焦显微镜(FluoView FV1000,Japan)中与4',6-二脒基-2-苯基吲哚对应的荧光光源后,即可在100倍油镜下观计数察400个细胞.
1.4.3 水化学参数测定
TN,NH4+-N,TP和CODCr的测定参考《水和废水监测分析方法(第四版)》[9].
2 结果与讨论
2.1 芽孢杆菌的鉴定
将获得的SL1和SL2序列上传至NCBI,与现有细菌序列进行Blast比对.NCBI数据库下载相近序列,利用Mega 7.0进行比对,结果如图2所示,SL1和SL2均隶属于Firmicutes门;Bacilli纲;Bacillales目;Bacillaceae科;Bacillus属.其中SL1与Bacillusaryabhattai(HQ242766.1)和Bacillusmegaterium(KU179342.1)潜在相似度均很高,相似度99.86%,SL2与Bacillussubterraneus(MT125847.1)的相似度最高,相似度99.68%.

图2 最大似然法分析系统发育Fig.2 Molecular phylogenetic analysis by Maximum Likelihood method
2.2 处理体系中小球藻的生物量
小球藻在不同处理组细胞密度均有所增加(图3).小球藻在实验室开始后第5天加入至培养液中,初始细胞密度为1×106cells mL-1的小球藻随着培养时间的延长,小球藻密度增加;第10天在Exp.2和Exp.3中加入芽孢杆菌SL1和SL2后,小球藻的生长发生明显差异.小球藻密度在Exp.1中保持着对数期的持续增长;小球藻与SL1共存的Exp.2中,小球藻的细胞密度相对于Exp.1,细胞密度下降.加入SL3的Exp.3中,小球藻的细胞密度相对于Exp.1,细胞密度上升.上述结果说明小球藻能够在实验所用的含有超高营养盐和有机质的垃圾渗滤液中生长;小球藻与芽孢杆菌相互作用较为复杂,与纯小球藻处理组相比,芽孢杆菌SL1对于小球藻的生长具有抑制作用,芽孢杆菌SL2对于小球藻的生长具有促进作用.

图3 小球藻密度的变化Fig.3 Cell density of Chlorella in the cultures
小球藻是一种细胞结构简单,生长繁殖快的微生物,细胞内的蛋白质,脂肪和碳水化合物含量都很高,又有多种维生素,可食用和作为养殖鱼类饵料[10-11].利用污水内的营养物质培养微藻,同时小球藻对水中C,N,P等物质的同化作用[12-13],实现了高营养污水的净化.利用污水对小球藻进行大规模培养,对于实现资源再利用具有重要意义.
2.3 处理体系脱氮效果
TN和NH4+-N在不同的处理组中发生了显著的变化(图4).各实验组中,TN初始浓度(第0天)为2.34 g/L,NH4+-N初始浓度为300 mg/L.处理20天后,对照组中TN下降至2.24 g/L,去除率仅4%;在Exp.1中,TN下降至1.24 g/L,去除率为45.7%;在Exp.2中,TN下降至0.18 g/L,去除率为92%;在Exp.3中TN下降至0.56 g/L,降解率为76%.处理20天后,对照组中NH4+-N下降到了280 mg/L,去除率仅6%;在Exp.1中下降至165 mg/L,去除率为45%;在Exp.2中下降至24 mg/L,去除率为92%;在Exp.3中下降至84 mg/L,去除率为72%.

图4 TN 和NH4+-N在不同处理组中的浓度变化Fig.4 TN and NH4+-N concentration in each treatment
郑逸等[14]研究发现小球藻在高盐条件下对TN的去除率仅为29%.本研究也再次显示,单纯的小球藻处理体系对氮的去除率不高.而小球藻和芽孢杆菌共生可提高对TN和NH4+-N的去除率.本研究显示与单纯小球藻体系相比,小球藻和芽孢杆菌SL1、SL2的共生体系均提高了对TN和NH4+-N的去除率.而且小球藻-SL1共生体系更优于小球藻-SL2体系.Ji等的研究也表明,小球藻(C.vulgaris)和地衣芽孢杆菌(Bacilluslicheniformis)共生体系对TN和NH4+-N的去除可分别达到88.82%,84.98%[15].
2.4 处理体系除磷效果
与生源要素氮属于开放式循环不同,磷的循环属于封闭式循环.需要在污水处理系统的后端通过沉淀、絮凝、过膜等手段将藻菌共生体及其碎片与水分离,进而达到去除磷的目的.因此本研究中所测定的TP也仅指的是将处理体系中藻菌去除后液体中溶解的总磷.随着培养时间的延长,不同处理组中TP均出现了明显下降(图5).对照组经过20天的处理,TP从初始浓度(第0天)116 mg/L下降到98 mg/L,去除率为15.6%;Exp. 1处理组下降至72 mg/L,去除率为37.9%;Exp.2处理组下降至22 mg/L,去除率为81.3%;Exp.3处理组下降至17 mg/L,去除率为85.3%.已有研究明,小球藻与芽孢杆菌共生体系可以有效地吸收活性磷[15].本研究中发现,即使小球藻在Exp.1组中的生物量高于Exp.2组,该组对溶解态TP的去除率却并不理想.这说明,藻菌共生体系对磷的去除效率远高于藻单独存在时.

图5 TP在不同处理组中的浓度变化
2.5 处理体系降解化学需氧量效果
随着处理时间的推进,CODCr在对照组中从初始浓度65.2 g/L(第0天)下降到51 g/L(第20天),降解率为21.8%(图6).但是,在Exp.1中下降至10.2 g/L,去除效率为76.7%;在Exp.3中下降至3.7 g/L,降解效率为94.3%.与结果预期不相符合的是,Exp.2组COD去除不明显,可能是由藻类凋亡释放部分溶解性有机质进入水中导致(图3).与本实验结果类似,Gupta等分离的细菌Bacillussp. ISTVK对污水CODCr的去除率可达到92%的[16];Church等的研究表明藻菌共生体系可显著提高去除污水中的CODCr的效率[17];Ji等的研究中C.vulgaris和Bacilluslicheniformis共生体系对CODCr的去除率可达到82.25%[15].结合本实验研究结果,小球藻,小球藻和芽孢杆菌的共生体系对CODCr均具有较好的降解效果.
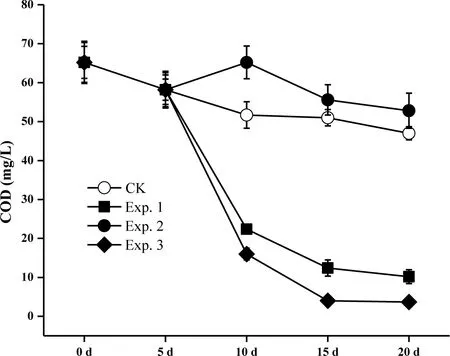
图6 CODCr在不同处理组中的浓度变化Fig. 6 CODCr concentration in each treatment
3 结论
本研究提供了一套从垃圾渗滤液中分离芽孢杆菌到构建藻-菌共生系统,进而处理垃圾渗滤液污水的技术思路.得到如下结论:
(1)小球藻能够在垃圾渗滤液所制得的污水中生长;
(2)本研究获得的两株芽孢杆菌均提升了藻-菌共生体系对于TN,NH4+-N和TP的去除率;
(3)分离获得的SL2菌株还可以促进小球藻的生长,促进污水中CODcr的降解,在污水处理行业具有一定的应用潜力.

