桦木酸在缺氧条件下对PC⁃3细胞干性、侵袭、迁移、黏附及HIF⁃1α表达的影响
谢尚延 黄帅 王斌 林卓远 钟少文 梁宝霞
广州医科大学附属第二医院1骨科,2急诊外科,3泌尿外科,4放射科(广州510260)
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一[1],近年来,其发病率呈上升趋势,有效防治PCa 已成为公共医疗卫生亟待解决的问题[2-3]。目前,PCa 治疗方式主要有手术切除、放化疗、雄激素去势等,但是这些方法仅对PCa 的初期阶段有效,而PCa 晚期极易复发、耐药和转移。此外,晚期PCa 常伴随骨痛、脊髓压迫等骨转移症状,因此迫切需要寻找能有效治疗PCa 的药物。
桦木酸(betulinic acid,BA)是一种羽扇豆烷型五环三萜类化合物,可从酸枣、白桦树皮等多种植物中提取,目前已知其具有抗瘤、抗感染及抗炎等多种生理活性。SHIN 等[4]发现桦木酸可抑制PC⁃3 细胞的血管生成,但其对PC⁃3 细胞的增殖、干性及转移的影响与机制尚未明确。本研究选取人前列腺癌细胞PC⁃3 作为研究对象,检测桦木酸在缺氧条件下对PC⁃3 细胞干性、侵袭、迁移、黏附及HIF⁃1α 表达的影响,为桦木酸治疗PCa 及骨转移提供依据。
1 材料与方法
1.1 材料、试剂和仪器人前列腺癌细胞株PC⁃3购于美国模式菌种收集中心(ATCC);RPMI⁃1640培养基和胎牛血清购于美国Gibco 公司;桦木酸(纯度≥98.0%)、胰岛素购于美国Sigma公司;CCK⁃8试剂盒和BCA 蛋白浓度测定试剂盒购于上海碧云天生物技术有限公司;Transwell 小室购于美国Mil⁃lipore 公司;Matrigel 胶和抗HIF⁃1α 抗体购于美国BD 公司;EGF、bFGF 购于美国eBioscience 公司;B27 购于美国Invitrogen 公司;HIF⁃1α、纤维连接蛋白购于美国CST 公司;鼠抗α⁃tublin 抗体、兔单克隆抗体CD31、CD44 购于美国Abcam 公司,ECL 化学发光剂购于英国Amersham 公司。逆转录试剂盒和PCR 试剂盒购自广州复能基因有限公司,ELISA 试剂盒(VEGF 购于上海Excell 公司,IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 购于美国R&DSystems 公司)。
CO2培养箱(水套式,美国Thermo 公司);多功能酶标(Stnergy⁃4 型,美国Biotek 公司);倒置相差显微镜(TH⁃200 型,日本Olympus 公司);离心机(IEC⁃CL31R 型,美国Thermo Fisher 公司);PCR(自动化PCR 仪,美国Thermo Fisher Scientific 公司)。
1.2 方法
1.2.1 细胞培养PC⁃3 细胞培养基为1640 培养基(含10%胎牛血清、100 mg/L 链霉素及100 U/mL 青霉素),于37 ℃、5% CO2条件中培养,选取对数期生长细胞用于实验。缺氧微环境在低氧培养箱(O2浓度为1%)进行模拟。
1.2.2 CCK⁃8 检测细胞增殖使用胰酶消化PC⁃3细胞,用RPMI⁃1640 培养基配制成3×104个/mL 的细胞悬液接种在96 孔板(100 μL/孔),过夜培养后添加含不同浓度桦木酸(0、0.5、1、5、10、15、20、30、40 μmol/L)的培养基,以DMSO(终浓度为0.05%)为对照。2 d后检测桦木酸对PC⁃3细胞增殖能力的影响,检测时每孔加入10 μL CCK⁃8 工作液,将培养板放入37 ℃培养箱内孵育3 h 后,于酶标仪在450 nm 处检测吸光度值,并计算抑制率为50%时的药物浓度得到半抑制浓度(IC50)值。然后以IC50浓度的桦木酸处理PC⁃3 细胞,培养0、1、2、3 d,检测桦木酸对PC⁃3 细胞增殖能力的影响。
1.2.3 Transwell 检测PC⁃3 细胞侵袭、迁移能力按常氧、缺氧及缺氧+IC50(10 μmol/L)桦木酸3 组分别处理PC⁃3 细胞2 d,胰酶消化PC⁃3 细胞并调至1×106个/mL,在Transwell 上室加入200 μL 细胞悬液,下室加入800 μL 培养基后。继续培养1 d后棉签擦去小室膜上细胞后,4 %多聚甲醛固定15 min,0.1 %结晶紫染色10 min。用光学倒置相差显微镜观察并拍照,随机选取5 个高倍视野计数,计算均值。
1.2.4 纤维连结蛋白检测细胞黏附于6 孔板中每孔加入1 × 104个PC⁃3 细胞过夜培养,PC⁃3 细胞分常氧培养、缺氧培养及缺氧+IC50(10 μmol/L)桦木酸3 组,分组如上分别处理2 d 后,细胞胰酶消化后调整为1 × 105个/mL。将200 μL 悬液接种在96 孔板(提前用纤维连结蛋白、BSA 分别孵育2 h和30 min)培养过夜,PBS 洗2 次,4 %多聚甲醛固定15 min,0.1%结晶紫染色10 min,用光学倒置相差显微镜观察并拍照并计数。
1.2.5 肿瘤成球实验检测细胞干性于6 孔板中每孔加入3 × 105个PC⁃3 细胞过夜培养,PC⁃3 细胞分常氧培养、缺氧培养及缺氧+IC50(10 μmol/L)桦木酸3 组,分组如上分别处理,2 d 后胰酶消化,以1×103个/mL 密度接种于24 孔低黏附培养板并加入成球培养基(含B27、20 ng/mL 表皮生长因子、0.4%白蛋白和5 μg/mL 胰岛素)。继续培养14 d后显微镜观察并计算肿瘤球数。公式:肿瘤球形成率(100%)=每孔肿瘤球均数/接种活细胞总数×100%。
1.2.6 PCR 实验TRIzol 试剂提取样品的总RNA,使用逆转录试剂盒构建CD31、CD44 及HIF⁃1α 的cDNA。随后,使用RT⁃PCR 试剂盒将样品进行扩增。以GAPDH 为参照,用2⁃ΔΔCq 法分析mRNA的相对表达水平。

表1 qRT⁃PCR 引物序列Tab.1 Primer sequerue of qRT⁃PCR
1.2.7 蛋白质免疫印迹法检测CD31、CD44 和HIF⁃1α的蛋白表达于6孔板中每孔加入3×105个PC⁃3细胞过夜培养,PC⁃3细胞分常氧培养、缺氧培养及缺氧+IC50(10 μmol/L)桦木酸3 组,分组如上分别处理,培养48 h 去掉培养液,预冷的PBS 洗涤3 次,加入蛋白裂解液充分裂解细胞,95 ℃10 min 蛋白变性处理后离心取上清液并用BCA 试剂盒检测定量。取50 μg 蛋白样品进行电泳,转膜,5%BSA室温摇床封闭30 min,TBST 洗膜,加一抗HIF⁃1α(1∶200)、一抗CD31(1∶200)和一抗CD44(1∶200),4 ℃孵育,TBST 洗膜后分别加二抗(α⁃tublin,1∶8 000)室温孵育2 h,暗盒显影。
1.2.8 酶联免疫吸附试验生长在6 孔板中的PC⁃3细胞分别按常氧培养、缺氧培养及缺氧+IC50(10 μmol/L)桦木酸处理2 d,收集细胞上清液,4 ℃下离心10 min 去除细胞碎片,然后根据说明书用ELISA 试剂盒检测VEGF、IL⁃8、IL⁃1β、IL⁃6、TNF⁃α的表达。
1.3 统计学方法每个实验独立重复3次。数据以均数±标准差表示,应用SPSS 25(SPSS Inc,Chicago,IL,USA)统计软件进行统计分析。两组之间的数据用t检验进行比较,组间差异采用单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 桦木酸抑制缺氧环境中PC⁃3 细胞的活力将不同浓度的桦木酸处理PC⁃3 细胞2 d 后,结果表明与对照组相比,桦木酸呈剂量依赖性抑制PC⁃3细胞的增殖能力,其IC50为10 μmol/L,差异有统计学意义(P<0.01,图1)。为进一步考察桦木酸抑制细胞活力的时间依赖性,在此基础上检测了桦木酸(10 μmol/L)处理PC⁃3 细胞0、1、2、3 d 后的增殖能力,结果表明与对照组相比,桦木酸呈时间依赖性抑制PC⁃3 细胞的增殖能力,差异有统计学意义(P<0.01,图2)。
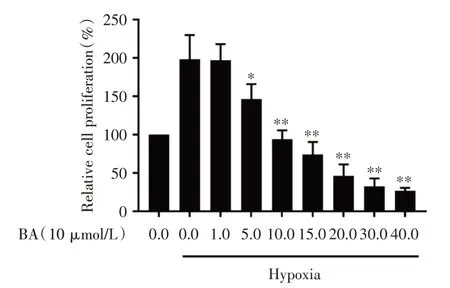
图1 不同浓度桦木酸对PC⁃3 细胞增殖的影响Fig.1 Effects of different concentrations of betulinic acid on the proliferation of PC⁃3 cells

图2 桦木酸在不同培养时间下对PC⁃3 细胞增殖的影响Fig.2 Effect of betulinic acid on the proliferation of PC⁃3 cells under different culture time
2.2 桦木酸抑制缺氧环境中PC⁃3 细胞的干细胞特性肿瘤干细胞与肿瘤细胞自我更新能力密切相关,成球试验是判断肿瘤细胞在条件培养基中自我更新的能力,可用于评价细胞的干性。缺氧是实体瘤中普遍存在的状态,因此在本实验中,通过细胞成球实验检测了桦木酸在缺氧条件下对PC⁃3细胞干性的影响。结果发现缺氧能诱导PC⁃3 细胞的肿瘤球形成率的增加,而用桦木酸(10 μmol/L)处理的PC⁃3 细胞在缺氧环境中的肿瘤球形成率明显受抑制(P<0.01,图3)。

图3 桦木酸抑制缺氧诱导下PC⁃3 细胞的肿瘤球形成Fig.3 Betulinic acid inhibits thespheres of PC⁃3 cellsunder hypoxia
2.3 桦木酸抑制缺氧环境中PC⁃3 细胞的侵袭、迁移细胞干性与细胞的运动和侵袭能力关系密切,通过Transwell 实验检测了桦木酸在缺氧环境中对PC⁃3 细胞侵袭、迁移的影响。结果表明,缺氧可以增加PC⁃3 细胞的侵袭、迁移能力,而桦木酸明显抑制PC⁃3 细胞在缺氧环境中的侵袭、迁移能力(P<0.01,图4、5)。

图4 桦木酸抑制PC⁃3 细胞侵袭Fig.4 Betulinic acid inhibits the invasion of PC⁃3 cells

图5 桦木酸抑制PC⁃3 细胞迁移Fig.5 Betulinic acid inhibits the migration of PC⁃3 cells
2.4 桦木酸抑制缺氧环境中PC⁃3细胞的黏附细胞黏附对维持细胞结构、生长与功能、运动与转移等多种生理过程起着重要的作用,本研究中通过细胞黏附实验发现缺氧可以增加PC⁃3 细胞的黏附,而桦木酸明显抑制PC⁃3 细胞在缺氧环境中的黏附能力(P<0.01,图6)。

图6 桦木酸抑制PC⁃3 细胞黏附Fig.6 Betulinic acid inhibits PC⁃3 cell adhesion
2.5 桦木酸抑制缺氧环境中HIF⁃1α的表达为了进一步研究桦木酸对缺氧PC⁃3 细胞内相关调控蛋白的影响,通过Western blot、PCR 实验检测了桦木酸(10 μmol/L)处理前、后HIF⁃1α 蛋白表达变化。Western blot 实验结果表明,与对照组相比,缺氧能够诱导HIF⁃1α 蛋白表达(P<0.01),而加入桦木酸(10 μmol/L)处理使PC⁃3 细胞缺氧后的HIF⁃1α蛋白表达较缺氧组明显下降(P<0.01)。PCR 实验结果表明,与对照组相比,缺氧处理PCa 骨转移PC⁃3 细胞48 h 后,HIF⁃1α 的mRNA 表达上调(P<0.01),而加入桦木酸(10 μmol/L)后,HIF⁃1α的mRNA 表达较缺氧组明显下调(P<0.01,图7)。同时还通过PCR 和Western blot 检测了桦木酸在缺氧条件下对PC⁃3 细胞表达CD31、CD44 干性基因的影响,PCR 及Western blot 实验结果表明,与对照组相比,缺氧能够促进干细胞标记基因CD31、CD44 蛋白及mRNA 的表达(P<0.01);而加入桦木酸(10 μmol/L)后,PC⁃3 细胞中CD31、CD44 蛋白及mRNA表达水平较缺氧组明显下降(P<0.01,图7)。

图7 桦木酸降低低氧环境中PC⁃3 细胞CD31、CD44 和HIF⁃1α 的表达Fig.7 Betulinic acid decreased the expression of CD31,CD44 and HIF⁃1 α in PC⁃3 cells under hypoxia
2.6 桦木酸抑制缺氧环境中PC⁃3 细胞中炎性细胞因子VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 的表达为了进一步研究桦木酸对缺氧PC⁃3 细胞内炎性细胞因子表达的影响,采用ELISA 法检测了桦木酸(10 μmol/L)处理前、后VEGF、IL⁃8、IL⁃1β、IL⁃6和TNF⁃α 因子的表达变化。结果表明,缺氧能够诱导VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 因子的表达(P<0.01),而加入桦木酸(10 μmol/L)处理使PC⁃3细胞缺氧后的VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 因子的表达较缺氧组明显下降(P<0.01,图8)。

图8 桦木酸降低缺氧诱导下PC⁃3 细胞VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 因子的表达Fig.8 Betulinic acid decreased the expression of VEGF,IL⁃8,IL⁃1 β,IL⁃6 and TNF⁃αfactorsin PC⁃3 cells induced by hypoxia
3 讨论
目前,多种天然产物已被证实可用于治疗多种疾病,如阿尔茨海默病、糖尿病、肿瘤等。由于分子结构的多样性和生物相容性,天然产物一直是药物开发的重要来源。从天然产物中探索疾病靶点的先导化合物,有望缓解当前药物发现来源方面的不足。桦木酸是一种羽扇豆烷型五环三萜类化合物,具有多种生理活性。研究表明桦木酸可抑制黑色素瘤、乳腺癌、脑癌等多种肿瘤细胞的增殖从而发挥抗癌活性,本研究发现桦木酸呈浓度和时间依赖性抑制前列腺癌骨转移PC⁃3 细胞的增殖能力,其IC50抑制浓度为10 μmol/L,该结果表明桦木酸具有抑制PC⁃3 细胞生长的潜力。
肿瘤干细胞具有无限增殖、自我更新、高致瘤能力和耐药等特征,是维持肿瘤生长及肿瘤复发、转移等生物学行为的根源。COLLINS等[5]研究发现,前列腺癌组织中也存在一部分特征与干细胞相似的肿瘤细胞亚群,即肿瘤干细胞样细胞(cancer stem⁃like cells,CSCs),亦称肿瘤干细胞(cancer stem cell,CSCs)。CSCs 普遍存在于大多数肿瘤中,且对化疗和放疗有极高的耐受性,因此,CSCs 是导致肿瘤复发,耐药和转移的极其重要的原因之一。肿瘤细胞干性与肿瘤增殖能力密切相关,肿瘤成球试验则是判断单个细胞在合适的条件培养基中自我更新的能力,可用于评价细胞的干性。CD44是一种黏附分子,在间质细胞、上皮细胞和部分肿瘤细胞中呈高表达[6-7]。研究证实CD44 参与肿瘤的发生、复发和远处转移,是前列腺肿瘤干细胞的一种特征分子[8]。CD31亦称PECAM⁃1,是一种跨膜糖蛋白,是参与血管生成内皮细胞标记物,并与肿瘤转移有关[9-11]。在缺氧环境中检测了桦木酸对PC⁃3 细胞干性的影响,结果表明桦木酸使PC⁃3 细胞缺氧后诱导的肿瘤球形成率明显受抑制。进一步的研究发现,桦木酸可下调缺氧状态下PC⁃3 细胞中CD31、CD44 的mRNA 及蛋白的表达,进而影响PC⁃3 细胞的干性。
恶性肿瘤最主要的特征是肿瘤内部缺氧微环境形成和远处转移。缺氧可诱导产生缺氧诱导因子⁃1α(hypoxia inducible factor⁃1α,HIF⁃1α)以调节下游相关基因的转录和表达,最终使肿瘤细胞在低氧条件下获得较强的增殖、侵袭及迁移能力。肿瘤组织中HIF⁃1α 的表达水平与肿瘤的进展、转移和放化疗抵抗力密切相关[12-14]。本研究通过体外缺氧模型发现桦木酸处理PC⁃3 细胞后,细胞HIF⁃1α 蛋白的表达明显下降,HIF⁃1α 相关mRNA表达明显下调,提示桦木酸可促使HIF⁃1α 在缺氧环境中表达下降。侵袭和迁移是肿瘤生物学特性之一,两者是复杂的相互关联过程,是肿瘤患者发生远处转移和致死的主因。另一方面,细胞黏附对维持细胞正常的结构、生长与功能、运动与转移能力等多种生理过程起着重要的作用。本研究结果表明,桦木酸可有效抑制缺氧环境中PC⁃3 细胞的侵袭、迁移能力,同时桦木酸还能抑制缺氧环境中PC⁃3 细胞的黏附能力。
细胞炎性因子与肿瘤的多种恶性行为密切相关[15],如血管内皮生长因子(VEGF)可以改变骨髓微环境,使其从静止状态转变为高度促血管生成和促肿瘤的环境,因此它对调节血管生成和细胞功能具有重要意义。有研究发现其在前列腺癌中的表达水平与肿瘤分级、血管生成和致瘤性相关。白细胞介素⁃1β(IL⁃1β)是肿瘤微环境中宿主间质或浸润细胞产生的血管生成蛋白,促进肿瘤生长和转移。白细胞介素⁃6(IL⁃6)和白细胞介素⁃8(IL⁃8)是一种多功能细胞因子,在体内外均显示出较强的血管生成潜能,并能显著促进肿瘤的生长和转移。肿瘤坏死因子⁃α(TNF⁃α)是一种由巨噬细胞、中性粒细胞和肿瘤细胞等产生的多效促炎细胞因子。TNF⁃α 与肿瘤的各个环节相关,包括细胞增殖、侵袭和转移。ELISA 实验结果提示,缺氧能够诱导VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 因子的表达,而加入桦木酸处理使PC⁃3 细胞缺氧后的VEGF、IL⁃8、IL⁃1β、IL⁃6 和TNF⁃α 因子的表达较缺氧组明显下降,表明桦木酸可抑制相关炎性细胞因子表达,进而影响PC⁃3 细胞的生物学行为。
综上所述,桦木酸可抑制PC⁃3 细胞的活力及干细胞特性,其作用机制可能与桦木酸抑制HIF⁃1α 及干性相关蛋白表达,抑制PC⁃3 细胞的炎性细胞因子分泌有关。提示桦木酸可能作为抗前列腺癌药物,有效的防治前列腺癌骨转移。本研究结果为开发和筛选新型抗前列腺癌药物提供了实验理论依据,但目前研究结果均为体外研究,下一步将进一步深入研究其作用机制和体内抗瘤效果。

