pH响应型碳点的荧光机制和生物医学应用
何松杰, 张清梅,2*, 张路鹏, 杜秀娟 , 陈峰华, 李 冰
(1. 太原科技大学 应用科学学院, 山西 太原 030024;2. 福建师范大学物理与能源学院 福建省量子调控与新能源材料重点实验室, 福建 福州 350117;3. 山西医科大学 口腔医学院, 山西 太原 030051)
1 引 言
生物体内,pH在许多细胞代谢过程中起着至关重要的作用,细胞的功能障碍往往与细胞器中的pH值异常有关[1-2]。在细胞内,pH在很小范围内的波动往往会导致细胞不当的生长和分裂[3-6]。因此,监测生物体内活细胞中的pH值在疾病的诊断与治疗方面具有重要意义。目前市场上用于制备荧光探针的材料主要有荧光团[7]、荧光纳米材料[8]以及荧光蛋白[9]。量子点作为一种最常见的荧光纳米材料,具有比荧光团更加稳定的发光,然而量子点大多由半导体材料制成,细胞毒性较高且难溶于水,导致其不能在细胞内pH的监测及生物医学应用方面很好地发挥作用[10]。
碳点(CDs)是至少有一维小于10 nm的碳纳米材料,由sp2/sp3杂化碳原子核和附着态组成[11-12]。根据碳核和附着状态的不同一般将CDs分为四大类:石墨烯量子点(GQDs)、碳纳米点(CNDs)、碳量子点(CQDs)和聚合物点(PDs)[13-14]。碳点作为一种新型的碳基荧光纳米材料,由于其优异的生物相容性、独特的荧光性质、可调谐的光致发光、丰富的表面官能团、高的稳定性、碳源的取材广泛及成本低廉等而备受关注,在细胞成像[15-17]、癌症治疗[18-25]、光催化[26-28]、发光二极管[29-31]、离子检测[17,32-35]、温度传感[36-37]、指纹检测[38]、信息加密[39-40]和储能[11,12,41-44]等诸多领域展现出了很好的应用前景。碳点表面是由大量的碳、氢、氧等亲水性官能团组成,相比半导体量子点而言,碳点无需进一步修饰就可均匀分散在水介质中。碳点的毒性低和良好的生物相容性使其在生物医学中具有潜在的应用前景。最近,杨柏课题组对CDs在生物传感方面的机理及应用做了系统的综述[45],葛介超[21]、郑敏[46]课题组分别对CDs在癌症的诊断和治疗方面进行了深入的研究,薛茗月课题组[47]在药物分析方面做了详细的综述。尽管CDs在生物医学中的应用已经有大量报道,但很少有对pH响应型碳点的综述报道[48-49]。本文的亮点在于将pH响应型碳点不同响应机制及其之间的协同关系进行了梳理,弥补了之前报道的机制之间相互分离,单独论述的不足,为进一步研究pH响应型碳点的荧光机制提供了一种思路。本篇综述首先介绍了pH响应型碳点的荧光机制,然后对pH响应型碳点在pH传感、生物成像和癌症治疗等方面的应用进行了系统的阐述。最后对当前研究现状进行了总结,提出了目前面临的挑战和未来发展的方向。
2 pH响应型碳点的荧光机制
为了更好地对pH响应型碳点进行可控制备和性能调控,对pH响应型碳点的荧光机制进行研究就显得尤为重要。pH的变化可能会改变pH响应型碳点的分子结构或者电子结构,这些改变可能会导致碳点发射波长和荧光强度的改变[48]。到目前为止,对pH响应型碳点荧光机制的研究仍然未达成共识,其中被人们广泛接受的核心机制是pH响应型碳点的碱性基团和酸性基团的质子化和去质子化。此外,pH响应型碳点在质子化和去质子化的作用下,在微观/宏观上具体表现为能级变化、碳点聚集、质子/电荷转移等机制[50]。不同pH响应型碳点的主要荧光机制如表1所示。

表1 不同pH响应型碳点的主要荧光机制和响应范围
表1(续)
碳点表面官能团的质子化和去质子化是典型的pH荧光机制[60]。如图1所示,酚羟基和羧基等酸性官能团通过共价键连接在碳点表面,在碱性条件下去质子化,碳点表面呈负电性;而在酸性条件下,碳点表面失去质子的一些官能团重新质子化,碳点表面表现为正电性。已有文献证明碳点由于质子化和去质子化导致的表面zeta电位的改变可能与其对pH的响应有关[51]。Hu等发现硫掺杂碳点的荧光强度对pH响应是可逆的,在378 nm的激发下,改变pH从3.0到9.0时,碳点的荧光强度逐渐增强。然后,将pH从9.0变化为3.0时,其荧光强度随之减弱。基于上述结果,可以得出硫掺杂碳点的光致发光强度与可逆的质子化和去质子化有关[52]。Huang等以柠檬酸为碳源,通过水热法制备双氰胺氮掺杂高量子产率(QY)的石墨烯碳量子点(GQDs),开发了一种用于环境和细胞内的通用定量pH传感器。得到的氮掺杂GQDs具有优异的光致发光性能,荧光量子产率为36.5%,碳点在1.81~8.96的pH之间具有光稳定性和pH响应性。进一步利用pH值与zeta电位的关系发现,荧光强度的变化可能是由于量子点表面羧基和酰胺基等官能团的可逆质子化和去质子化所致[2]。Yuan等通过电解石墨棒,在浓硝酸和浓硫酸混合溶液中回流合成了一种新型的水溶性多色荧光GQDs,它对1.0~14.0的全酸碱度都有响应。在365 nm激发下,当pH从1.0增加到11.0时,碳点光致发光峰的位置从522 nm红移到575 nm,这可能是由于含氧官能团(如环氧基、羟基和羧基)的去质子化所引起的[61]。此外,Shi等的研究也证实了碳点可以在3.5~10.0的pH范围内用作荧光pH纳米传感器,且碳点的这种行为可能与羧基去质子化有关[62]。Zhang等通过天冬氨酸和NH4HCO3混合物的一步微波辅助热解成功合成了GQDs。所制备的GQDs荧光强度在pH从2.0~12.0变化时明显衰减,且在350 nm激发下,当pH从7.0~12.0变化时其发射峰从458 nm红移到491 nm。作者认为这种现象可能是由碳点表面官能团的质子化和去质子化引起的[63]。上述研究都将pH响应型碳点的荧光机制解释为质子化和去质子化,但我们通过调研认为,质子化和去质子化可能只是其荧光机制的核心部分,需要进一步研究pH响应型碳点在质子化或去质子化后是否引起其自身能级变化、质子/电荷转移以及碳点聚集等微观结构和表象的变化,并且它们之间或许存在某种协同效应,共同影响了碳点的光致发光性质。

图1 pH响应型碳点的荧光机制——质子化和去质子化
2.1 能级变化
碳点对pH响应的性质来源于表面含氧基团的质子化和去质子化,这是最广泛接受的机制之一。同时,在质子化和去质子化的基础上,H+/OH-引起的能级变化也被认为是碳点对pH响应的机制之一。pH的改变会导致碳点发生质子化或去质子化,碳点的表面态随之发生改变并影响碳点内部和表面之间的相互作用,从而进一步引起碳点能级发生变化,最终可能直接影响碳点的荧光性质。如图2所示,碳点在酸性条件下,随着酸性的增强,从左到右能级逐渐加宽;而在碱性条件下,如右边图所示,随着溶液碱性的增强,较宽的能级会逐渐变窄。Kong等以N-(β-氨基乙基)-γ-氨基丙基甲基二甲氧基硅烷和柠檬酸为碳源制备了pH响应型碳点。随着pH从1.0增加到12.0,碳点的荧光强度稳定地增加到几乎是pH为1.0样品5倍的水平,并且在405 nm的激发下,峰值位置从520 nm蓝移到463 nm。他们认为,吸收的羟基可以钝化碳点的表面缺陷,形成表面改性的保护壳层从而使碳点被隔离,降低了非辐射复合速率从而导致荧光强度增加和发射峰蓝移。而H+可以破坏羟基钝化的保护壳层,在碳点表面产生新的缺陷,并通过延长共轭链的长度和扩大碳点的尺寸导致荧光猝灭和发射峰红移。由于pH的变化,官能团的质子化和去质子化可能导致碳点的静电电荷发生改变,从而使费米能级发生变化[53]。Choudhury等以柠檬汁为碳源通过一步热解法合成碳点。他们研究发现,pH条件的改变可以显著改变碳点的能级结构,从而影响半导体激光器中涉及的电子跃迁类型。这种效应可能是由于存在于碳点表面的含氧官能团的去质子化引起的能级变化,并导致一些化学性质不同的碳点形成[64]。Zhao等以绿色天然材料海带为主要碳源,乙二胺为氮掺杂剂,采用微波法合成的碳点荧光强度在3.0~8.0的pH范围内呈线性关系,在370 nm的激发下,碳点的荧光强度随着pH的增加而降低。在较低的pH下,碳点表面发生质子化,氢键结合引起的羟基官能团的强烈振动耦合可导致其能级加宽。因此,碳点在酸性条件下的荧光强度很强。但在碱性条件下,去质子化过程中氢键效应的消除可能导致振动耦合的减少和更多的离散能级,从而导致碳点荧光强度降低[54]。因此,我们认为碳点表面发生的质子化或去质子化可能会引起碳点的碳核和表面官能团之间的相互作用发生改变,微观上表现为碳点的能级发生变化,宏观上则表现为碳点荧光强度或发射波长的改变。

图2 pH响应型碳点的荧光机制——能级变化
2.2 碳点聚集
碳点聚集也是碳点对pH响应的重要机制之一。pH响应型碳点在酸性或碱性条件下其表面会发生质子化或去质子化,一些碳点受此影响会在酸性条件下表现出自组装聚集,从而影响了碳点本身的光学性质,如图3所示。Xu等以H3PO4为原料,在低温60 ℃条件下一步氧化蔗糖制备了具有良好量子产率的磷酸功能化碳点,并研究了其在不同pH下的荧光可逆性质。研究发现,在3.0~13.0的pH范围内碳点的光致发光和紫外-可见吸收光谱是可逆的,并且首次在酸性条件下直接观察到碳点的自组装聚集。随着pH从2.0增加到13.0,碳点的最佳发射和激发峰都发生了红移。他们认为,在酸性条件下,碳点迅速聚集成较大的颗粒,表面的含氧官能团缓慢氧化,导致光致发光强度降低。而在碱性条件下,碳点的结构互变异构迅速发生,类似于作为碳点核心的酚羟基和醌残基之间的异构化,可以被视为一个大的共轭体系,由于氢化/脱氧过程发生得很慢而导致光致发光强度降低[55]。Sun等以苯二胺为碳源通过微波法合成了发红光的碳点,并系统地测量了该碳点在4.0~11.0的不同pH下的zeta电位。研究发现,随着pH从5.0增加到11.0,碳点的zeta电位从17 mV明显下降到-12 mV。同时结合透射电镜观察,发现随着pH的降低出现了碳点的聚集。结合透射电镜、zeta电位和碳点在较低pH下荧光猝灭的结果,可以得出在酸性条件下,较低的zeta电位意味着更少的碳点聚集,这可归因于碳点表面羧基和羟基的去质子化和减少的非共价分子相互作用[51]。最近,Atailson等研究也发现,碳点表面的zeta电位降低会导致碳点之间的斥力降低,从而增加了团聚的趋势[56]。因此,我们认为pH的改变会导致碳点的结构和碳点之间表面官能团的相互作用发生改变,宏观上表现为碳点表面的zeta电位发生改变,而zeta电位值的变化可能会影响在质子化或去质子化条件下碳点的自组装聚集程度。
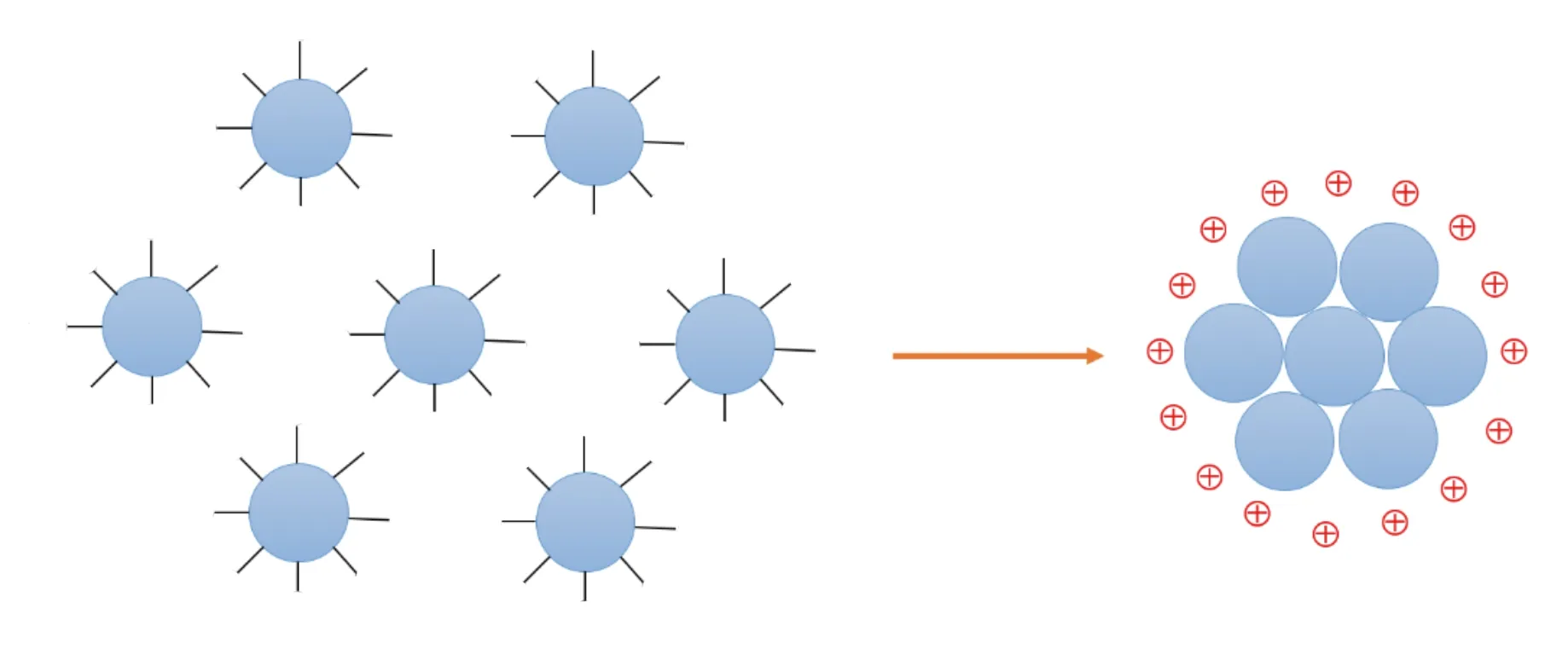
图3 pH响应型碳点的荧光机制——碳点聚集
2.3 质子/电荷转移
pH值变化导致碳点表面官能团的质子化或去质子化也会引起官能团和碳点发射位点之间的质子转移,从而影响碳点的光致发光。如图4所示,碳点表面官能团去质子化后留下的O-通过共价键相连在碳点表面,碳点通过质子转移改变其自身的表面态,从而对其自身光学性能产生影响,中间插图为激发态电子向碳点表面正电荷发射的简单示意图。Qian等采用溶剂热法处理四氯化碳和乙二胺合成了非晶态氮掺杂碳点。结果表明,在pH为5.0~13.5的范围内,在最佳激发条件下碳点的荧光强度与pH值成反比。进一步研究发现,随着pH的降低碳点的吡啶氮原子逐渐被质子化,质子可能从质子化的氮原子转移到共轭碳结构从而增强了碳点的荧光[65]。Lv等以对苯二胺为前驱体,在酸性溶液中水热反应10 h,制备出一种具有强橙光发射、pH和过氧化氢双重响应的碳点。在酸性条件下,随着pH值降低,在430 nm的激发光下,碳点的荧光强度急剧降低,这可归因于碳点表面的氨基质子化增加了—NH3+和碳点之间的分子内电子转移能力[57]。Wang等以间苯二胺为碳源,在浓H2SO4存在下采用溶剂热法合成了荧光量子产率为36% 的碳点。在450 nm的激发光下,碳点的荧光强度在pH为3.0~12.0范围内逐渐降低,并在6.0~10.0范围内呈现线性关系。深入研究发现,随着pH增加,碳点荧光猝灭的机制可归因于氨基中的孤对电子向碳点的正电荷发射。在高pH值下,碳点的激发态电子可以从最高占据分子轨道(HOMO)跃迁到最低未占据分子轨道(LUMO),然后氨基的基态电子由于其HOMO能级高于碳点而转移到碳点的HOMO能级,导致明显的荧光猝灭。相比之下,当质子化发生时,孤对氨基不可用于电荷转移,碳点的LUMO能级中的受激电子直接回到碳点的HOMO能级,从而使其荧光强度得以恢复[58]。此外,Liu等首次揭示了pH响应型碳点荧光强度与其特定表面结构的定量关系。他们认为羧基通过激发态质子转移影响碳点的非辐射与辐射复合之比,从而导致其荧光强度的变化。与此同时,α-H在β-二羰基烯醇化物中的解离增加了碳点共轭体系的离域程度,导致荧光红移且强度降低。因此,碳点的荧光强度可通过改变羧基和β-二羰基之比进行切换,从而获得较理想的pH响应。这项工作有助于更好地理解碳点pH响应的荧光机制,为可控调节其pH响应提供了一种有效的策略,并进一步促进了基于碳点的pH传感器的合理设计[59]。以上结果表明,在质子化和去质子化作用下,碳点表面的质子可能被转移到带负电荷的基团上,并且在适当波长的光照射下,吸收能量跃迁到激发态的电子可能会向碳点表面的正电荷发射。无论是质子亦或是电荷的转移,都改变了碳点的表面态,因此可以认为质子/电荷转移改变了pH响应型碳点的光学性能。
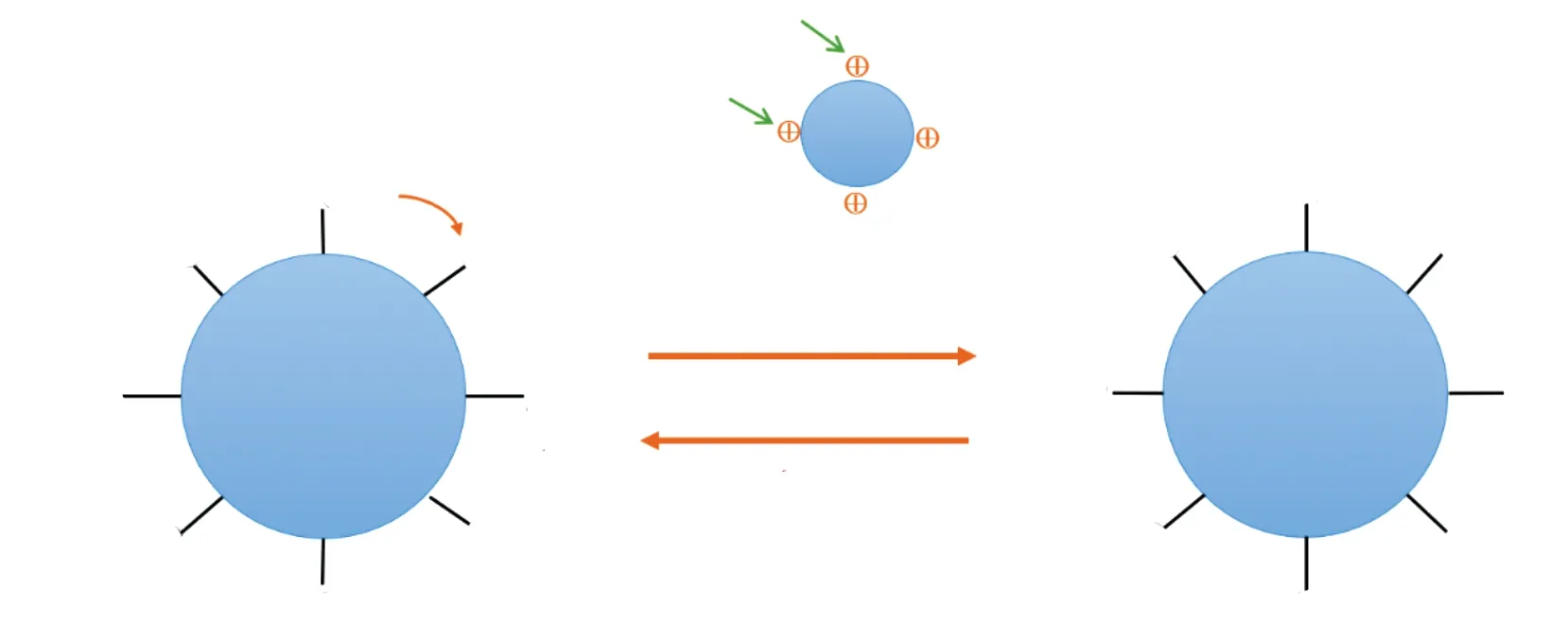
图4 pH响应型碳点的荧光机制——质子/电荷转移
pH响应型碳点作为碳点家族的重要成员之一,已经在众多领域展现出了巨大的应用潜力。对pH响应型碳点荧光机制的研究可以帮助我们更好地对其进行可控制备和性能调控。本文结合大量的文献研究,将pH响应型碳点的荧光机制总结为碳点表面官能团的质子化和去质子化改变了碳点的表面态,导致碳点的碳核和表面官能团之间的相互作用发生改变,或者影响了碳点之间的相互作用,从而可能表现为碳点自身能级变化、自组装聚集或表面质子/电荷转移等荧光机制。除上述这些机制外,有可能存在诸如碳点能级变化和碳点聚集、碳点能级变化和质子/电荷转移、碳点聚集和质子/电荷转移以及碳点能级变化、碳点聚集和质子/电荷转移的协同机制。在这些机制的协同作用下,宏观上表现为碳点的荧光强度或者发射波长发生改变。有关pH响应型碳点的这些荧光机制,还需要在实验上做进一步的探讨。
3 pH响应型碳点在生物医学方面的应用
pH响应型碳点因其优异的生物相容性和低毒性,在生物医学领域显示出了广阔的应用前景。
目前主要应用于pH传感、生物成像和癌症治疗等领域,如图5和表2所示。
图5 pH响应型碳点在生物医学方面的应用

表2 pH响应型碳点及其复合材料在生物医学领域的主要应用
注:PgP:聚乙二醇-g-(甲酰苯甲酸/半胱胺/溴乙胺)-共轭聚(二甲氨基乙基丙烯酸-甲基丙烯酸共羟乙基酯);CDs-Pt(Ⅳ)-PEG:碳点-顺铂(Ⅳ)-聚乙二醇药物递送系统;CA-CDs:碳点与海藻酸钙复合的水凝胶薄膜;MSNs-SS-CDP-AA:碳点通过二硫键连接到介孔二氧化硅纳米颗粒(MSN)表面组成的智能纳米载体;SCDs-MT:超碳点与线粒体靶向肽复合物;Ce6@IDCDs:chlorin e6与具有光敏性和pH响应性碳点的复合物。
3.1 pH传感
pH荧光探针一直都是生物医学领域重要的细胞或生物体内pH的检测手段,近年来,将碳点作为荧光探针应用于pH传感也受到了研究人员的广泛关注。Gao等以对苯二胺和硫脲为碳源制备了具有溶酶体靶向功能的碳点荧光探针。在360 nm激发下,所制备的碳点在4.0~8.0的pH范围内荧光强度逐渐减弱,且在4.0~7.4的pH范围内具有良好的线性关系,该碳点有望成为一种优良的pH荧光探针[66]。Liu等以邻苯二胺为前驱体,通过二次碳化制备了具有良好水分散性的碳点,该碳点表现出明显的pH依赖性。在450 nm激发下,随着pH从3.92增加到7.0,碳点(Scy-CDs)荧光强度逐渐增强,如图6(a)所示。图6(b)为在4.0~7.0 的pH下碳点荧光强度的线性拟合。碳点的pKa值为5.30,而这恰好与正常溶酶体pH值范围一致。此外,在较低的酸性条件下,碳点的荧光发生猝灭后,加入半胱氨酸(Cys)或同型半胱氨酸(Hcy)荧光会完全恢复,表现出灵敏的“开-关-开”的荧光现象,该传感器可用于细胞内溶酶体的pH检测[67]。Yang等以木质素为碳源、氢氧化镁和乙二胺分别为掺杂剂和钝化剂,一步水热法成功制备了镁氮共掺杂碳量子点(Mg,N-CQDs)。制备的Mg,N-CQDs在紫外灯照射下发射绿色荧光,荧光量子产率高达46.38%。在405 nm激发下,当碳点溶液的pH从12.0~5.4变化时,Mg,N-CQDs的荧光颜色从蓝色变为绿色, 进一步将pH值从5.4降低到2.2时,其溶液的荧光颜色又从绿色变为黄色。随着pH值从12.0降低到2.2,Mg,N-CQDs的最大吸收峰从400 nm移动到480 nm。同时,Mg,N-CQDs的荧光强度随着pH从7.0降低到2.2而逐渐降低。这种现象可能是由于Mg,N-CQDs边缘的金属配体在酸性条件下发生改变,这种改变使其能够在细胞内pH检测中更好地发挥作用[80]。Li等设计了一种基于聚集诱导发射选择性检测四环素(TCs)和pH的新型荧光探针。作者以中性红和硫脲为原料,采用一锅水热法合成了具有红色荧光、低细胞毒性和优异光稳定性的碳点。制备的碳点对pH表现出良好的传感能力,在3.0~5.0的pH范围内,碳点的光致发光强度略有变化。随着pH从5.0增加到9.0,光致发光强度急剧下降, 同时溶液的颜色从粉红色变为黄色。该pH响应型碳点表现出令人满意的可逆性、良好的化学稳定性以及对氢离子浓度的特异性。碳点的这些性质有利于双模pH传感的实现和细胞内pH的检测[68]。此外,Safavi,Guo,Chang以及Zhang等课题组也分别在pH传感领域做了相关的研究工作,并取得了一些很有意义的研究成果[50,69-71,81-82]。

图6 (a)在450 nm 激发下,Scy-CDs(0.04 mg·mL-1)在水中的发射光谱(pH从7.0降低到3.92);(b)在556 nm 处的发射下,Scy-CDs 的pH依赖性荧光强度变化[67]。
比率荧光探针能够有效地消除外界环境的干扰,因此可准确测量细胞及细胞器内的pH,目前已有一些基于碳点的比率型pH荧光探针的报道。例如,Wang等报道了一种使用3-氨基苯基硼酸(3-APBA)作为唯一前驱体,通过一步溶剂热法合成氮和硼共掺杂的碳点。碳点在单个激发波长下显示出两个发射峰,并且这两个发射峰以相反的趋势响应pH值的变化,因此作者将碳点作为比率式pH荧光探针应用于细胞内pH的检测[83]。Xu等以苯二胺和壳聚糖为前驱体,采用水热法合成了碳点。在380 nm的单波长激发下,在439 nm和550 nm处显示出双发射峰。并且随着pH值的增加,碳点在439 nm处的荧光强度略有下降,而在550 nm处的荧光强度明显增加,两个发射峰表现为相反的变化趋势。研究表明,该碳点具有出色的pH敏感性和抗干扰能力,可以用做比率荧光探针来测量活细胞内溶酶体的pH值,同时还可进行细胞成像[72]。
3.2 生物成像
pH响应型碳点已广泛应用于生物成像,它可以作为荧光标记物,在改变pH的情况下表现为荧光强度的变化或者荧光颜色的改变,并以此来监测活细胞的生理状况。Kong等报道了一种基于碳点的无机-有机荧光探针的设计和合成。这是基于碳点的无机-有机杂化纳米系统对活细胞和组织中的pH进行双光子荧光成像和生物传感的首次报道[84]。Shi等制备了可以应用于人宫颈癌(HeLa)细胞共聚焦荧光成像的碳点,并研究了硼掺杂碳点的pH依赖性荧光成像。硼掺杂碳点(0.6 mg/mL)和HeLa细胞在37 ℃下孵育0.5 h,然后分别在3种不同的磷酸盐缓冲液(pH=3.5,7.4,10.0)中孵育。研究发现,在pH 为10.0的磷酸盐缓冲液中,硼掺杂碳点染色的HeLa细胞显示出强蓝色荧光,且荧光亮度随着pH降低而明显降低[55]。Shen等制备了量子产率高达68% 的碳点,当pH从1.0提高到13.0时,碳点水溶液迅速由透明/无色变为黄绿色,且无聚集和沉淀。相反,当将碳点溶液调节到酸性条件时,该溶液颜色又变成透明/无色。基于碳点的低细胞毒性和优异的光学性质,已将其成功应用于细胞成像。在405 nm激发下,可以从HeLa细胞观察到碳点样品的蓝色发射[85]。Choi等利用荧光共振能量转移(FRET)机理构建了pH/氧化还原活化荧光碳点(FNP),该碳点可通过荧光“开-关”监测癌细胞的消除。当谷胱甘肽(GSH)的二硫键被还原、苯甲酸亚胺在酸性条件下被裂解时,FNP(IR825)在肿瘤细胞中的内化产生了生物成像能力。为了研究FNP(IR825)对谷胱甘肽水平和酸性条件的信号效应,Choi等使用激光共聚焦显微镜在不同细胞系中进行了观察。研究发现,在MDCK细胞中没有观察到荧光,在MDA-MB-231细胞中猝灭效应仅在酸处理时丧失,而在处理过的MDA-MB-231细胞中添加谷胱甘肽和酸证实了IR825的完全释放。同时Choi等还发现,他们的智能纳米载体可以在近红外激光照射下杀死小鼠体内的肿瘤细胞。如图7所示,用FNP(IR825)和近红外光谱处理的MDA-MB-231细胞出现死亡细胞数量增加(红色)的变化,而在近红外光谱处理的MDCK细胞中没有观察到显著变化(绿色)。因此,这个可调系统可用于评估基于FNP颜色变化的给药系统的效率,该系统依赖于细胞环境,同时用于光热治疗引导的生物成像以跟踪治疗进度[73]。Gao等制备了具有溶酶体靶向功能的pH响应型碳点。该碳点可以被细胞吸收然后进入溶酶体中,并应用于体外和体内pH变化的监测。脂多糖(LPS)可以模拟细胞内炎症,作者通过对昆明小鼠背部的3个不同位置皮下注射LPS、LPS+CDs、磷酸盐缓冲液(PBS)+CDs,进一步探索了CDs在LPS诱导的炎症模型中可视化pH变化的应用。实验结果表明,CDs可以作为跟踪体内pH变化的荧光探针应用于生物成像中[66]。到目前为止,pH响应型碳点作为荧光探针已被广泛应用于体内或体外生物成像,对活细胞、细胞器以及体内炎症的监测具有重要的生物学意义。目前,现有的文献中很少有单独使用碳点作为细胞器或组织中pH监测的荧光探针,因此需要我们进一步开发具有靶向性的pH响应型碳点对细胞内pH进行更加精准的监测。
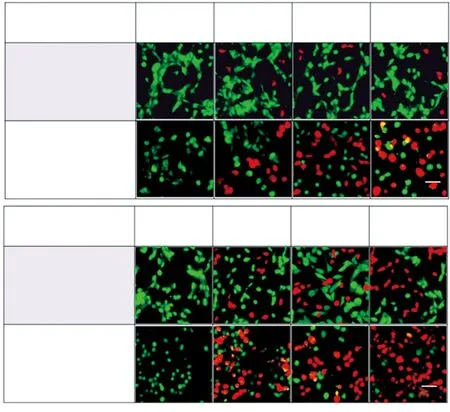
图7 在pH为7.4和6.8时,分别在MDCK正常细胞和MDA-MB-231癌细胞中使用pH/氧化还原活化荧光碳点得到的细胞成像图[73]。
3.3 癌症治疗
3.3.1 药物递送
研究表明,碳点在药物递送的应用中可以作为纳米载体或纳米载体的封端剂,同时还可以增加载体的载药量。Zhang等研究了一种基于pH响应型碳点的pH和氧化还原双重响应的CDs-Pt(Ⅳ)-PEG给药系统,如图8所示。作者以柠檬酸和氨水为碳源,采用一步水热法合成碳点,顺铂(Ⅳ)作为药物前体,醛官能化的单甲氧基聚乙二醇(mPEG-CHO)与碳点-顺铂(Ⅳ)共轭形成对pH响应的苯甲酸亚胺键,CDs-Pt(Ⅳ)-PEG药物递送系统对癌细胞的细胞毒性与顺铂相当,而对正常细胞的副作用显著降低。此外,该系统通过高对比度荧光成像实现了对癌细胞的识别。这种基于碳点的给药系统可以提高药物的利用效率,减少正常生理条件下的副作用。在癌细胞MGC-803中用CDs-Pt(Ⅳ)-PEG体系分别在7.4和6.8的pH下处理发现,CDs-Pt(Ⅳ)-PEG体系在pH为 6.8的条件下比pH 为7.4时具有更明显的抑制作用[74]。此外,Feng的团队也做了类似的研究工作,并得到了良好的实验结果[86]。随后Wang等通过将非线性聚乙二醇、壳聚糖和石墨碳点整合到单个纳米粒子中,设计了一类生物相容性聚乙二醇-壳聚糖@碳点杂化纳米凝胶,用于双光子荧光(TPF)生物成像和近红外光双响应药物释放以及协同治疗。碳点的复合增强了杂化纳米凝胶对疏水性抗癌药物的负载能力,壳聚糖可以诱导杂化纳米凝胶对pH敏感的溶胀/解溶胀,从而在pH为5.0~7.4的重要生理范围内调节药物的释放,并对包埋的pH响应型碳点进行表面调节以实现荧光pH传感,具有热敏性的非线性聚乙二醇可以通过嵌入的碳点在近红外辐射下产生的局部热来促进药物释放。体外实验结果表明,杂化纳米凝胶通过化学-光热联合治疗的协同效应表现出了很高的治疗效果[87]。Sarkar等以芦荟叶凝胶为碳源制备了pH响应型碳点,并设计制备了海藻酸钙(CA)水凝胶膜,旨在控制抗生素万古霉素在胃肠道(GI)中的递送。与CDs相比,CA/CDs膜的载药量从38%提高到89%。此外,加入β-环糊精后万古霉素的吸收能力提高了96%。万古霉素通过CA/CDs膜的释放在pH 1.5时更明显,这接近胃的pH值,并且发现在pH 1.5和β-环糊精共存时万古霉素的释放速率降低,在120 h内达到56%。CA/CDs水凝胶膜在pH 1.5和β-环糊精共存时的高药物吸收能力和较低的释放速率可作为万古霉素胃区控释的给药载体,为口服万古霉素提供一种潜在的选择[75]。Jiao等通过二硫键将pH响应型荧光碳点引入到介孔二氧化硅纳米粒子表面,研制了一种智能纳米载体用于氧化还原响应的药物控释和体内生物成像。使用多柔比星(DOX)作为模型药物以评估氧化还原反应的体外药物释放,结果表明,所制备的MSNs-SS-CDPAA/DOX在pH 7.4和pH 5.0的磷酸盐缓冲液中显示出高度氧化还原响应的药物释放,并具有实时成像能力以监测癌症治疗过程中的细胞行为[76]。以上结果表明,pH响应型碳点可以作为纳米载体或纳米载体的封端剂在药物递送中发挥重要作用。

图8 CDs-Pt(Ⅳ)-PEG纳米给药系统示意图[74]
3.3.2 光热治疗/光动力治疗
光热治疗(PTT)是利用光敏剂在激光照射条件下产生热疗、有效杀死癌细胞并抑制肿瘤转移的一种新兴癌症治疗方法。碳点由于其优异的光热转换性能,已有研究将其作为PTT试剂。Zhang等以柠檬酸和双氰胺为前驱体,采用水热法制备了一种具有pH响应特性的智能碳纳米点,用于癌细胞的选择性光热治疗。在中性条件下,该碳纳米点在红外区域附近没有吸收,而在弱酸性条件下,碳点发生聚集并在近红外区域附近表现出明显的吸收,因此可以将其应用于肿瘤的光热治疗。实验表明,碳纳米点能够在溶酶体中选择性内化,智能碳纳米点在癌细胞的溶酶体中内化后,癌细胞中较低的pH环境导致智能碳纳米点更严重的聚集状态,与未内化智能碳纳米点的癌细胞相比,内化了智能碳纳米点的癌细胞可以通过更大的光收集效应来提高PTT效应[77]。类似地,Shen等也以柠檬酸和双氰胺为前驱体,采用水热法并通过在酸性环境下自组装制备了小尺寸pH响应型碳点(约5 nm),调节碳点的pH值构建了具有高可见和近红外光吸收的新型SCD,所制备的SCD具有优异的光热转换效率和良好的生物相容性。进一步通过在SCD表面修饰线粒体和癌细胞靶向肽,以获得对癌细胞选择性、线粒体靶向的PTT敏感剂。结果表明,靶向SCD通过近红外光热疗法精准损伤癌细胞,癌细胞和正常细胞的存活率差异高达70%,表明该方法具有高特异性选择[78]。
光动力治疗(PDT)是指在适当的光源照射下,光敏剂产生的活性氧(ROS) 具有非常强的细胞毒性,可以杀灭癌细胞。Kim等以柠檬酸和1-(3-氨基丙基)咪唑(API)为碳源,通过微波和透析两步法合成了负载chlorine6(Ce6)的咪唑化pH响应型碳点(Ce6@IDCDs)。在pH为6.5的条件下,发现Ce6@IDCDs复合体系被破坏,这说明在该pH值时脱质子化咪唑的质子化导致Ce6@IDCDs解体。细胞实验表明,在肿瘤pH环境下,表面咪唑质子化导致封装在IDCD中的Ce6泄漏,从而产生更多单线态氧,与pH值为7.4的Ce6@IDCDs相比增加了2.15倍,并且在激光照射下成功地在肿瘤组织中引发了PDT效应。因此,Ce6@IDCDs激光照射很可能成为基于PDT的多种肿瘤免疫治疗的强大治疗平台[79]。
综上所述,pH响应型碳点不仅在监测活细胞和生物体内的pH变化方面具有很好的应用前景,而且在癌症治疗方面作为药物载体或者光敏剂也发挥着重要的作用。这些报道为我们进一步开发pH响应型碳点在生物医学中的重要应用指明了方向。
4 总结与展望
碳点以其独特的荧光特性、低毒性以及良好的生物相容性,在生物医学领域的应用中显示出巨大的潜力。本文对pH响应型碳点的荧光机制(以质子化和去质子化为核心机制,具体表现为能级变化、碳点聚集以及质子/电荷转移等机制)及其在生物医学领域的应用(pH传感、生物成像以及癌症治疗等)进行了系统的阐述。虽然有关pH响应型碳点的研究报道很多,但无论是荧光机制,还是在生物医学领域的应用,都有待于进一步探索。简述如下:
(1)到目前为止,pH响应型碳点的荧光机制仍然存在争议,有待进一步深入研究。诸如将揭示pH响应型碳点荧光机制的宏观光学性质和微观表征有机结合起来,或者利用第一性原理计算不同pH响应型碳点对应的能级宽度等来进一步探究其荧光机制。同时,在pH响应型碳点现有的荧光机制基础上,通过实验和理论研究进一步挖掘新的机制。
(2)碳点的表面官能团往往影响着碳点的荧光性能,因此我们有必要设计一种能够定量调控碳点表面官能团的实验来更好地研究碳点对pH响应的机理。深入探讨pH响应型碳点表面官能团和荧光机制之间的关系,为发展和设计可利用的pH荧光探针提供实验基础和理论支撑。
(3)pH响应型碳点在pH传感、生物成像以及癌症治疗方面的研究已有很多,然而对将其应用于光热治疗、光动力治疗以及光热和光动力协同治疗的研究很少,需要对pH响应型碳点在光热/光动力治疗方面的研究工作做深入的探索。
(4)目前对于由绿色环保的生物质碳源为前体来合成pH响应型碳点的报道较少,应该充分发挥生物质碳点先天无毒性及其药食同源的优势,积极探索pH响应型生物质碳点基多功能荧光探针,使其在生物医学领域大放光彩。
(5)拓宽pH响应型碳点的应用范围,目前其多应用在生物医学上的生物成像和癌症治疗方面,应当积极发展对pH响应型碳点在抗菌材料、伤口愈合以及促进成骨等其他领域的应用。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210307.

