外柱细胞软化对Corti器感音影响的生物力学研究
马文凯,徐旭,姚文娟
1.上海大学力学与工程科学学院,上海 200444;2.上海市应用数学和力学研究所,上海 200444
前言
世界卫生组织2019年的统计数据显示,全球残疾性听力损失人数达4.32 亿,占总人口的5%,预计2050年这一数字将达到7 亿,约占总人口的10%[1]。耳疾病已成为当下困扰人类健康的重要问题,其中感音神经性耳聋是最为复杂的一类听力损失疾病。感音神经性耳聋患者能够完成声音在外耳与中耳的机械传导,但不能完成内耳的机电转换过程。Corti器中的细胞结构损伤会引起感觉上皮细胞功能受限,这是感音神经性耳聋产生的最主要因素。
Corti 器是耳蜗感音的重要器官,具有精密而复杂的结构,处于蜗管的内淋巴液中。卵圆窗的振动通过外淋巴液传导至基底膜,然后Corti 器中的其他功能细胞相互协作,共同完成机械振动向电信号的转换。听觉的产生伴随着如基底膜、毛细胞、柱细胞等结构与淋巴液间的多种耦合作用,任何结构微小的性质变化都会对听力产生影响。血管舒张刺激磷蛋白(Vasodilation-Stimulated Phosphoprotein,VASP)能促进外柱细胞中肌动蛋白丝生长,它在外柱细胞中的表达与听力形成有关。Schick 等[2]通过实验测试了小鼠的听力发育情况,发现VASP 缺失会导致听力发育迟缓,并推测听力发育延迟是由于外柱细胞中肌动蛋白丝的延迟形成导致的。目前普遍认为在内毛细胞和外毛细胞之间,柱细胞充当刚性桥梁的作用。然而VASP 能够促进肌动蛋白丝形成[3],缺少肌动蛋白会导致外柱细胞刚度降低,这表明在耳蜗力学中,适当的外柱细胞刚度对听力很重要。2018年,Cooper 等[4]通过高分辨率光学测量实验发现,Deiters 细胞和外毛细胞间的结构耦合在外毛细胞的控制下将声音诱发的结构运动集中到两类细胞的结合区域,以优化耳蜗的调音和压缩,因此对该区域的力学行为进行研究具有重要意义。
目前对耳疾病的研究大多为传统的医学实验,这种方法能有效探究各种现象之间的联系,却难以揭示内在机理。Corti器所处的液体环境以及各细胞结构和材料的差异性必然使得听觉产生的过程极其复杂,给观测带来极大困难,有限元仿真的应用系统有效地解决了这类复杂问题。因此,本研究选取耳蜗某一特定位置通过建立Corti器三维有限元模型来研究细胞病变导致耳疾病的内在机理。
1 方法
1.1 有限元模型建立
本研究根据Edge等[5]和Richter等[6]对沙鼠Corti器测量的结果以及Murakoshi等[7]的报告获取有限元模型的几何参数。该段Corti器位于距离蜗底2.5~3.0 mm处,特征频率为16 kHz。基底膜由纤维层和基质构成,尽管透明基质的成分目前还不清楚,但是其与盖膜的凝胶状结构类似,因此,假设基底膜基质的杨氏模量与盖膜相同;内毛细胞杨氏模量与外毛细胞相同;骨质螺旋板杨氏模量与骨质材料相同。基底膜基质、Hensen 细胞、内毛细胞、外毛细胞以及盖膜杨氏模量相对较小的结构被认为是变形后体积非常接近变形前,泊松比设置为0.49,其余结构泊松比为0.30。淋巴液分为鼓阶中的外淋巴和蜗管中的内淋巴,均为不可压缩的流体,材料性质假设与水相同,密度取为1 000 kg/m3,动力粘度为0.659×10-3Pa·s。模型中各组织结构的材料参数见表1。

表1 Corti器材料参数Table 1 Material parameters of organ of Corti
基于COMSOL 仿真软件,建立流-固耦合的三维Corti器有限元数值模型,模型横截面如图1a所示,比例尺等于50 μm。几何绝对容差设置为1×10-5,经检查,结构无穿透和交叉。本模型采用四面体网格划分,总网格数为129 775,其中Corti 器总网格数为69 785,淋巴液流体总网格数为59 990。对于尺寸较小的结构,软件自动进行网格加密,最大单元大小为14.5 μm,最小单元大小为1.6 μm。网格有限元模型如图1b所示,其中灰色区域为淋巴液流体,深蓝色区域为Corti 器,静纤毛、毛细胞、趾骨突和Deiters 细胞被包裹在对应位置的内淋巴液中。
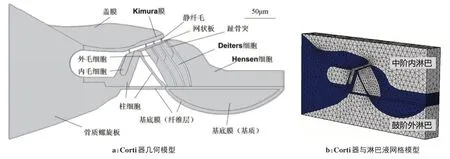
图1 Corti器与淋巴液流-固耦合有限元模型Figure 1 Fluid-solid coupling finite element model of organ of Corti and lymph
1.2 边界条件和载荷
除静纤毛、毛细胞、趾骨突和Deiters 细胞外,Corti 器在纵向上是连续的。Plassmann 等[16]通过实验测得沙鼠耳蜗纵向长度约为12 mm,而Corti 器的振动幅度为纳米级,远小于耳蜗纵向长度,因此本模型假设前后两个横截面边界不发生旋转和纵向位移,约束设置为辊支承。骨质螺旋板、Hensen 细胞以及基底膜纤维外侧面为固定约束。淋巴液与Corti器的接触面为流固耦合面。
卵圆窗振动在鼓阶的外淋巴液中产生压强,作用在基底膜底面。该压强大小与声压级和频率有关。根据定义:

可以导出外耳道声压有效值为:

其中,pref为参考声压,大小为2×10-5Pa,SPL为声压级。根据文献[17-18]的实验数据估计得出频率为16 kHz 时不同外耳道声压对应的鼓阶压强,即基底膜底面受到的压强,对应关系如表2所示。
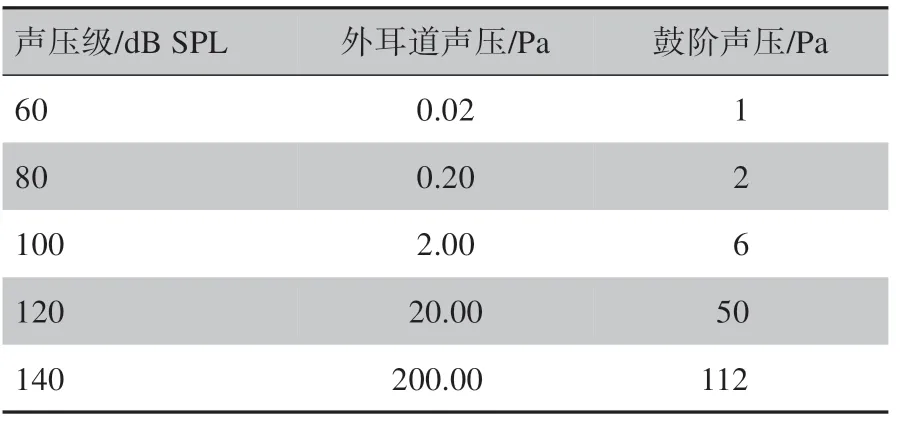
表2 声压级与鼓阶压强对应关系Table 2 Correspondence between sound pressure level and scala tympani pressure
2 结果与分析
2.1 模型验证
胞体伸缩运动在外毛细胞轴向产生主动力,放大基底膜位移,使之产生增益。Frank 等[19]实验表明主动放大过程中外毛细胞运动产生力的大小在整个听觉频率范围内处于恒定水平。根据文献[8,20]估算出外毛细胞两端主动力大小为1 kPa。基底膜位移测量位置如图2所示,将本模型60~140 dB 声压级下的基底膜位移增益与Overstreet 等[21]以及Ren 等[22-23]的实验数据进行对比,结果如图3所示,可以看出本模型的基底膜位移增益在实验数据的合理范围内,证明模型及计算方法的正确性。

图2 基底膜位移测量点位置示意图Figure 2 Schematic diagram of the basilar membrane displacement measurement point

图3 本模型的基底膜增益与实验结果对比Figure 3 Comparison of the basilar membrane gain of the proposed model and experimental results
2.2 基底膜位移增益
VASP缺失会影响外柱细胞中肌动蛋白丝的含量,进而影响刚度。Tolomeo等[15]使用DNA酶去除哺乳动物离体外柱细胞中的肌动蛋白丝,测量发现其刚度从7×10-4N/m下降到1.7×10-4N/m,降低约4倍。根据这一测量数据可大致估计出肌动蛋白丝对外柱细胞刚度的贡献。假设外柱细胞刚度服从弹性理论,与杨氏模量成正比,确定需要考察的外柱细胞杨氏模量变化的大致范围为0.2~1.0 GPa。分别选取0.2、0.4、0.6、0.8和1.0 GPa作为外柱细胞刚度变化时的杨氏模量,进行60~140 dB声压级下双向流固耦合作用的基底膜力学分析。基底膜位移增益变化如图4所示。结果表明,外柱细胞软化过程中基底膜位移增益变化包含两个不同的阶段,它们之间可能存在一个过渡的临界值,变化倍数大于该临界值时位移增益缓慢变化,小于该临界值时快速下降,这说明外柱细胞软化并不会立即影响Corti器的正常功能,缓慢变化阶段使Corti器正常工作得到缓冲。声压级对该临界值有影响,相对于低声压级,高声压级作用下临界值更小。声压级对位移增益缓慢变化阶段的影响也不同,60、80、100、120 dB声压级下该阶段为增大的趋势,140 dB声压级下为降低的趋势。

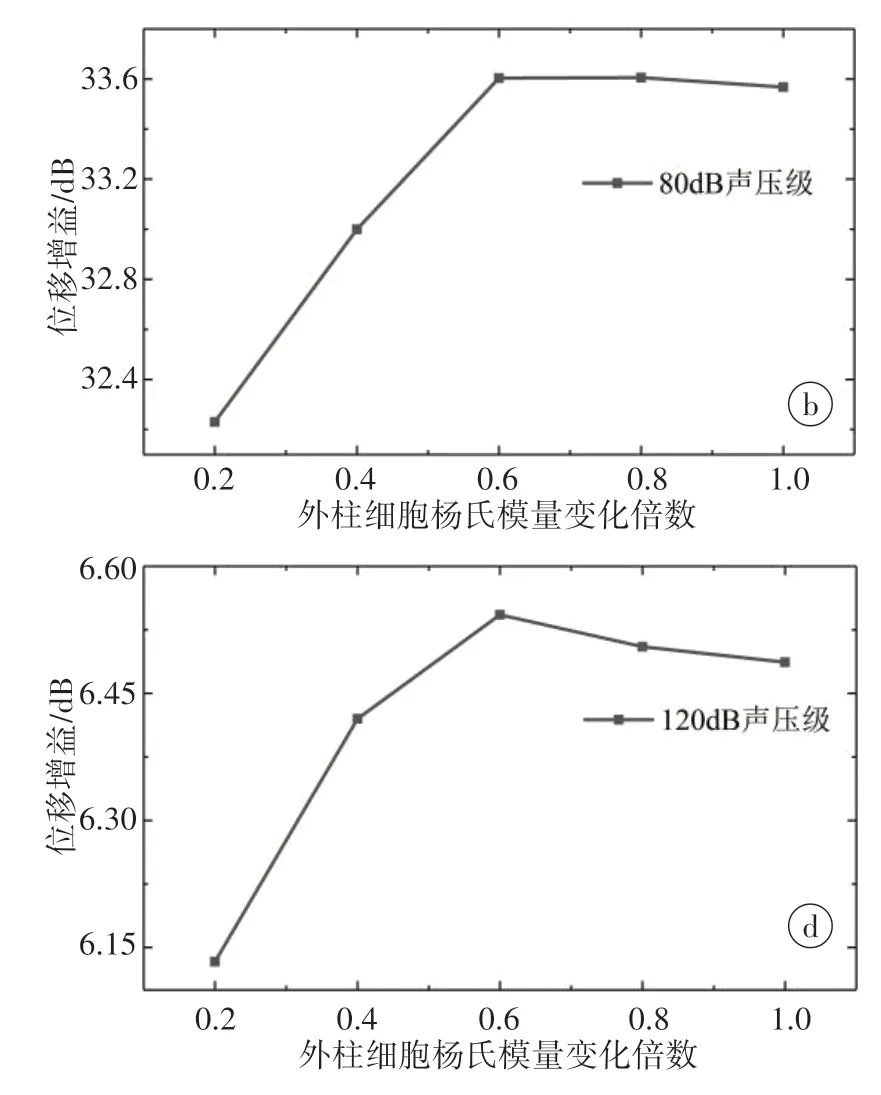
图4 基底膜位移增益变化Figure 4 Displacement gain changes of the basilar membrane
Tolomeo 等[15]的实验结果表明肌动蛋白缺失引起的外柱细胞的刚度降低范围在一个数量级以内,但不能排除其他因素的影响使外柱细胞的刚度产生更大的减小。为探明外柱细胞刚度变化引起的基底膜位移增益的变化规律,本研究计算了杨氏模量为0.01 GPa(正常值的0.01 倍)时的基底膜位移增益,60、80、100、120、140 dB 声压级下的增益值分别为32.19、26.30、16.88、4.11、1.88。可以看出此时的基底膜增益已明显降低。整体而言,外柱细胞刚度降低会使基底膜位移增益减小。因此本研究认为外柱细胞软化具有削弱外毛细胞的主动力对基底膜位移的放大作用的趋势。
2.3 基底膜应力增益
Von Mises应力是基于剪切应变能的一种等效应力,是应力状态的一种表征形式,其表达式为:

其中,σ1、σ2、σ3分别表示第一、二、三主应力。本研究的应力均为Von Mises应力。
图5a显示了基底膜主动应力变化情况。可以看出在声压级增加的过程中,主动应力缓慢降低后快速增加,外柱细胞软化不会改变这一变化趋势,但却能够改变主动应力由缓慢降低向快速增加过渡点的声压级大小以及主动应力的变化范围。高声压级与低声压级下外柱细胞刚度对主动应力的影响是不同的。60、80、100 dB 声压级下主动应力随外柱细胞软化而减小;120、140 dB 声压级下主动应力随外柱细胞软化而增大。图5b~f 显示了不同声压级下应力增益的变化情况。60、80、100 dB声压级下应力增益值为正,并随外柱细胞软化而减小;120、140 dB声压级下应力增益值为负,且随外柱细胞软化而增大。外柱细胞软化使应力增益向0 值方向移动,说明主动应力值逐渐靠向被动应力值。本研究认为在100 dB 和120 dB 声压级之间可能存在一个临界点,该临界点两边外柱细胞软化对基底膜应力变化的影响是截然相反的。

图5 基底膜主动应力与应力增益变化Figure 5 Active stress and stress gain changes of the basilar membrane
2.4 外毛细胞与Deiters细胞结合位置位移增益
按照由内到外的顺序分别将3 排外毛细胞和Deiters 细胞的结合位置编号为I、II、III,如图6所示。图7显示了60、140 dB 声压级下结合点I、II、III 的位移增益在不同外柱细胞杨氏模量下的变化情况,可以看出外柱细胞软化引起的3 个结合点的位移增益变化趋势明显不同。结合点I 和结合点III 的位移增益随外柱细胞软化而减小,结合点II 的位移增益变化趋势与结合点I、III 相反。在60 dB 声压级下,外柱细胞杨氏模量为正常值的0.2 倍时,结合点I、II、III 的位移增益分别为65.862、66.348 和65.392 dB,相比于正常情况下分别变化了-2.646%、+0.205%和-0.479%。140 dB 声压级下外柱细胞杨氏模量为正常值的0.2 倍时,结合点I、II、III 的位移增益分别为24.717、25.654和24.578 dB,相比于正常情况下分别变化了-7.295%、+0.427%和-1.250%。可见结合点I 的变化幅度最大,结合点II、III 的变化幅度相对较小。当外柱细胞杨氏模量降低为正常值的0.2 倍时,3 个结合点的增益大小顺序产生变化,由I>II>III 变为II>I>III。这说明外柱细胞软化会引起外毛细胞和Deiters 细胞结合位置运动优先级产生变化。总体而言,声压级的大小并不会改变结合点位置的位移增益变化趋势,但会影响增益大小,声压级越高结合点的增益越小。

图6 Deiters细胞与外毛细胞结合位置示意图Figure 6 Schematic diagram of the junction between Deiters cells and outer hair cells

图7 60 dB和140 dB声压级下Deiters细胞与外毛细胞结合位置位移增益变化Figure 7 Displacement gain changes at the junction between Deiters cells and outer hair cells at 60 dB and 140 dB sound pressure levels
本模型的计算结果显示外柱细胞杨氏模量变化能够小幅度地改变结合点的位移增益大小,却不能改变位移增益随声压级增大而减小的变化趋势。图8a、c 和e 分别显示了外柱细胞杨氏模量正常时结合点I、II、III主动位移和被动位移的变化情况。可以看出结合点I 的主动位移随声压级的增加而减小,结合点II、III 的结果与之相反,3 个结合点的被动位移均随声压级而增加。结合点II、III主动位移和被动位移随声压级的变化趋势一致,结合点I 主动位移和被动位移随声压级的变化趋势相反。这一发现说明结合点I 位置的主动机制可能有别于结合点II、III。图8b、d 和f 分别显示了外柱细胞杨氏模量为正常值的0.2倍时,结合点I、II、III 主动位移和被动位移的变化情况。外柱细胞软化并没有改变主被动位移随声压级的变化趋势,但是对变化率产生一定的影响。外柱细胞杨氏模量正常时,140 dB 声压级下结合点I 的主动位移为128.34 nm,相比于60 dB 声压级下的主动位移(128.53 nm)变化了-0.148%,然而在外柱细胞杨氏模量为正常值的0.2 倍时(如图8b 所示,60 dB声压级为136.49 nm,140 dB 声压级为134.13 nm),这一变化率为-1.729%,外柱细胞杨氏模量进一步降低为正常值的0.01 倍时(60 dB 声压级为182.55 nm,140 dB 声压级为143.80 nm),这一变化率达到了-21.227%,因此外柱细胞软化会使外毛细胞与Deiters 细胞结合位置产生更宽的位移变化范围。

图8 外柱细胞杨氏模量正常与0.2倍时Deiters细胞与外毛细胞结合位置主被动位移变化Figure 8 Active and passive displacement changes at the junction of Deiters cells and outer hair cells when the Young′s modulus of outer pillar cells is normal and 0.2 times
2.5 外毛细胞与Deiters细胞结合位置应力增益
图9显示了60 dB和140 dB声压级下结合点I、II、III的Von Mises应力增益变化情况。可以看出结合点I、III应力增益随外柱细胞软化而增加,结合点II与之相反。整体来看结合点II应力增益值最大,结合点III次之,结合点I最小。60 dB声压级下外柱细胞杨氏模量为正常值的0.2倍时,结合点I、II、III的应力增益分别为70.492、72.277和70.810 dB,相比正常情况下分别变化了+2.418%、-0.083%和+0.066%。140 dB声压级下外柱细胞杨氏模量为正常值的0.2倍时,结合点I、II、III的应力增益分别为29.048、31.512和29.975 dB,相比正常情况下分别变化了+6.034%、-0.196%和+0.147%。外柱细胞软化对结合点II、III的应力增益影响相对微弱,对结合点I的应力增益影响相对明显。

图9 60 dB和140 dB声压级下Deiters细胞与外毛细胞结合位置应力增益变化Figure 9 Stress gain changes at the junction of Deiters cells and outer hair cells at 60 dB and 140 dB sound pressure levels
本模型的计算结果显示外柱细胞杨氏模量降低能够小幅度地改变结合点的应力增益大小,却不能改变应力增益随声压级增大而减小的变化趋势(如图10a 所示)。图10b~d 显示了外柱细胞杨氏模量正常时结合点I、II、III 主动应力和被动应力的变化情况。可以看出结合点I 的主动应力随声压级的增加而减小,结合点II、III 的结果与之相反,3 个结合点的被动应力均随声压级而增加。结合点II、III主动应力和被动应力随声压级的变化趋势一致,结合点I 主动应力和被动应力随声压级的变化趋势相反,外毛细胞与Deiters 细胞结合位置应力与位移变化趋势一致。

图10 外柱细胞刚度正常时Deiters细胞与外毛细胞结合位置的应力增益和主被动应力变化Figure 10 Stress gain and active and passive stress changes at the junction between Deiters cells and outer hair cells when the outer pillar cell stiffness is normal
3 结论
VASP 缺失会导致外柱细胞软化,本研究通过有限元模型分析了这一病灶对Corti器感音过程中重要位置的力学行为的影响,并得出以下结论:
(1)基底膜位移增益在外柱细胞软化过程中先是缓慢变化,然后快速下降,这两个阶段间存在过渡的变化倍数临界值,且该临界值受声压级的影响,高声压级下该临界值更低。当外柱细胞杨氏模量变化倍数大于该临界值时,位移增益的变化不明显,这说明外柱细胞软化并不会立即影响Corti 器的正常工作,Corti 器的正常功能在大于临界值的范围内得到“缓冲”,软化达到一定程度会削弱外毛细胞的主动力对基底膜位移的放大作用。
(2)在100 dB 和120 dB 声压级之间可能存在一个临界值,外柱细胞软化在该临界值两侧对基底膜应力变化产生的影响是截然相反的。声压级小于临界值时,应力增益为正,且应力增益和主动应力均与外柱细胞刚度呈正相关。大于临界值时,基底膜主动应力会快速增加。外柱细胞软化会导致基底膜应力增益移向0 值,说明主动应力逐渐靠近被动应力,声压级不影响这一变化趋势。
(3)外毛细胞与Deiters 细胞结合点I、III 位移增益与外柱细胞刚度成正相关,结合点II的变化趋势与之相反,高声压级会加剧这种变化。在这种变化趋势下,外柱细胞刚度降低到一定程度后,3 个结合点的位移增益优先级会发生变化。3 个结合点的应力增益变化趋势与位移增益相反,但是主、被动应力值与位移值变化趋势相同。结合点I 的主动位移和主动应力均随声压级升高而减小,外柱细胞杨氏模量越小,主动位移的这一变化越显著。

